Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку химии в 9 классе на тему "Галогены"
Содержание
- 1. Презентация к уроку химии в 9 классе на тему "Галогены"
- 2. Галогены
- 3. Улыбнись новому знанию Давайте изучим мы
- 4. ГалогеныПоложение галогенов в ПСХЭ
- 5. Строение атома
- 6. Строение атома
- 7. Общая характеристика
- 8. История открытия галогеновCl2At
- 9. История открытия фтора
- 10. История открытия хлора
- 11. История открытия брома
- 12. История открытия йода
- 13. История открытия астата
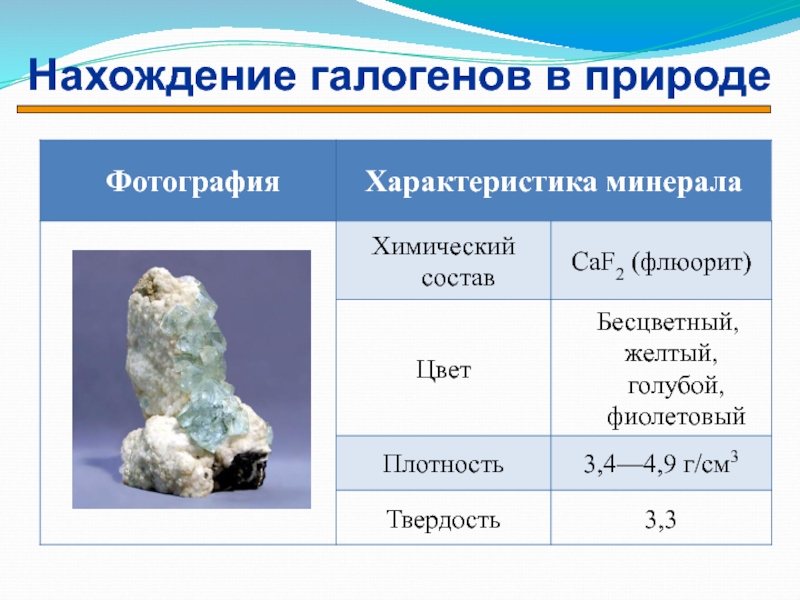
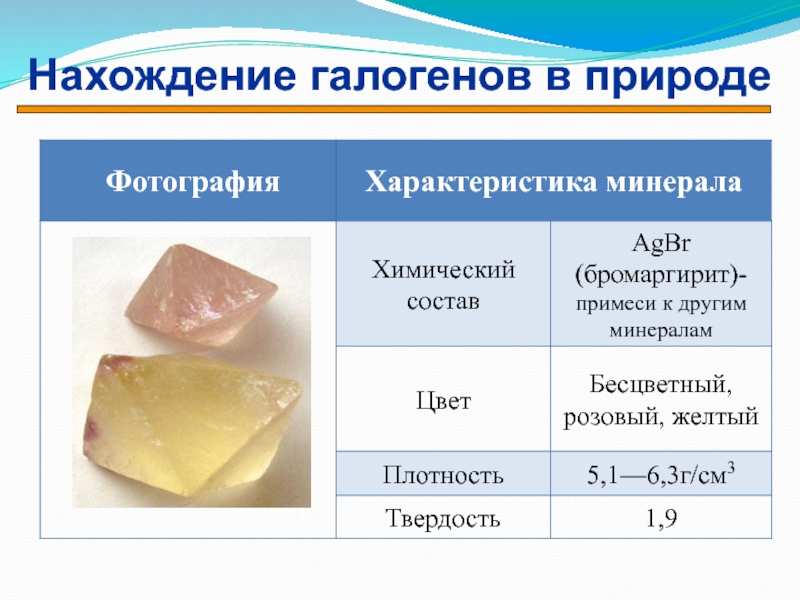
- 14. Нахождение галогенов в природе
- 15. Нахождение галогенов в природе
- 16. Нахождение галогенов в природе
- 17. Нахождение галогенов в природе
- 18. Нахождение галогенов в природе
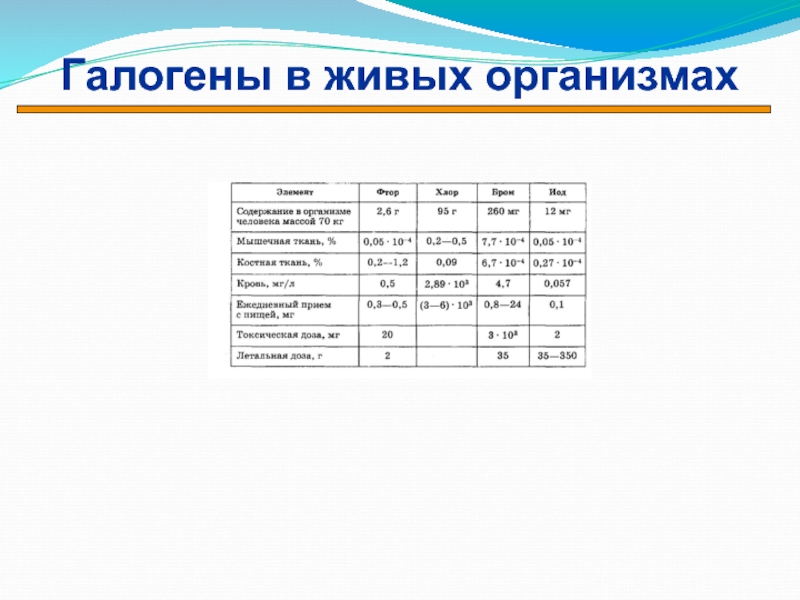
- 19. Галогены в живых организмах
- 20. ФТОРГруппы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798F 19 9 0 10
- 21. Группы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798Cl 35 17 0 10Cl2ХЛОР
- 22. Группы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798Br 80 35 0 10Br2БРОМ
- 23. Группы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798I 127 53 0 10I2ЙОД
- 24. Группы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798At 210 85 0 10At2АСТАТ
- 25. Галогены
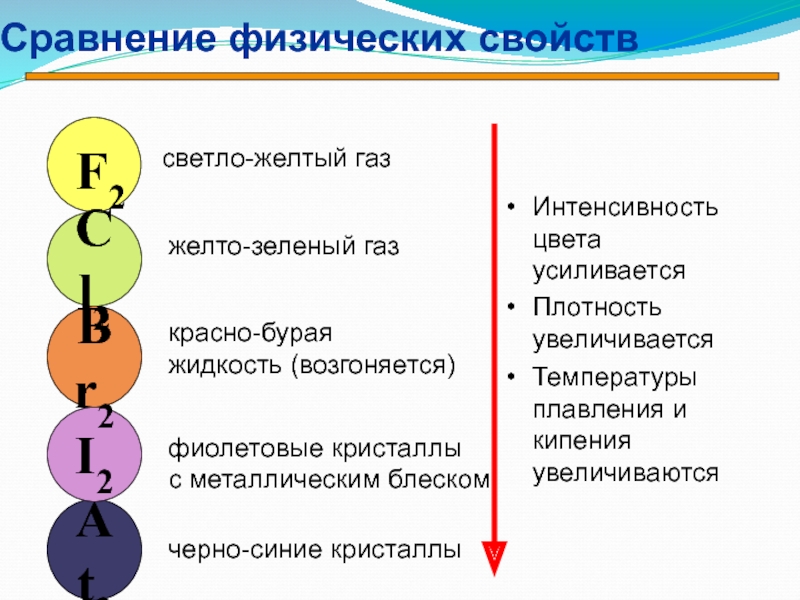
- 26. Сравнение физических свойствИнтенсивность цвета усиливаетсяПлотность увеличиваетсяТемпературы плавления
- 27. Возгонка йодаКристаллический йод обладает способностью при нагревании
- 28. Хлор хвалился: «Нет мне равных!Галоген я -
- 29. Проверить F2
- 30. Слайд 30
- 31. Химические свойства хлораCl2 - сильно реакционоспособен (искл.
- 32. Слайд 32
- 33. Химические свойства бромаBr2 - умеренно реакционоспособен.Вытесняется из солей фтором и хлором.
- 34. Слайд 34
- 35. Химические свойства йодаI2 - мало реакционоспособен.Вытесняется из солей фтором, хлором и бромом.
- 36. Слайд 36
- 37. Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида?
- 38. AgNO3AgClAgBrAgIAgFУравнения реакций:AgNO3 + MeClAgNO3 + MeBrAgNO3 +
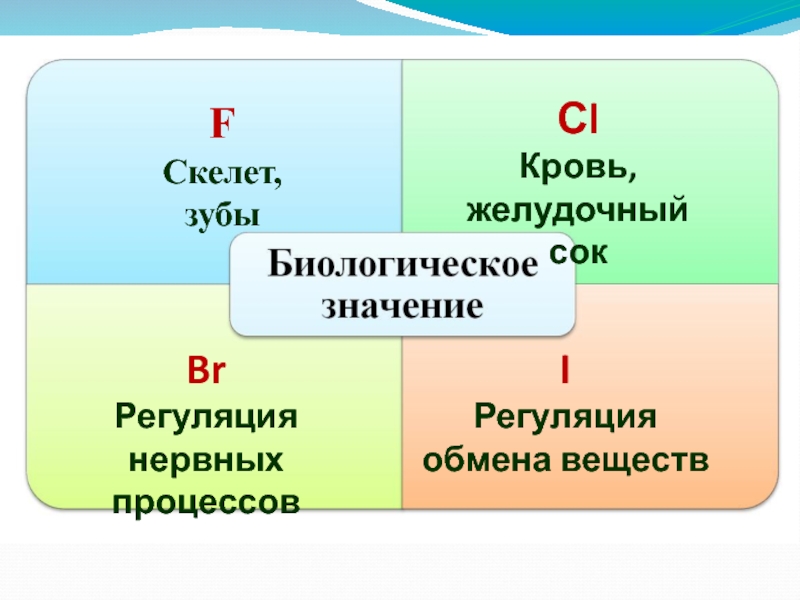
- 39. F Скелет, зубыСlКровь, желудочный сокBrРегуляция нервных процессовIРегуляция обмена веществ
- 40. Применение фтора Тефлон (посуда) Фреон-
- 41. Применение хлораОтбеливателиПроизводство HClПолучение
- 42. Применение бромаЛекарственные препаратыКрасители ФотографияВетеринарные препаратыИнгибиторыкоррозииПрисадки
- 43. Применение йодаЛекарственные препаратыФотографияКрасителиAgI для создания искусственных осадковГалогеновыеэлектролампы
- 44. Спасибо за внимание !
- 45. «Химия в действии», М. Фримантл, М, «Мир»,1991г,
- 46. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Улыбнись новому знанию
Давайте изучим мы сегодня
отменно
элементы галогены.
А
по-русски - солероды,Все – от фтора и до йода.
Даже неустойчивый астат
Быть в семействе этом рад.
Слайд 7Общая характеристика
+9 ) )
2 7
+17 ) ) )
2 8 7
+35 ) ) ) )
2 8 18 7
+53 ) ) ) ) )
2 8 18 18 7
Заряд ядра увеличивается
Радиус атома увеличивается
Количество валентных электронов равно 7
Притяжение валентных электронов к ядру уменьшается
Способность отдавать электроны увеличивается
Неметаллические свойства ослабевают
Окислительная способность уменьшается
Уменьшается электроотрицательность (ЭО)
Увеличивается сила галогеноводородных кислот
Уменьшается кислотный характер высших оксидов.
Слайд 9История открытия фтора
В
1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода,
охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора А. Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины. Анри Муассан
(1852 – 1907 г.)
2HF→H2↑ + F2↑
Слайд 10История открытия хлора
В 1774 году
шведский аптекарь К. Шееле открыл хлор. «Я поместил смесь черной
магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах».В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый).
В 1812 году Гей-Люсеок дал газу название хлор.
Карл Вильгельм Шееле
(1742 – 1786 г.)
MnO2+ 4HCl → Cl2+ MnCl2 + 2H2O
Слайд 11История открытия брома
В 1825 году
французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость,
который он назвал - "мурид" (от латинского слова muria, означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный"). Балар писал: «Точь-в-точь как ртуть есть единственный металл, который имеет жидкую фазу при комнатной температуре, бром есть единственный жидкий неметалл» .Антуан Жером Балар
(1802 – 1876 г.)
2NaBr + Cl2 → 2NaCl + Br2
Слайд 12История открытия йода
В 1811 году
французский химик Бернар Куртуа открыл йод путём перегонки маточных
растворов от азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (фармацевтической фирме в Дижоне.В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров).
Бернар Куртуа (1777 – 1838 г. )
2 NaI + 2 H2SO4 = I2 + SO2 + Na2 SO4 + 2 H2 O
Слайд 13История открытия астата
В 1869
г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем
(как «эка-иод»).Впервые астат был получен искусственно в 1940 г. открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211At они облучали висмут альфа-частицами.
Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.
20983Bi + 42He → 21185At + 2 10n
Эрст Сегре
(1914 – 1985 г.)
Слайд 26Сравнение физических свойств
Интенсивность цвета усиливается
Плотность увеличивается
Температуры плавления и кипения увеличиваются
At2
I2
Br2
Cl2
светло-желтый
газ
желто-зеленый газ
красно-бурая
жидкость (возгоняется)
фиолетовые кристаллы
с металлическим блеском
черно-синие
кристаллыСлайд 27Возгонка йода
Кристаллический йод обладает способностью при нагревании переходить из твердого
состояния в газообразное, минуя жидкое (возгонка), превращаясь в фиолетовые пары.
Слайд 28Хлор хвалился: «Нет мне равных!
Галоген я - самый главный.
Зря болтать
я не люблю:
Всё на свете отбелю!»
Йод красой своей гордился,Твердым был, но испарился.
Фиолетовый как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным. Но румяным.
Бил себя он грозно в грудь:
«Я ведь бром! Не кто-нибудь!..»
Фтор молчал и думал:
«Эх!.. Ведь приду – окислю всех…»
Химические свойства галогенов
Слайд 29Проверить
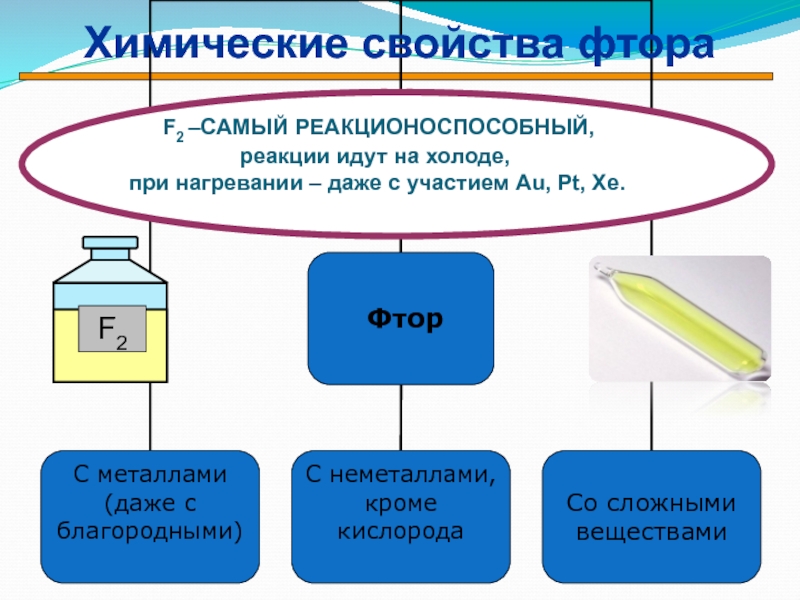
F2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ,
реакции идут на холоде, при нагревании – даже с участием Au, Pt, Xe.
Химические свойства фтора
Слайд 30
С простыми веществами:
С МЕталлами С Неметаллами
2Na + F2 → 2NaF H2 + F2 → 2HF
Mo + 3F2 → MoF6 Xe + 2F2 → XeF4
Со сложными веществами:
2H2O + F2 → 4HF + O2
2KCl + F2 → Cl2 + 2NaF
2KBr + F2 → Br2 + 2КF
2KI + F2 → I2 + 2КF
Химические свойства фтора
Фтор вытесняет любой галоген из соли
Вода горит во фторе фиолетовым пламенем
F2
Слайд 31
Химические свойства хлора
Cl2 - сильно реакционоспособен (искл. C, O2, N2
и некот. др.).
Отбеливает ткани и бумагу.
Слайд 32
С
простыми веществами:С МЕталлами С НЕметаллами
2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 → 2HCl (tº, hυ)
Cu + Cl2 → Cu Cl2 2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
2KBr + Cl2 → Br2 + 2КCl
2KI + Cl2 → I2 + 2КCl
Химические свойства хлора
Горение железа в хлоре
Cl2
Хлор отбеливает ткани за счет атомарного кислорода, выделяемого из НClO
Слайд 33Химические свойства брома
Br2 - умеренно реакционоспособен.
Вытесняется из солей фтором и
хлором.
Слайд 34
С простыми веществами:
С МЕталлами С НЕметаллами
2Fe + 3Br2 → 2FeBr3 H2 + Br2 → 2HBr
Cu + Br2 → Cu Br2 2P + 5Br2 → 2PBr5
Со сложными веществами:
Br2 + H2O → HBr + HBrO
2KI + Br2 → I2 + 2КCl
Химические свойства брома
Чаще чем фтор и хлор используется в органическом синтезе
Обладает высокой селективностью (избирательностью)
Br2
Слайд 35Химические свойства йода
I2 - мало реакционоспособен.
Вытесняется из солей фтором, хлором
и бромом.
Слайд 36
С простыми веществами:
С металлами С неметаллами
Hg + I2 → HgI2 H2 + I2 → 2HI (tº)
2Al + 3I2 → 2AlI3 2P + 3Br2 → 2PI3
Со сложными веществами:
I2 + H2O → HI + HIO (практически не идет)
I2 + р-р крахмала → темно-синее окрашивание
Химические свойства йода
I2
Окисляется конц. серной и азотной кислотами
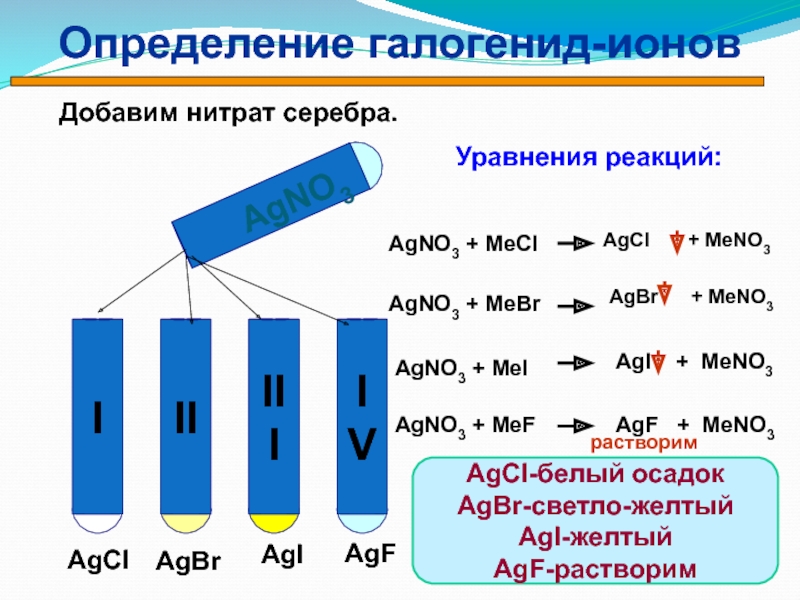
Слайд 37Определение галогенид-ионов
Определить в какой пробирке находится раствор хлорида, бромида,
иодида, фторида
?
Слайд 38AgNO3
AgCl
AgBr
AgI
AgF
Уравнения реакций:
AgNO3 + MeCl
AgNO3 + MeBr
AgNO3 + MeI
AgNO3 + MeF
растворим
AgCl
+ MeNO3
Добавим нитрат
серебра.AgBr + MeNO3
AgI + MeNO3
AgF + MeNO3
Определение галогенид-ионов
AgCl-белый осадок
AgBr-светло-желтый
AgI-желтый
AgF-растворим
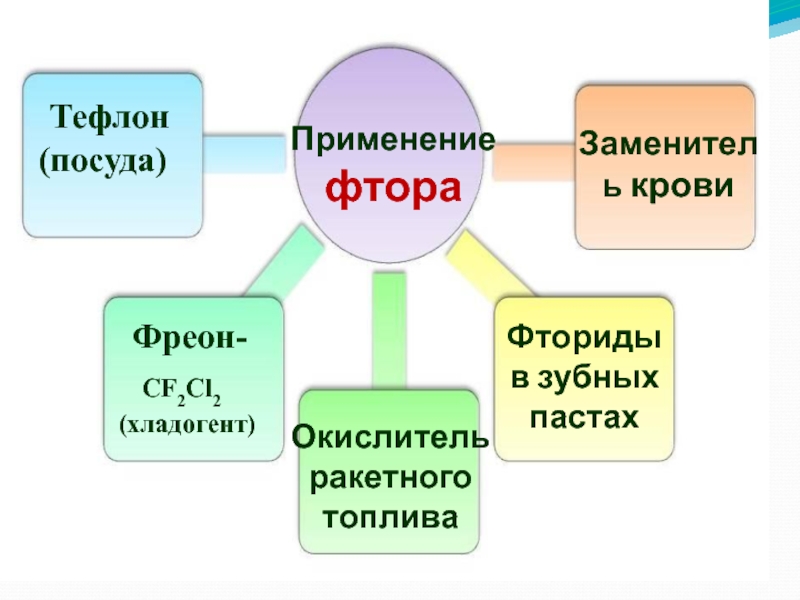
Слайд 40Применение фтора
Тефлон
(посуда)
Фреон-
CF2Cl2
(хладогент)
Окислитель ракетного топлива
Заменитель крови
Фториды
в зубных пастах Слайд 41
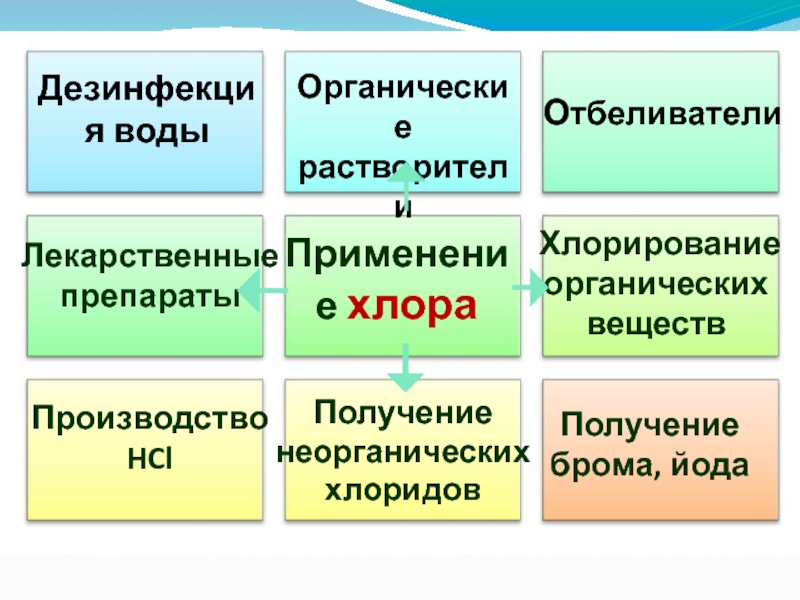
Применение хлора
Отбеливатели
Производство
HCl
Получение брома,
йода
Дезинфекция воды
Органические растворители
Лекарственные препараты
Хлорирование органических веществ
Получение
неорганических хлоридов