Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Типы химических реакций в органической химии
Содержание
- 1. Типы химических реакций в органической химии
- 2. Типы химических реакций в органической химии.
- 3. ЦЕЛЬ УРОКА: познакомиться
- 4. КРИТЕРИИ ОЦЕНКИСумма баллов
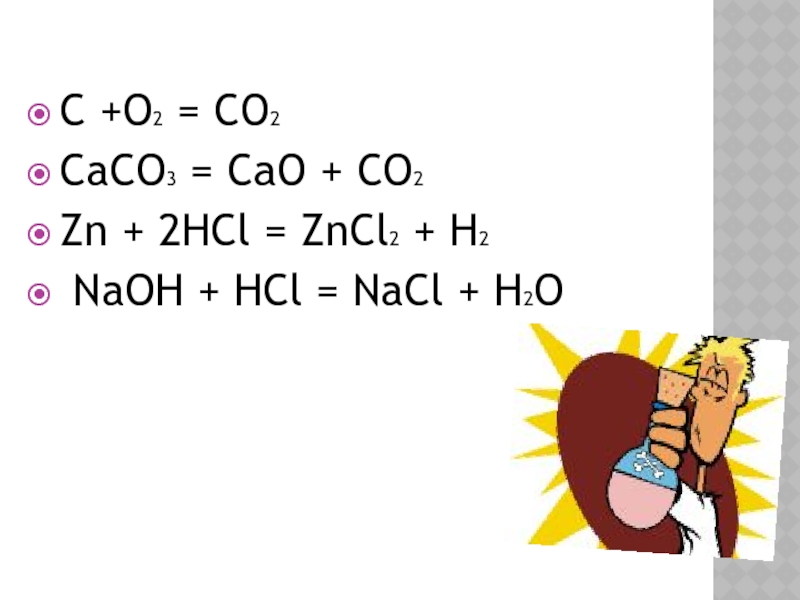
- 5. Реакции органических веществ можно разделить на четыре
- 6. Реакции замещенияРеакции замещения - реакции, в результате
- 7. МетанМетан – алкан (предельный углеводород).Атом углерода в
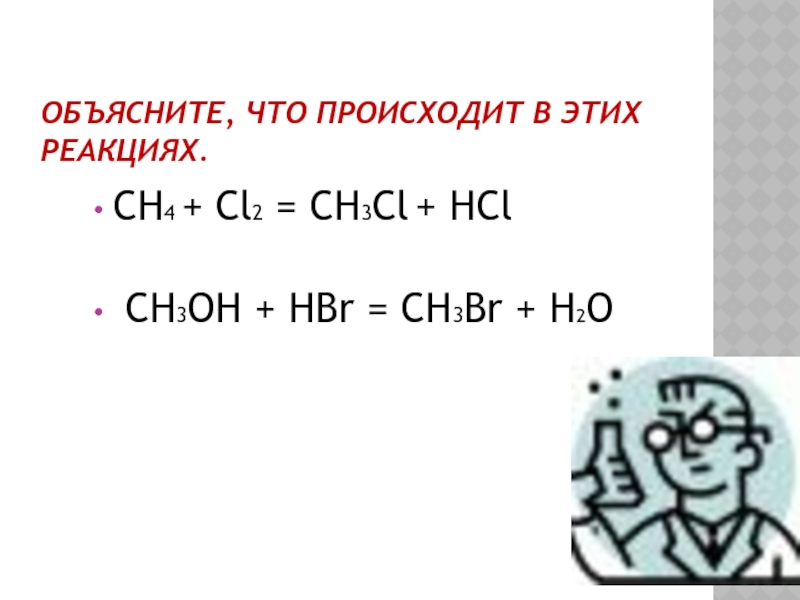
- 8. ОБЪЯСНИТЕ, ЧТО ПРОИСХОДИТ В ЭТИХ РЕАКЦИЯХ.CH4 +
- 9. ЛАБОРАТОРНЫЙ ОПЫТ.
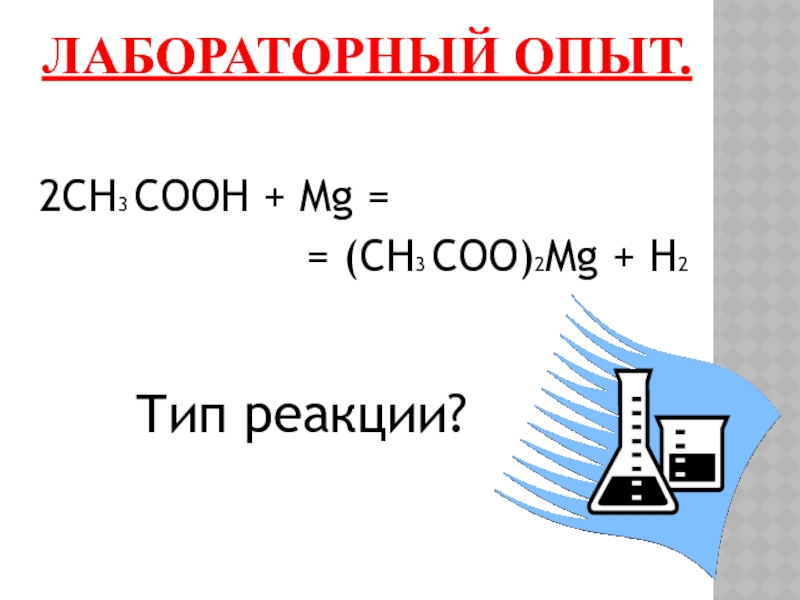
- 10. ЛАБОРАТОРНЫЙ ОПЫТ.2CH3 COOH + Mg =
- 11. Реакции присоединения. Реакции присоединения – реакции, в
- 12. Ацетилен Этин (ацетилен) относится к классу Алкинов,
- 13. Слайд 13
- 14. Реакции присоединения-1.Гидрирование.
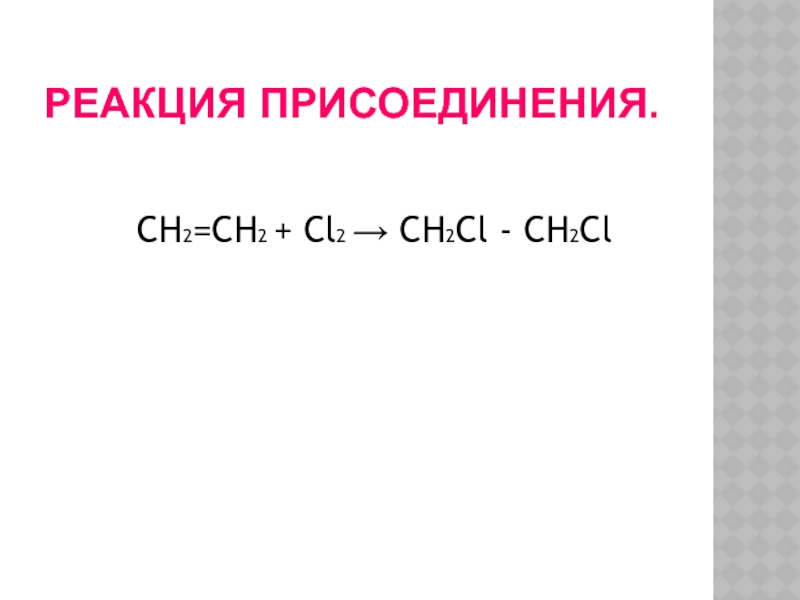
- 15. РЕАКЦИЯ ПРИСОЕДИНЕНИЯ. CH2=CH2 + Cl2 → CH2Cl - CH2Cl
- 16. РЕАКЦИИ ОТЩЕПЛЕНИЯ.Реакции отщепления – реакции,
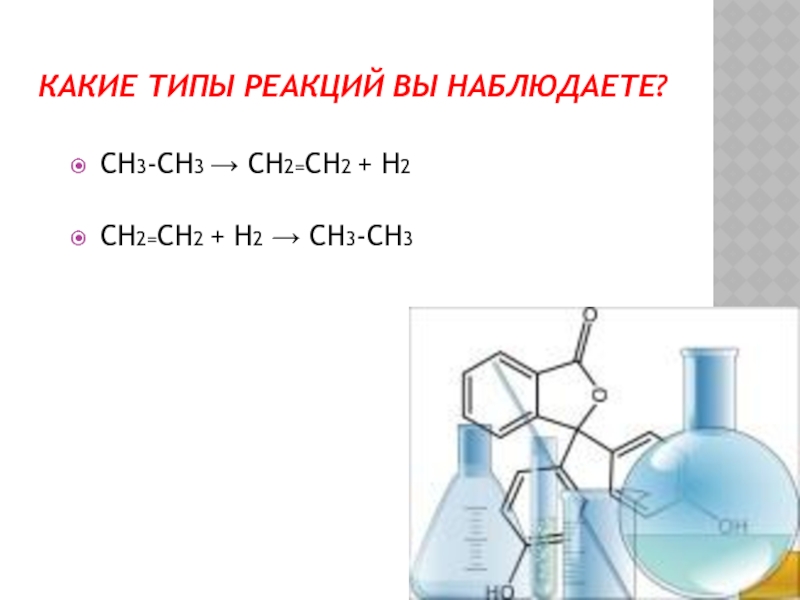
- 17. КАКИЕ ТИПЫ РЕАКЦИЙ ВЫ НАБЛЮДАЕТЕ?CH3-CH3 → CH2=CH2 + H2CH2=CH2 + H2 → CH3-CH3
- 18. ЛАБОРАТОРНЫЙ ОПЫТ. Получение этилена
- 19. ЛАБОРАТОРНЫЙ ОПЫТ.
- 20. РЕАКЦИИ ИЗОМЕРИЗАЦИИ.Реакции изомеризации – реакции, в результате
- 21. Слайд 21
- 22. ЗАДАНИЕ.1 вариант. 1. Присоединения, гидрирование.
- 23. ДОМАШНЕЕ ЗАДАНИЕ.
- 24. ПОДВЕДЁМ ИТОГИ УРОКА.
- 25. Слайд 25
- 26. Как я чувствовал себя на уроке? С
- 27. СПАСИБО
- 28. Скачать презентанцию
Типы химических реакций в органической химии.
Слайды и текст этой презентации
Слайд 3ЦЕЛЬ УРОКА:
познакомиться
с классификацией
органических реакций
по характеру химических
превращений.
Слайд 5Реакции органических веществ можно разделить на четыре типа:
Замещения;
Присоединения;
Отщепления (элиминирования);
Перегруппировки (изомеризации)
Субстрат
– это главное органическое вещество, которое участвует в реакции.
Реагент –
это другой компонент этой реакции.Слайд 6Реакции замещения
Реакции замещения - реакции, в результате которых происходит замена
одного атома или группы атомов в исходной молекуле на другие
атомы или группы атомов.Характерны для веществ, имеющих простые одинарные связи.
Происходят при сильном освещении.
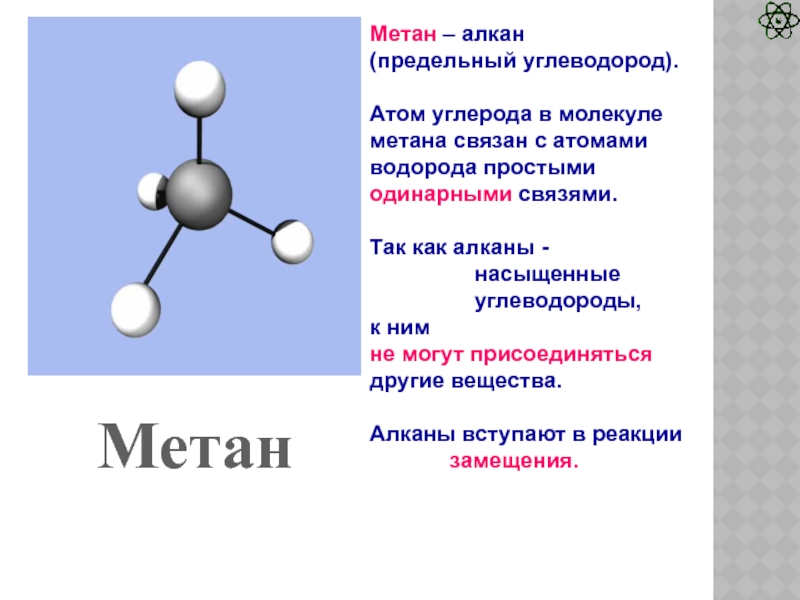
Слайд 7Метан
Метан – алкан
(предельный углеводород).
Атом углерода в молекуле метана связан
с атомами водорода простыми одинарными связями.
Так как алканы -
насыщенные
углеводороды,
к ним
не могут присоединяться другие вещества.
Алканы вступают в реакции
замещения.
Слайд 9ЛАБОРАТОРНЫЙ ОПЫТ.
Соедините
уксусную кислоту и порошок магния.
Что наблюдаете?К какому типу относится эта реакция?
Напишите уравнение реакции.
Слайд 11Реакции присоединения.
Реакции присоединения – реакции, в результате которых два
или более молекул реагирующих веществ соединяются в одну.
Происходят
с веществами, у которых есть двойные или тройные связи.
Эти вещества называются алкены и алкины,
например, этен С2Н4 и этин С2Н2
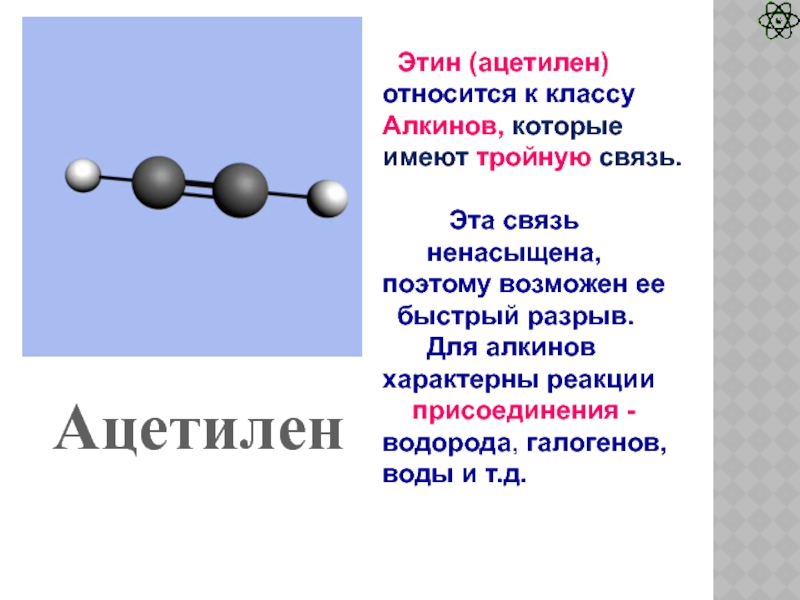
Слайд 12Ацетилен
Этин (ацетилен) относится к классу Алкинов, которые имеют тройную
связь.
Эта связь
ненасыщена,
поэтому возможен ее
быстрый разрыв.
Для алкинов характерны реакции
присоединения - водорода, галогенов, воды и т.д.
Слайд 13
Реакции присоединия-
1.Гидрирование.
2.Галогенирование:
фторирование;
хлорирование;
бромирование;
иодирование.
3.Гидрогалогенирование:
гидрофторирование;
гидрохлорирование;
гидробромирование;
гидроиодирование.
4.Гидратация.
Слайд 14
Реакции присоединения-
1.Гидрирование.
+Н2
2.Галогенирование:
фторирование; +F2 хлорирование; +Cl2
бромирование; +Br2
иодирование. +J2
3.Гидрогалогенирование:
гидрофторирование; +HF
гидрохлорирование; +HCl
гидробромирование; +HBr
гидроиодирование. +HJ
4.Гидратация. + Н2O
Слайд 16 РЕАКЦИИ ОТЩЕПЛЕНИЯ.
Реакции отщепления – реакции, в результате которых
из одного соединения образуется несколько новых соединений.
Реакции отщепления являются обратными
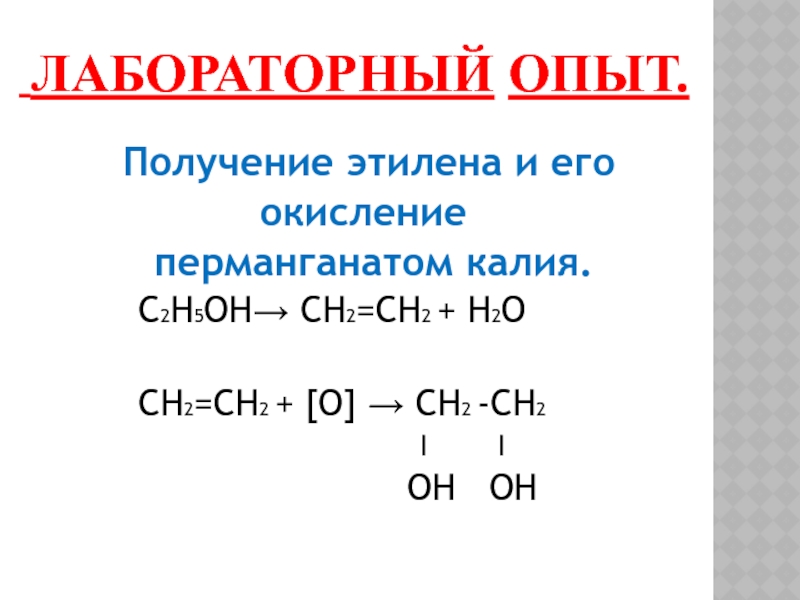
процессами реакций присоединения.Слайд 19 ЛАБОРАТОРНЫЙ ОПЫТ.
Получение этилена
и его
окисление перманганатом калия.
C2H5OH→ CH2=CH2 + H2O
CH2=CH2 + [O] → CH2 -CH2
I I
OH OH
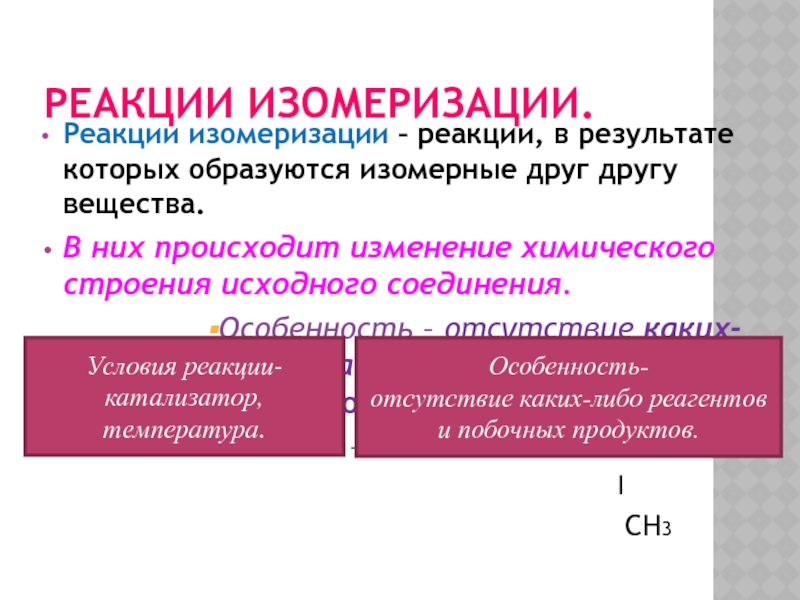
Слайд 20РЕАКЦИИ ИЗОМЕРИЗАЦИИ.
Реакции изомеризации – реакции, в результате которых образуются изомерные
друг другу вещества.
В них происходит изменение химического строения исходного соединения.
Особенность
– отсутствие каких-либо реагентов и побочных продуктовCH3-CH2-CH2-CH3 → CH3 –CH -CH3
I
CH3
Условия реакции-
катализатор,
температура.
Особенность-
отсутствие каких-либо реагентов и побочных продуктов.
Слайд 22ЗАДАНИЕ.
1 вариант.
1. Присоединения, гидрирование.
2. Изомеризация.
3. Элиминирование, дегидратация.
4. Отщепления, дегидрирование.
5. Присоединения,
бромирование.2 вариант.
1. Элиминирование, дегидрирование.
2. Присоединения, гидрирование.
3. Присоединения, гидратация.
4. Изомеризация.
5. Присоединения, хлорирование.
Слайд 23ДОМАШНЕЕ ЗАДАНИЕ.
Разработать памятку
в виде схемы, таблицы
диаграммы
по определению
типов химических реакций
в органической химии.
Слайд 26
Как я чувствовал себя на уроке?
С каким настроением работал?
Доволен
ли уроком?Какие затруднения возникали?
Как преодолеть эти учебные
проблемы?