Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация. Основные положения теории электролитической диссоциации
Содержание
- 1. Презентация. Основные положения теории электролитической диссоциации
- 2. Цели урока:1.Сформулировать основные положения теории электролитической диссоциации.2.Закрепить
- 3. ПРОВЕРЬ СВОИ ЗНАНИЯВещества, растворы которых проводят электрический
- 4. ПРОВЕРЬ СВОИ ЗНАНИЯВещества, растворы которых проводят электрический
- 5. Задание Распределите вещества на электролиты и неэлектролиты: NaCl(р-р), глюкоза(р-р), NaOH(р-р), HCl(р-р), спирт(р-р), сахар(р-р)
- 6. Испытание веществ на электрическую проводимость (видеофрагмент)
- 7. С каким типом связи характерны этапы растворения
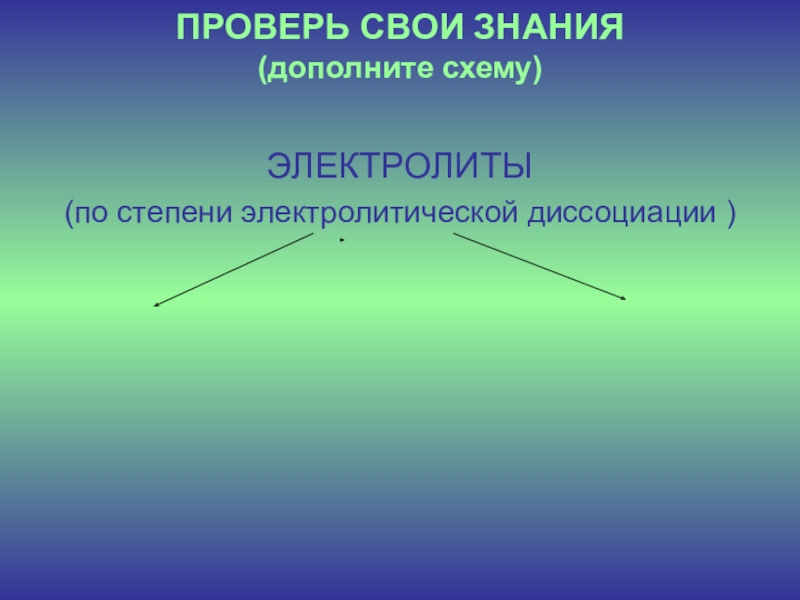
- 8. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему) ЭЛЕКТРОЛИТЫ(по степени электролитической диссоциации )
- 9. Вопрос Кто является основателем теории электролитической диссоциации?
- 10. История открытия теории электролитической диссоциации В
- 11. Основные положения ТЭДПри растворении в воде электролиты
- 12. ИОНЫ (по составу) ПРОСТЫЕ Например:
- 13. Основные положения ТЭД2. Причиной диссоциации электролита в
- 14. ИОНЫ (по наличию водной оболочки)ГИДРАТИРОВАННЫЕ(в растворах и
- 15. Основные положения ТЭД3. Под действием электрического тока
- 16. ИОНЫ (по знаку заряда)КАТИОНЫ положительно заряженные частицыАНИОНЫ отрицательно заряженные частицы
- 17. Основные положения ТЭД 4. Электролитическая диссоциация –
- 18. Основные положения ТЭД 5. Не все электролиты в одинаковой мере диссоциируют на ионы.
- 19. ЭЛЕКТРОЛИТЫ(по степени диссоциации) СЛАБЫЕ
- 20. Основные положения ТЭД6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- 21. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов)КИСЛОТЫ
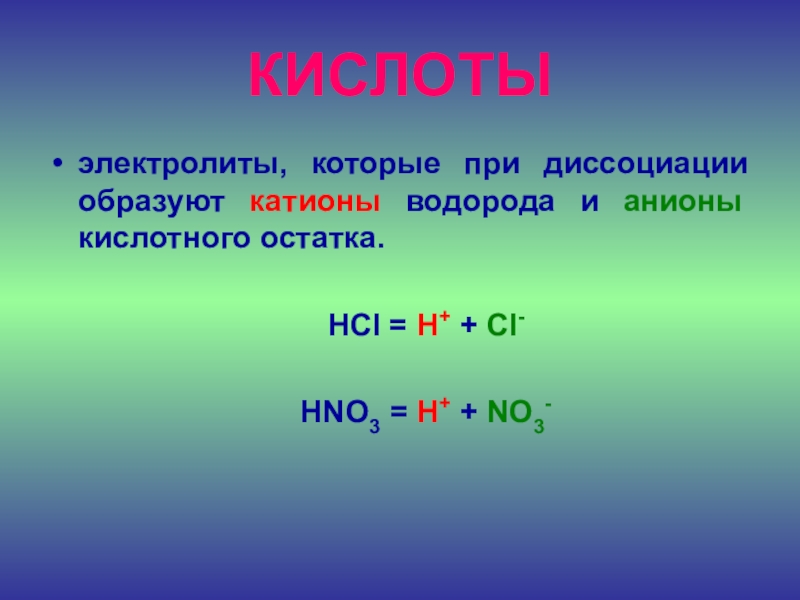
- 22. КИСЛОТЫэлектролиты, которые при диссоциации образуют катионы водорода
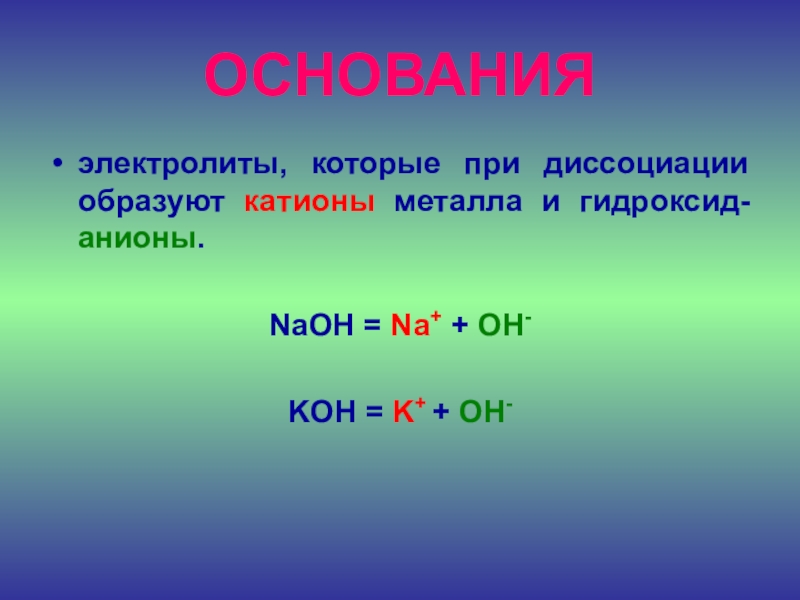
- 23. ОСНОВАНИЯэлектролиты, которые при диссоциации образуют катионы металла
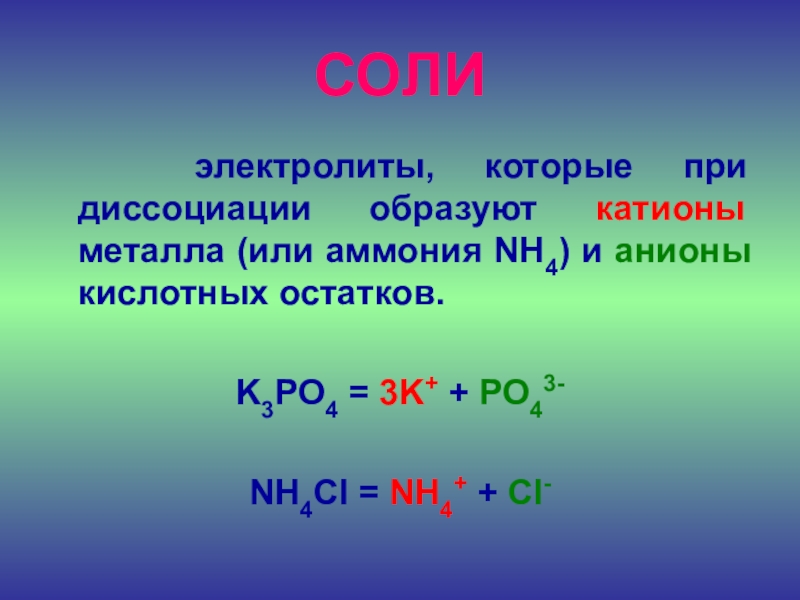
- 24. СОЛИ электролиты, которые при диссоциации образуют
- 25. ЗакреплениеВариант 11. Катион - это А)
- 26. ОтветыВариант 11. А2. Б3. В4. В5. АВариант 21. В2. Б3. Г4. Г5. А
- 27. ДОМАШНЕЕ ЗАДАНИЕ§ 36, упр. 1(б, в), 3, 4, 5 ( по учебнику Габриеляна О.С., 8 класс)
- 28. 1. На уроке было над чем
- 29. СПАСИБО за урок!
- 30. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Выполнила: Гуня Марина Александровна, учитель химии
МБОУ Дубровская СОШ им. Н.П.Сергеенко, 2015 год
Слайд 2Цели урока:
1.Сформулировать основные положения теории электролитической диссоциации.
2.Закрепить понятия: ион, катион,
анион, гидратированные и негидратированные ионы.
3.Рассмотреть примеры диссоциации солей, кислот и
щелочей.Слайд 3ПРОВЕРЬ СВОИ ЗНАНИЯ
Вещества, растворы которых проводят электрический ток, называют ………
Процесс
распада электролита на ионы называют ……..
Вещества, растворы которых не проводят
электрический ток, называют ……….Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют …………
Слайд 4ПРОВЕРЬ СВОИ ЗНАНИЯ
Вещества, растворы которых проводят электрический ток, называют электролитами
Процесс
распада электролита на ионы называют электролитической диссоциацией
Вещества, растворы которых не
проводят электрический ток, называют неэлектролитамиОтношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют степенью диссоциации
Слайд 5Задание
Распределите вещества на электролиты и неэлектролиты:
NaCl(р-р), глюкоза(р-р), NaOH(р-р),
HCl(р-р), спирт(р-р), сахар(р-р)
Слайд 7С каким типом связи характерны этапы растворения веществ:
А. 1)ориентация молекул
2)гидратация молекул
3)диссоциация кристалла электролита.
Б. 1)ориентация молекул
2)гидратация молекул3) ионизация молекул
4)диссоциация кристалла электролита.
Ответ обоснуйте.
Слайд 10История открытия теории электролитической диссоциации
В 1887 году шведский
химик Сванте Аррениус сформулировал основные положения теории электролитической диссоциации
Слайд 11Основные положения ТЭД
При растворении в воде электролиты диссоциируют (распадаются) на
положительные и отрицательные ионы.
NaCl = Na+ + Cl-
Ионы – это одна из форм существования химического элементаСлайд 13Основные положения ТЭД
2. Причиной диссоциации электролита в водном растворе является
его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв
химической связи в нем.Слайд 14ИОНЫ
(по наличию водной оболочки)
ГИДРАТИРОВАННЫЕ
(в растворах и кристаллогидратах)
Например:
CuSO4 * 5H2O
НЕГИДРАТИРОВАННЫЕ
(в
безводных солях)Например:
Cu2+SO42-
Na+NO3-
Слайд 15Основные положения ТЭД
3. Под действием электрического тока положительно заряженные
ионы движутся к отрицательному полюсу источника тока – катоду, поэтому
их называют катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду, поэтому их называют анионами.Слайд 16ИОНЫ
(по знаку заряда)
КАТИОНЫ
положительно заряженные частицы
АНИОНЫ
отрицательно заряженные
частицы
Слайд 17Основные положения ТЭД
4. Электролитическая диссоциация – процесс обратимый для
слабых электролитов.
Наряду с процессом диссоциации протекает и обратный
процесс – ассоциация (соединение ионов)HNO2 H+ + NO2-
Слайд 20Основные положения ТЭД
6. Химические свойства растворов электролитов определяются свойствами тех
ионов, которые они образуют при диссоциации.
Слайд 22КИСЛОТЫ
электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного
остатка.
HCl = H+ + Cl-
HNO3 = H+ + NO3-Слайд 23ОСНОВАНИЯ
электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы.
NaOH
= Na+ + OH-
KOH = K+ + OH-
Слайд 24СОЛИ
электролиты, которые при диссоциации образуют катионы металла (или
аммония NH4) и анионы кислотных остатков.
K3PO4 = 3K+ +
PO43-NH4Cl = NH4+ + Cl-
Слайд 25Закрепление
Вариант 1
1. Катион - это
А) положительно заряженный ион
Б) отрицательно заряженный ион
В) ион, не имеющий заряда Г) нейтрально заряженный ион
2. Анион - это
А) положительно заряженный ион
Б) отрицательно заряженный ион
В) ион, не имеющий заряда
Г) нейтрально заряженный ион
3. Хлорид-анион имеет заряд:
А) +2 Б) +1 В) -1 Г) -2
4. Катион магния имеет заряд:
А) 0 Б) +1 В) +2 Г) +3
5. Укажите правильное уравнение диссоциации сульфата натрия
А) Na2SO4 = 2Na 1+ + SO4 2-
Б) Na2SO3 = 2Na 1+ + SO3 2-
В) Na2SO4 = Na 2+ + SO4 2-
Г) NaSO4 = Na 1+ + SO4 2-
Вариант 2
1. Анион – это
А) ион, не имеющий заряда Б) положительно заряженный ион
В) отрицательно заряженный ион Г) нейтрально заряженный ион
2. Катион – это
А) ион, не имеющий заряда Б) положительно заряженный ион
В) отрицательно заряженный ион Г) нейтрально заряженный ион
3. Сульфат-анион имеет заряд:
А) +2 Б) +1 В) -1 Г) -2
4. Катион алюминия имеет заряд:
А) 0 Б) +1 В) +2 Г) +3
5. Укажите правильное уравнение диссоциации фосфата натрия
А) Na3РO4 = 3Na 1+ + РO4 3-
Б) Na3РO3 = 3Na 1+ + РO3 3-
В) Na3РO4 = Na 3+ + РO4 3-
Г) NaРO4 = Na 1+ + РO4 3-
Слайд 28
1. На уроке было над
чем подумать
2. Я
понял(а) новую тему
3. На все возникшие у меня
вопросы я получил(а) ответы4. На уроке я поработал(а)
добросовестно
5. Оцените свою работу на уроке по пятибалльной системе.
Ответьте на утверждение
«да» или «нет»: