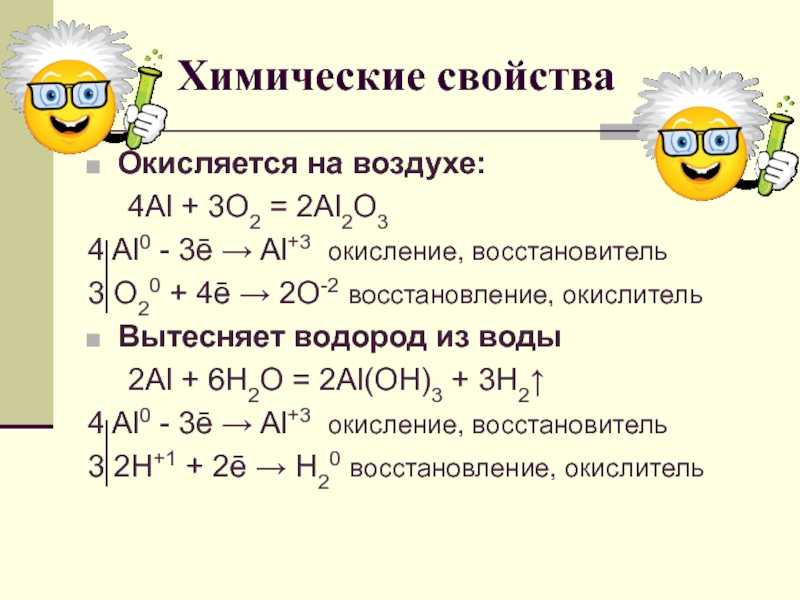
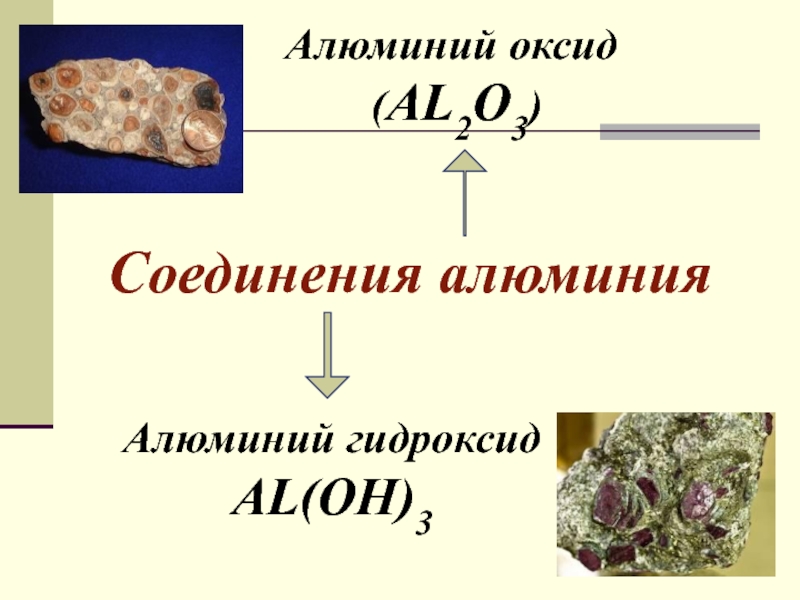
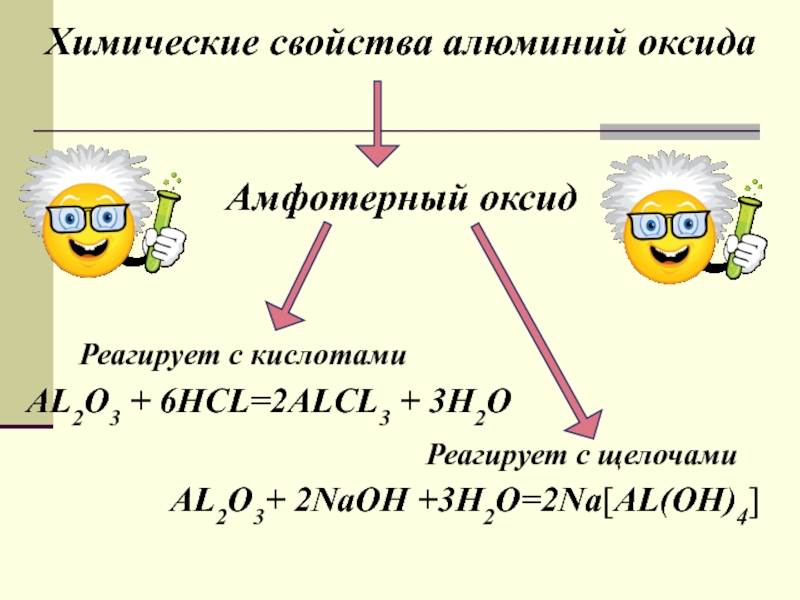
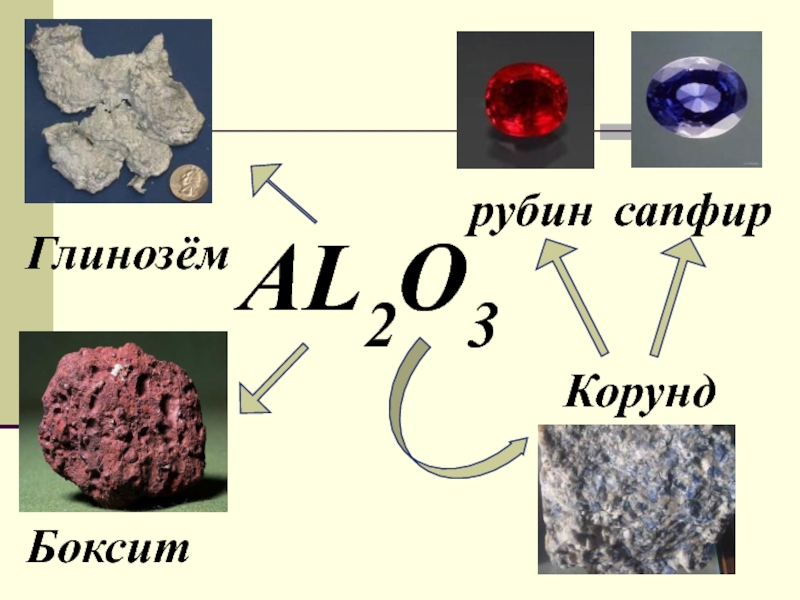
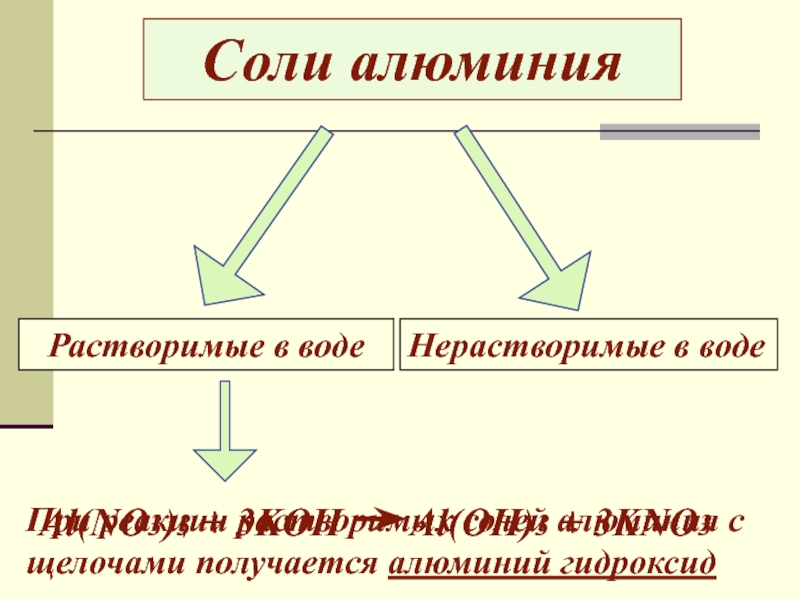
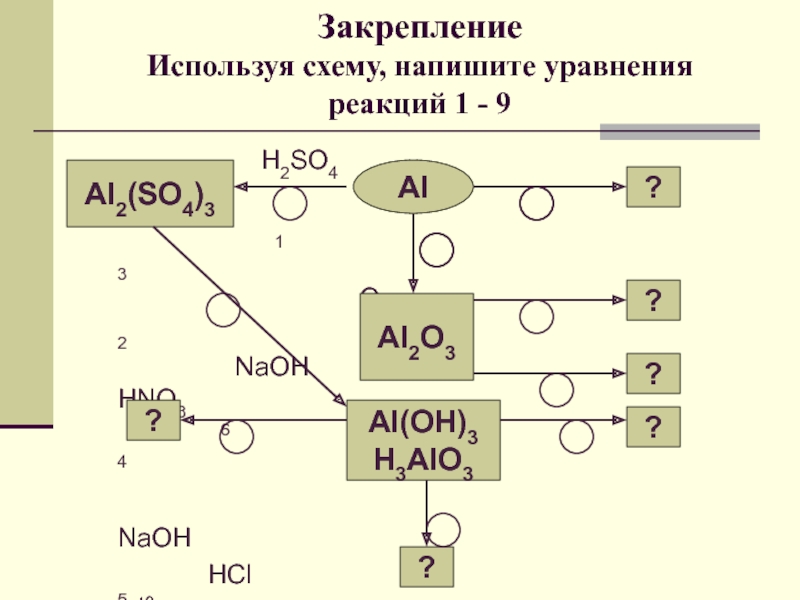
урока:
Ознакомить с физико-химическими свойствами алюминия и его соединений.
Установить взаимосвязь
свойств алюминия и его строения.Ознакомить с важнейшими соединениями алюминия и выяснить их практическое значение.
Al