Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соединения химических элементов. Степень окисления
Содержание
- 1. Соединения химических элементов. Степень окисления
- 2. Бинарные соединения – сложные вещества, состоящие из
- 3. Степень окисления – это условный заряд атомов
- 4. Элементы с постоянной степенью окисленияЩелочные металлы (
- 5. Водород и кислород в большинстве
- 6. Степень окисления сокращённо обозначают с.о. Для
- 7. Определите самостоятельно с.о. элементов в следующих соединениях:
- 8. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Соединения химических элементов
Степень окисления
Составила учитель химии
МБОУ «Октябрьская ООШ №2»
Потапова Нина
Ивановна
Слайд 2Бинарные соединения – сложные вещества, состоящие из двух химических элементов.
NaCl
Хлорид натрия
Na0+Cl0=Na+Cl‾
Связь ионная
+11Na )2)8)1
Атом натрия передал свой внешний
электрон атому хлора и превратился с зарядом +1, а атом хлора принял электрон и превратился в ион с зарядом -1
HCl
Хлороводород
Hδ+Clδ-
Связь ковалентная полярная
+1Н )1 +17Cl )2)8)7
В молекуле хлороводорода связь образуется за счёт спаривания одиночных внешних электронов и образования общей электронной пары, которая смещена в сторону более электроотрицательного атома хлора.
Слайд 3Степень окисления – это условный заряд атомов химических элементов в
соединении. Она может иметь отрицательное, положительное или нулевое значение. Ставится
над символом элемента сверху.Необходимо запомнить!
В соединениях с ионной связью степени окисления элементов равны зарядам ионов.
Na+1Cl-1, Ca+2F2-1, Mg+2O-2.
В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степень окисления элементов равна нулю.
H2º, Cl2º, O2º, F2º, Siº, Cº, Sº …
В соединениях с ковалентной полярной связью степень окисления элемента – это условный заряд его атома в молекуле, если считать, что молекула состоит из ионов.
H+1Cl-1, H2+1O-2
Алгебраическая сумма степеней окисления в соединении всегда равна нулю.
Слайд 4Элементы с постоянной степенью окисления
Щелочные металлы ( I группа, главная
подгруппа) +1
Li, Na, K, Rb, Cs, Fr
Элементы
II группы (кроме Hg) +2Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
Алюминий Al +3
Фтор F -1
Все другие элементы имеют переменную степень окисления
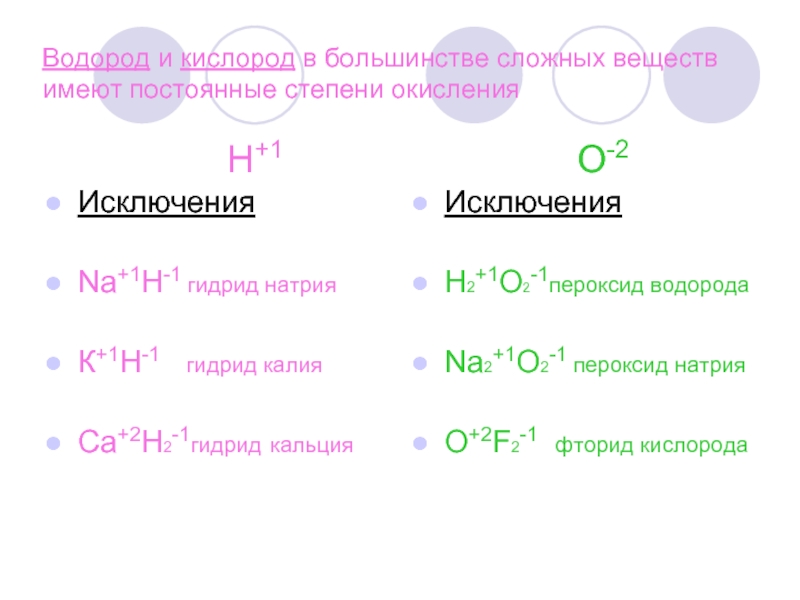
Слайд 5 Водород и кислород в большинстве сложных веществ имеют постоянные степени
окисления
Н+1 О-2
Исключения
Na+1H-1 гидрид натрия
К+1Н-1 гидрид калия
Са+2Н2-1гидрид кальция
Исключения
Н2+1О2-1пероксид водорода
Na2+1O2-1 пероксид натрия
O+2F2-1 фторид кислорода
Слайд 6Степень окисления сокращённо обозначают с.о. Для того, чтобы рассчитать с.о.
одного элемента в соединении, надо знать с.о. другого элемента.
Найдите
с.о. хлора в соединениях Cl2O, Cl2O7. Мы знаем с.о. кислорода Cl2O-2.
Определим общий отрицательный заряд кислорода:
(-2)·1=-2
Общий заряд двух атомов хлора должен быть +2, чтобы суммарная с.о. была =0.
Найдём заряд одного атома хлора:
(+2) : 2=+1
Следовательно степень окисления хлора =+1
Cl2+1O-2
Слайд 7Определите самостоятельно с.о. элементов в следующих соединениях: NO, NO2, CuCl2-1, CuCl-1,
BaH2, MgF2, Al2S3.
Проверьте себя:
N+2O-2, N+4O2-2, Cu+2Cl2-1, Cu+1Cl-1, Ba+2H2-1, Mg+2F2-1, Al2+3S3-2.
Домашнее
задание: § 17 (ст. 26-28)Определите с.о. элементов в следующих соединениях:
N2O5, N2O3, K3N, Ca3N2, MnCl2, MnCl4, PCl3, PCl5.