Слайд 1Электролиты и неэлектролиты . Электролитическая диссоциация
Электролитами называют вещества, растворы
или расплавы которых проводят электрический ток
Н/р: соли, кислоты, основания.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток.
Н/р: многие органические вещества (сахар, эфир, бензол и др.)
Слайд 2Процесс распада электролитов на ионы в водном растворе или расплаве
называется электролитической диссоциацией.
Положительные ионы называют катионами,
отрицательные ионы –
анионами.
К катионам относятся: ион водорода и ионы металлов, катионы основных солей.
К анионам относятся: гидроксид-ион, ионы кислотных остатков, анионы кислых солей.
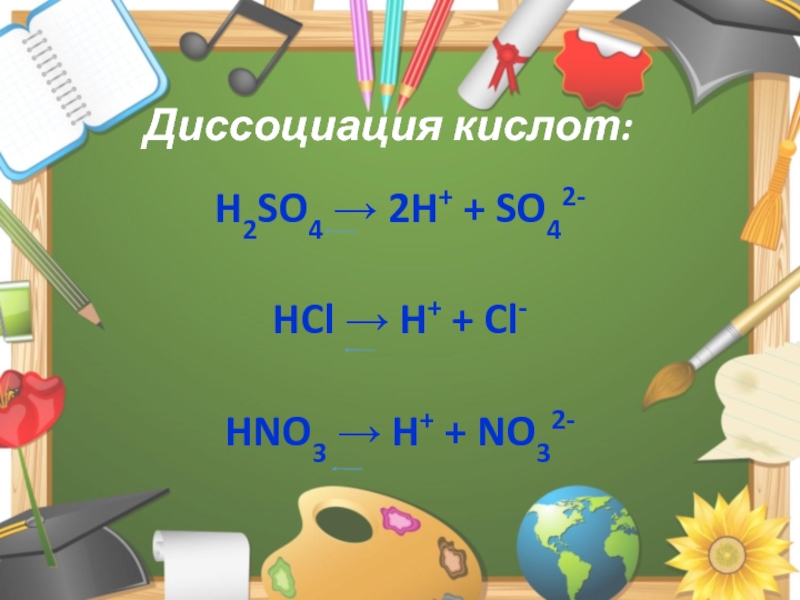
Слайд 3Диссоциация кислот:
H2SO4 → 2H+ + SO42-
HCl → H+ + Cl-
HNO3
→ H+ + NO32-
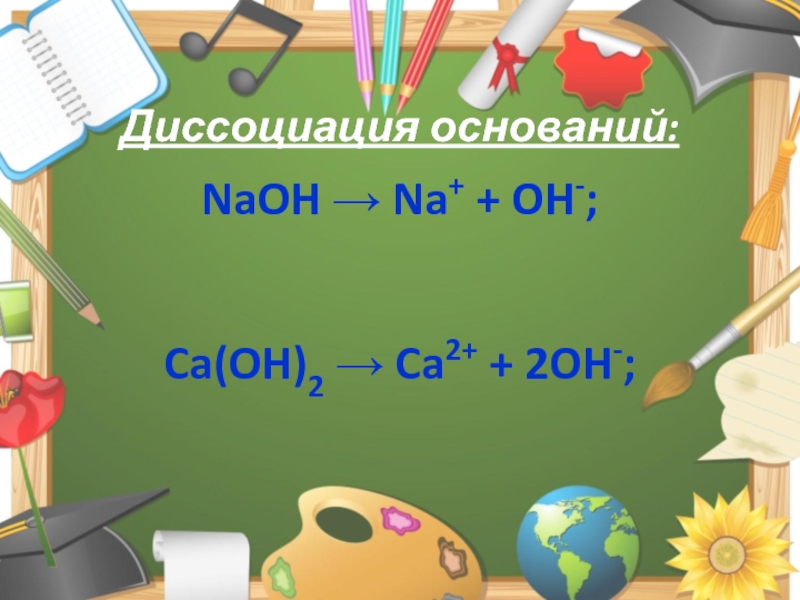
Слайд 4Диссоциация оснований:
NaOH → Na+ + OH-;
Ca(OH)2 → Ca2+ + 2OH-;
Слайд 5Диссоциация растворимых солей:
NaCI Na+ + CI-
AI2(SO4)3
2AI3+ + 3SO42-
Слайд 6Диссоциация воды:
Н2О → Н+ + ОН –
Слайд 7В чистой воде соотношение ионов водорода и гидроксид-ионов равное:
Н+
= ОН-
среда нейтральная;
При добавлении кислоты равновесие нарушается:
Н+ > ОН-
среда раствора кислая;
При добавлении щёлочи:
Н+ < ОН-
среда раствора щелочная.
Слайд 8Гидролиз солей
Гидролиз солей
Слайд 9Гидролиз -
от греч. «гидро» - вода,
«лизис» - разложение.
Слайд 10Гидролиз солей –
реакция обмена между солью и водой,
приводящая
к образованию слабого
электролита.
Слайд 114 типа солей:
соль, образованная
сильной кислотой и слабым основанием
(ALCl3);
сильным основанием и
слабой кислотой (Na2 S);
сильным основанием и сильной кислотой (NaCl);
слабым основанием и слабой кислотой (СН3СООNH4).
Слайд 12:
Соль, образованная сильной кислотой и слабым основанием.
AlCl3 → Al3+ +
3Cl-;
Н2О → Н+ + ОН –;
Al3+ + Н+ + ОН
– → AlОН2+ + Н+;
в растворе в свободном виде остался ион водорода (Н+), значит среда раствора кислая;
полное уравнение гидролиза:
AlCl3 + Н2О → AlОНCl2 + НCl;
Слайд 13Соль, образованная, сильным основанием и слабой кислотой.
Na2S
2Na++S2-
Н2О → Н+ + ОН –;
S2-
+ H2O HS- + OH-
в растворе в свободном виде остался гидроксид ион ( OH-), значит среда раствора щелочная.
Полное уравнение гидролиза
Na2S + H2O NaHS + NaOH
Слайд 14Соль, образованная сильным основанием и сильной кислотой
КСl + Н2О ↔
КСl ↔ К + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и гидроксид - анионов в растворе равны, как в чистой воде.
Слайд 15Соль, образованная слабым основанием и сильной кислотой.
CH3COONH4
CH3COO- +NH4+
Н2О →
Н+ + ОН –;
CH3COO- + NH4+ +H2O CH3COOH + NH3*H2O
CH3COONH4 + H2O CH3COOH + NH3*H2O
В этом случае гидролизу подвергаются как катион, так анион, образуются слабые электролиты, и среда раствора оказывается близкой к нейтральной или слабокислая, или слабощелочная, что зависит от констант диссоциации кислоты и основания.
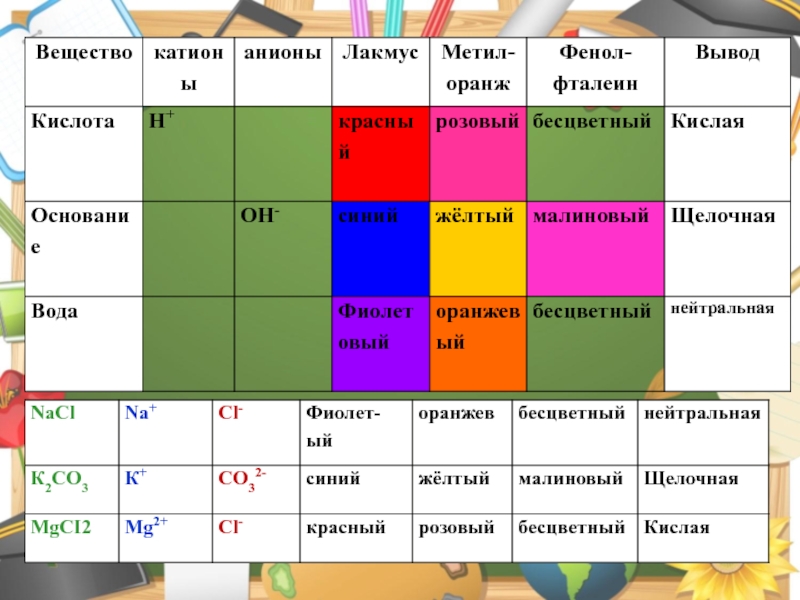
Слайд 16Индикаторы –вещества, которые меняют окраску в зависимости от среды.
Слайд 17
Изменение цвета различных индикаторов при действии растворов кислот и щелочей
Слайд 18
Демонстрационный опыт: к раствору соды Na2CO3 приливаем поочерёдно индикаторы лакмус
и метилоранж, фенолфталеин.
Na2CO3
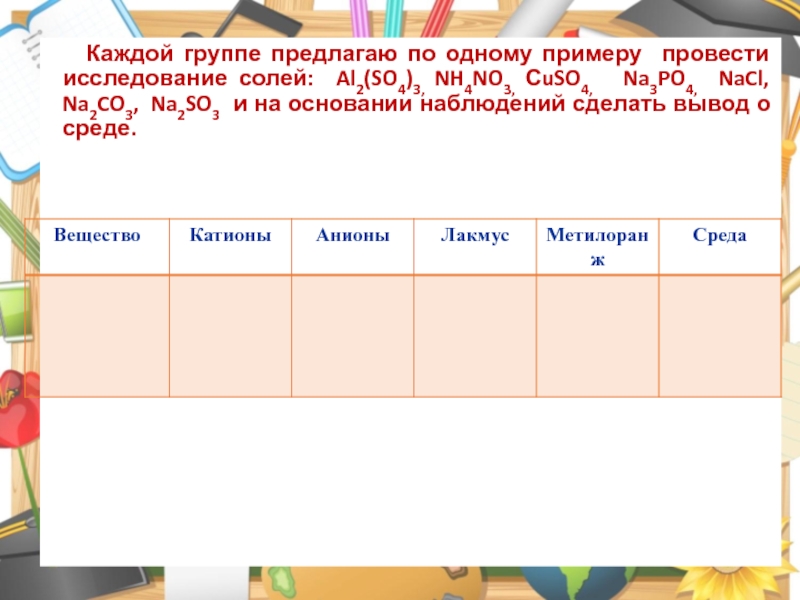
Слайд 19Каждой группе предлагаю по одному примеру провести исследование солей: Al2(SO4)3,
NH4NO3, СuSO4, Na3PO4, NaCl, Na2CO3, Na2SO3 и на основании
наблюдений сделать вывод о среде.
Слайд 20Задание №1.
а) используя метилоранж или лакмус, определите среду раствора соли
сульфата алюминия.
Слайд 21
Вывод:
раствор соли, образованной слабым основанием и сильной кислотой имеет
кислую среду.
Слайд 22Задание №2.
а) используя метилоранж или лакмус, определите среду раствора соли
фосфата натрия.
Слайд 23Какой вывод можно сделать, исходя из состава соли и средой
её раствора?
Раствор соли, образованной сильным основанием и слабой кислотой имеет
щелочную среду.
Слайд 24
Задание №3.
а) определить среду раствора соли, образованной сильной кислотой и
сильным основанием NaCI.
б) обосновать свой ответ.
Слайд 25Вывод:
Среда нейтральная, т.к. не образуется слабый электролит;
такие соли гидролизу
не подвергаются.
Слайд 27Упражнения
1.Кислую среду имеет
водный раствор:
а.Na3PO4
б.KCl
в.Na2CO3
г. ZnSO4
2.Щелочную среду имеет водный раствор:
а.FeCl3
б.K2SO4
в.Na2CO3
г.BaCl2
Слайд 28 3.Нейтральную среду имеет раствор:
а. Нитрата меди (II) Cu(NO3)2
б.Нитрата бария BaNO3
в.Ацетата калия CH3COONH4
г.Карбоната натрия Na(CO3)2
4.Одинаковую реакцию среды имеют растворы карбоната натрия и
а.нитрата бария BaNO3
б.сульфита калия K2SO3
в.сульфата натрия Na2SO4
г.хлорида алюминия AICI3
Слайд 29 5.Кислую реакцию среды имеет каждый
из двух растворов:
а.BaCl2 и
ZnCl2
б.AlCl3 и FeCl2
в.FeCl3 и NaCl
г.KCl и CaCl2
6.Соль, образованная сильным основанием и сильной кислотой,
а.Гидролизуется по катиону
б.Гидролизуется по аниону
в.Не подвергается гидролизу
г.Полностью разлагается водой
Слайд 307. Установите соответствие между составом соли и реакцией среды её
водного раствора
Ответ:
Слайд 31 8. Установите соответствие между названием соли и средой её
водного раствора.
Слайд 329. Установите соответствие между названием соли и отношением её к
гидролизу.
Слайд 3310.Установите соответствие между названием соли и отношением её к гидролизу.
Слайд 3411. Установите соответствие между веществом и продуктами его гидролиза.