Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Процессы в растворах: электролитическая диссоциация (ЭД)
Содержание
- 1. Процессы в растворах: электролитическая диссоциация (ЭД)
- 2. Вещества Электролиты - вещества, растворы и расплавы которых
- 3. Неэлектролиты вещества, которые содержат ковалентные неполярные или
- 4. Электролиты Вещества, которые содержат ионные и ковалентные
- 5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
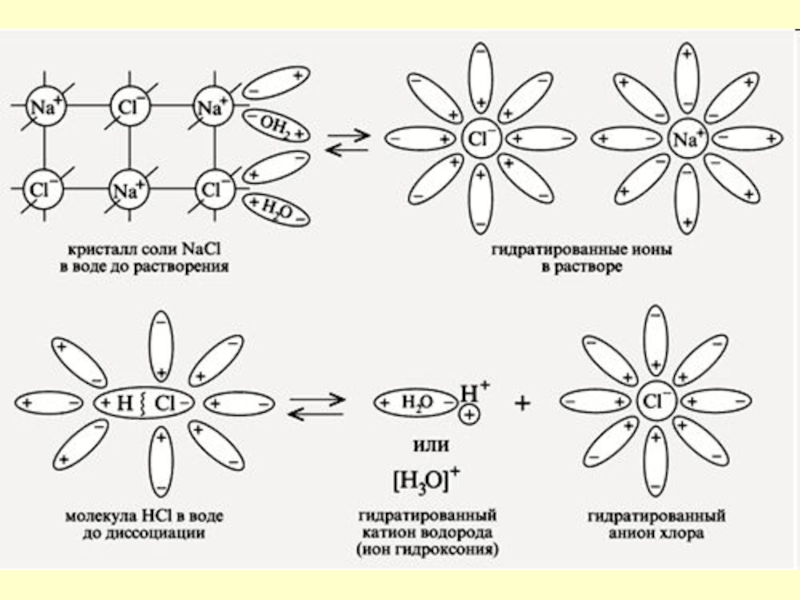
- 6. Вещества с ионной связьюКристаллическая решетка NaClКристалл NaCl
- 7. Механизм ЭД ионных веществ Ориентация диполей
- 8. Na+Cl -Na+Cl -Na+Cl -
- 9. Механизм ЭД полярных веществориентация диполей воды
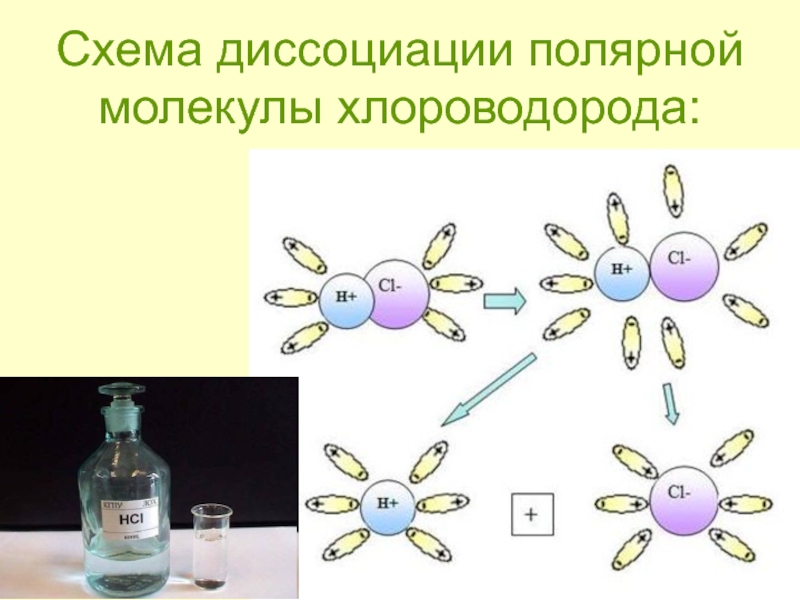
- 10. Схема диссоциации полярной молекулы хлороводорода:
- 11. Электролиты Сильные - при растворении в воде
- 12. Сильные электролиты вещества с ионными или сильно
- 13. Слабые электролитывещества с неполярными и малополярными связями:1) почти
- 14. Степень диссоциации Степень диссоциации (α) - отношение числа
- 15. Электролитическая диссоциация веществ, идущая с образованием свободных
- 16. Диссоциация кислотосуществляется ступенчато. На каждой ступени отщепляется
- 17. Диссоциация оснований Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2
- 18. Диссоциация солейСредние соли – соли, состоящие из
- 19. Диссоциация солейКислые соли – соли, в состав
- 20. Шведский ученый Сванте Аррениус(1859-1927) В 1887 году
- 21. Каблуков И.А. Кистяковский В.А.
- 22. Русские химики И.А.Каблуков и В.А.Кистяковский применили к
- 23. Основные положения теории ЭД 1. Электролиты в
- 24. Слайд 24
- 25. Основные положения теории ЭД 2. Беспорядочное движение
- 26. Основные положения теории ЭД 3. Диссоциация –
- 27. 4. Степень электролитической диссоциации (a) зависит от
- 28. Основные положения теории ЭД5. Свойства ионов
- 29. Источники информации:http://slovari.yandex.ru/http://www.lyceum8.ru/himiya/4.htmhttp://900igr.net/fotografii/khimija/Dissotsiatsija/010-Mekhanizm-dissotsiatsii-veschestv.htmlhttp://him.1september.ru/2003/34/7.htmhttp://900igr.net/kartinki/khimija/Povarennaja-sol/059-K-r-i-s-t-a-l-l-y-g-a-l-i-t-a.html
- 30. Благодарю за работу!
- 31. Скачать презентанцию
Вещества Электролиты - вещества, растворы и расплавы которых не проводят электрический ток. Неэлектролиты - вещества, растворы и расплавы которых не проводят электрический ток.
Слайды и текст этой презентации
Слайд 1Процессы в растворах:
электролитическая диссоциация (ЭД)
Презентация подготовлена учителем биологии и химии
МОУ СОШ д.Городище Немского района Кировской области
Слайд 2Вещества
Электролиты
- вещества, растворы и расплавы которых не проводят электрический
ток.
Неэлектролиты
- вещества, растворы и расплавы которых не проводят
электрический ток.Слайд 3Неэлектролиты
вещества, которые содержат ковалентные неполярные или малополярные связи. Эти
связи не распадаются на ионы.
газы, твердые вещества (неметаллы), органические
соединения (сахароза, бензин, спирт). Слайд 4Электролиты
Вещества, которые содержат ионные и ковалентные полярные связи. Эти
связи легко распадаются на ионы.
Неорганические кислоты, основания, соли.
Слайд 5Электролитическая диссоциация – процесс распада электролита на ионы при растворении
его в воде или расплавлении
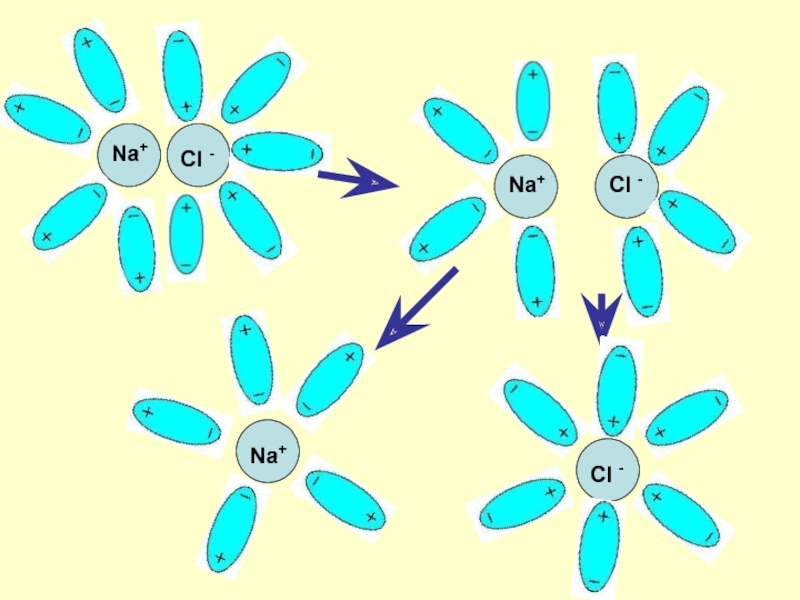
Слайд 7Механизм ЭД
ионных веществ
Ориентация диполей воды вокруг кристаллов соли.
Образование
между молекулами воды и ионами кристаллов слабых связей.
Разрушение кристаллической решетки
и образование гидратированных ионов.Слайд 9Механизм ЭД
полярных веществ
ориентация диполей воды вокруг полярной молекулы.
еще большая
поляризация полярной молекулы и превращение полярной связи ее в ионную.
образование свободных гидратирован-ных ионов.
Слайд 11Электролиты
Сильные
- при растворении
в воде практически
полностью
распадаются
на
ионы.
Слабые
частично
распадаются на
ионы. Их растворы
содержат
ионы и нераспавшиеся
молекулы, поэтому
концентрация ионов
мала.
Слайд 12Сильные электролиты
вещества с ионными или сильно полярными связями.
все
хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3)
и сильные основания: LiOH, NaOH, KOH, RbOH, CsOH, Вa(OH)2, Sr(OH)2, Сa(OH)2.Слайд 13 Слабые электролиты
вещества с неполярными и малополярными связями:
1) почти все органические кислоты
(CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти
все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Ca(OH)2; Al(OH)3; NH4OH);Слайд 14Степень диссоциации
Степень диссоциации (α) - отношение числа распавшихся на ионы
молекул (n) к общему числу растворенных молекул (N):
Слайд 15Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую
проводимость растворов.
CaCl2 = Ca2+ + 2Cl-
KAl(SO4)2 = K+ + Al3+
+ 2SO42-HNO3 = H+ + NO3-
Ba(OH)2 = Ba2+ + 2OH-
Слайд 16Диссоциация кислот
осуществляется ступенчато. На каждой ступени отщепляется один ион водорода.
H
Cl = H+ + Cl -
- H2SO4
= H+ + HSO4- (I ступень)HSO4- = H+ + SO42- (II ступень)
Кислоты - при диссоциации образуют
катионы водорода и анионы кислотного
остатка.
Слайд 17Диссоциация оснований
Ba(OH)2 = Ba2+ + 2OH-
Сa(OH)2 = Сa2+ +
2OH-
Основания - при диссоциации образуют катионы металла и анионы -
гидроксид-ионы. Слайд 18Диссоциация солей
Средние соли – соли, состоящие из атомов металла и
кислотного остатка, диссоциируют в одну ступень:
CaCl2 = Ca2+
+ 2Cl-KBr = K+ + Br-
NaCl = Na+ + Cl-
Слайд 19Диссоциация солей
Кислые соли – соли, в состав молекул которых кроме
атомов металла входят атомы водорода, распадаются ступенчато. Сначала отрываются все
атомы металла, а затем атомы водорода по- одному.KHCO3 = K+ + HCO3−
HCO3− = H+ + CO32-
Слайд 20Шведский ученый Сванте Аррениус(1859-1927)
В 1887 году создал теорию ЭД.
В
1903году был удостоен Нобелевской премии
"За чрезвычайные заслуги в развитии
химии".Слайд 22 Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации
химическую теорию растворов Д.И.Менделеева и доказали, что при растворении электролита
происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы.Слайд 23Основные положения
теории ЭД
1. Электролиты в водной среде (и в
расплавленном состоянии) распадаются
на положительно заряженные ионы
(катионы) и отрицательно
заряженные ионы (анионы).
Слайд 25Основные положения
теории ЭД
2. Беспорядочное движение ионов в растворе под
действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся
к электроду с отрицательным зарядом (катоду), а анионы – к аноду.Слайд 26Основные положения
теории ЭД
3. Диссоциация – обратимый процесс: параллельно с
распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. NaCl Na+ + Cl-Слайд 27 4. Степень электролитической диссоциации (a) зависит от природы электролита и
растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся
на ионы (n) к общему числу молекул, введенных в раствор (N).Основные положения
теории ЭД