Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Разложение оксидов
Содержание
- 1. Разложение оксидов
- 2. оглавление
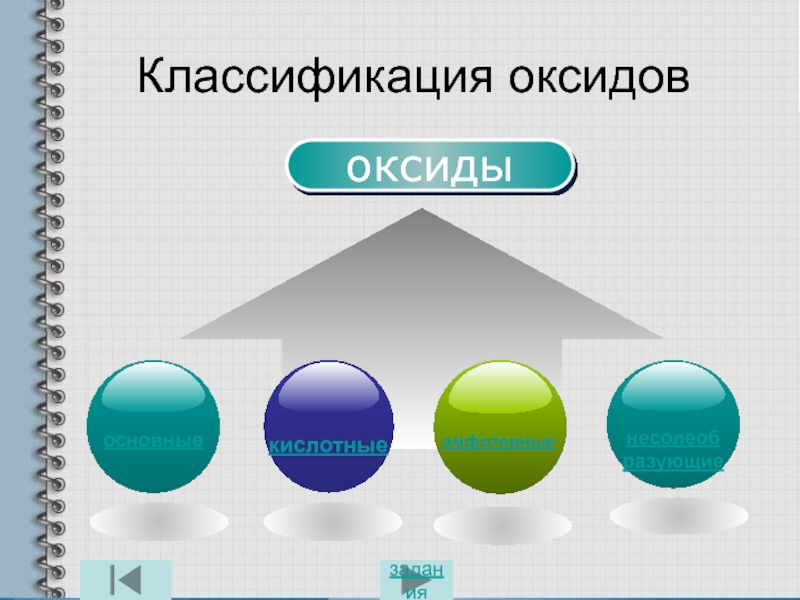
- 3. Классификация оксидовоксидызадания
- 4. Основные оксидыСпособы полученияА) металл+ кислородCu+O2→CuOБ) разложение нерастворимых
- 5. Кислотные оксидыСпособы полученияА) неметалл+ кислородC+O2→CO2Б) разложение кислотыH2CO3→H2O+CO2В)разложение
- 6. Амфотерные оксидыСпособы полученияА) металл+ кислород Zn+O2→ZnOБ)
- 7. Индеферентные оксиды (несолеобразующие)Получение1)СО2+С=2СО 2)НСООН=СО+Н2О Химические
- 8. Задания1) . Из перечня веществ выпишите отдельно
- 9. Глоссарийзадания
- 10. Скачать презентанцию
оглавление
Слайды и текст этой презентации
Слайд 4Основные оксиды
Способы получения
А) металл+ кислород
Cu+O2→CuO
Б) разложение нерастворимых оснований
Cu(OH)2→CuO+H2O
В)разложение солей
CaCO3→CaO+CO2
Химические свойства
1)с водой, если образуется растворимое основание
Na2O+H2O→ NaOH
2)с кислотными
оксидамиNa2O+CO2→Na2CO3
3)с кислотами
Na2O+HCI→NaCI+H2O
4) с амфотерными оксидами
Na2O +ZnO→Na2ZnO2
5) С восстановителями
CuO+Н2 →Cu+H2O
классиф
задания
Слайд 5Кислотные оксиды
Способы получения
А) неметалл+ кислород
C+O2→CO2
Б) разложение кислоты
H2CO3→H2O+CO2
В)разложение солей
CaCO3→CaO+CO2
Ca(HCO3)2→CaCO3+CO2+H2O
Химические свойства
1) с
основными оксидами
Na2O+CO2→Na2CO3
2) со щелочами
NaOH+CO2→Na2CO3 +H2O
3) с водой
H2O+CO2→H2CO3
4) с амфотерными
ZnO+CO2→ZnCO3
классиф
задания
Слайд 6Амфотерные оксиды
Способы получения
А) металл+ кислород
Zn+O2→ZnO
Б) разложение амфотерных оснований
Zn(OH)2→ZnO+H2O
В)разложение солей
ZnCO3→ZnO+CO2
Химические свойства
1)с кислотными оксидами
ZnO+CO2→ZnCO3
2) со щелочами
NaOН
+ZnO→Na2ZnO2 + Н2О3)с кислотами
ZnO+HCI→ZnCI2+H2O
4) с основными оксидами
Na2O +ZnO→Na2ZnO2
классиф
Слайд 7Индеферентные оксиды (несолеобразующие)
Получение
1)СО2+С=2СО
2)НСООН=СО+Н2О
Химические свойства
1) с неметаллами
СО+О2=СО2
СO+CI2=COCI2
2)со
щелочами
CO + NaOH=HCOONa
3) с основными оксидами
FeO+CO=Fe+CO2
классиф
Слайд 8Задания
1) . Из перечня веществ выпишите отдельно оксиды основные, кислотные,
амфотерные,назовите их: K2O, SO3,CO2, MgO, CaO, P2O5, ZnO, Fe2O3, PbO,
Na2O,CrO,Cr2O3,CrO3.2)Допишите уравнения реакций
А) CaO + H2SO4→ E)SO3 + H2O→
B) CaCO3 → F) SO3 +NaOH→
C) K+O2 → K) Fe2O3 + SO3 →
D) CaO+ H2O→ L)Fe(OH)3 →
3)Какая масса оксида меди(II) вступит в реакцию с водородом, если образуется 32г меди?