Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Развитие науки Химия 11 класс
Содержание
- 1. Развитие науки Химия 11 класс
- 2. ОСНОВНЫЕ ЭТАПЫ РАЗВИТИЯ ХИМИИЭтапы развития химииДо III
- 3. Предалхимический период (до III в)В предалхимическом
- 4. Предалхимический период (до III в)Попытки теоретического
- 5. «Квадрат противоположностей» графическое отображение взаимосвязи между элементами
- 6. АЛХИМИЧЕСКИЙ ПЕРИОД III – XVI В.В.Александрийская
- 7. Александрийская алхимия«Хризопея Клеопатры» — изображение из алхимического трактата
- 8. Александрийская алхимияСамо слово «химия» (и арабское al-kīmiya) обычно
- 9. Александрийская алхимияСреди значительных представителей греко-египетской алхимии, имя
- 10. Арабская алхимияТеоретической основой арабской алхимии по-прежнему являлось
- 11. Арабская алхимияПроблема трансмутации, таким образом, в рамках
- 12. Арабская алхимияАрабская алхимия, в отличие от александрийской,
- 13. Европейская алхимияНаучные воззрения арабов проникли в средневековую
- 14. Европейская алхимияСреди крупнейших алхимиков европейского этапа можно
- 15. Европейская алхимияВ Европе в мифологию и символику алхимии были
- 16. Европейская алхимияК началу XIV века европейская алхимия добилась первых значительных
- 17. Европейская алхимияВ середине XIII века в Европе началась выделка пороха; первым
- 18. Техническая химияНачиная с эпохи Возрождения, в связи c
- 19. Техническая химияБирингуччо и Агрикола видели задачу алхимии
- 20. Техническая химияПарацельс утверждал, что задача алхимии — изготовление
- 21. Техническая химияК представителям ятрохимии (спагирикам, как называли
- 22. Значение технической химииТехническая химия и ятрохимия непосредственно
- 23. Значение алхимического периодаГлавным результатом алхимического периода в
- 24. Период становления (XVII – XVIII в.в.)Вторая
- 25. Новая химияОдним из следствий этой научной революции
- 26. Создание теоретических представлений о составе тел, способных
- 27. Теория флогистона – движущая сила развития учения
- 28. Химическая революцияПроцесс превращения химии в науку завершился
- 29. В 1789 году Лавуазье издал свой знаменитый учебник «Элементарный
- 30. Период количественных законов: конец XVIII — середина XIX в.Главным итогом развития
- 31. Химия во второй половине XIX в. Для данного периода
- 32. Периодическая система элементовВ 1869 году Д. И. Менделеев опубликовал первый вариант своей Периодической
- 33. Структурная химияИЗОМЕРИЯ - существование соединений-изомеров (гл. обр. органических),
- 34. Структурная химияНа протяжении почти всего XIX века структурные представления
- 35. Физическая химияВ середине XIX века начала стремительно развиваться пограничная область
- 36. Физическая химияИзучение тепловых эффектов реакций начал
- 37. К.М. Гульдберг и П. ВаагеВ 1867 году К. М. Гульдберг и П. Вааге открыли закон действующих
- 38. Сва́нте А́вгуст Арре́ниус Важным достижением физической химии
- 39. Современный период: с начала XX в.После
- 40. Современный период: с начала XX в.В 1929 году Ф.
- 41. Современный период: с начала XX в.Благодаря
- 42. Современный период: с начала XX в.Подлинным
- 43. Современный период: с начала XX в.Отличительной
- 44. Современный период: с начала XX в.Закономерным
- 45. Скачать презентанцию
Слайды и текст этой презентации
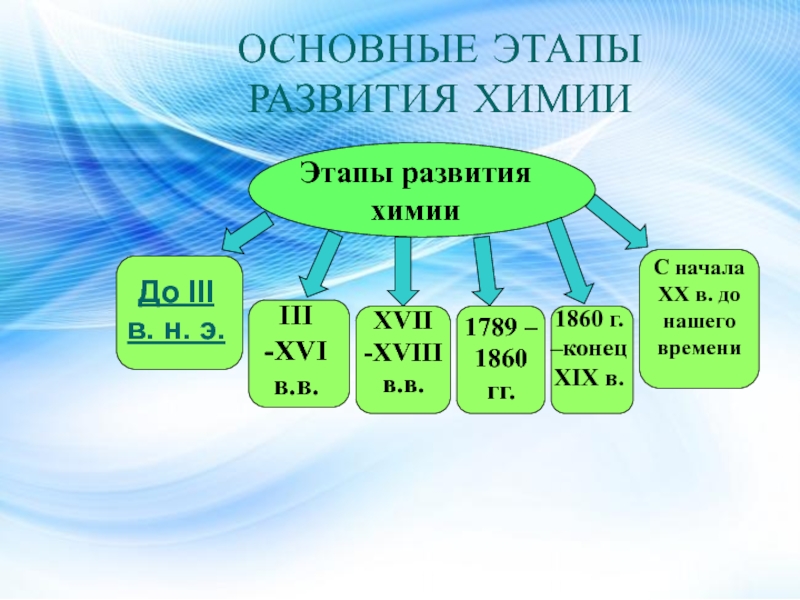
Слайд 2ОСНОВНЫЕ ЭТАПЫ РАЗВИТИЯ ХИМИИ
Этапы развития химии
До III в. н. э.
III
-XVI в.в.
XVII -XVIII в.в.
1789 – 1860 гг.
1860 г. –конец XIX
в.С начала XX в. до нашего времени
Слайд 3Предалхимический период
(до III в)
В предалхимическом периоде теоретический и практический аспекты знаний о
веществе развивались относительно независимо друг от друга.
Практические операции с веществом
являлись прерогативой ремесленной химии. Начало её зарождения следует в первую очередь связывать с появлением и развитием металлургии. В античную эпоху были известны в чистом виде 7 металлов: медь, свинец, олово, железо, золото, серебро и ртуть, а в виде сплавов — ещё и мышьяк, цинк и висмут. Помимо металлургии, накопление практических знаний происходило и в других областях, таких как производство керамики и стекла, крашение тканей и дубление кож, изготовление лекарственных средств и косметики. Именно на основе успехов и достижений практической химии древности происходило развитие химических знаний в последующие эпохи.
Слайд 4Предалхимический период
(до III в)
Попытки теоретического осмысления проблемы происхождения свойств
вещества привели к формированию в античной греческой натурфилософии - учения об элементах-стихиях.
Наибольшее
влияние на дальнейшее развитие науки оказали учения Эмпедокла, Платона и Аристотеля. Согласно этим концепциям все вещества образованы сочетанием четырёх первоначал: земли, воды, воздуха и огня.
Сами элементы при этом способны к взаимопревращениям, поскольку каждый из них, согласно Аристотелю, представляет собой одно из состояний единой первоматерии — определённое сочетание качеств.
Положение о возможности превращения одного элемента в другой стало позднее основой алхимической идеи о возможности взаимных превращений металлов (трансмутации).
Практически одновременно с учением об элементах-стихиях в Греции возник и атомизм, основателями которого стали Левкипп и Демокрит.
Слайд 6АЛХИМИЧЕСКИЙ ПЕРИОД
III – XVI В.В.
Александрийская алхимия
Арабская алхимия
Европейская алхимия
Алхимический период — это
время поисков философского камня, считавшегося необходимым для осуществления трансмутации металлов. Алхимическая
теория, основанная на античных представлениях о четырёх элементах, была тесно переплетена с астрологией и мистикой. Наряду с химико-техническим «златоделием» эта эпоха примечательна также и созданием уникальной системы мистической философии. Алхимический период, в свою очередь, разделяется на три подпериода: александрийскую (греко-египетскую), арабскую и европейскую алхимию.Слайд 7Александрийская алхимия
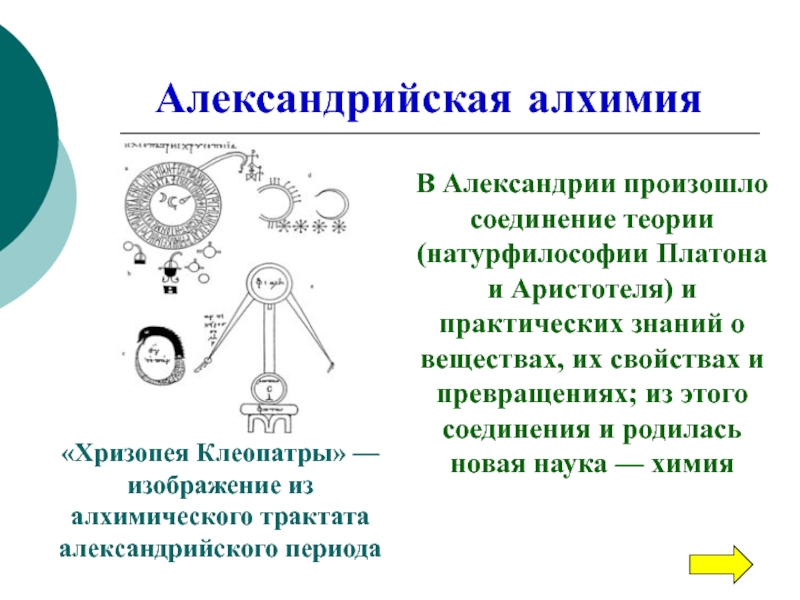
«Хризопея Клеопатры» — изображение из алхимического трактата александрийского периода
В Александрии произошло
соединение теории (натурфилософии Платона и Аристотеля) и практических знаний о
веществах, их свойствах и превращениях; из этого соединения и родилась новая наука — химия
Слайд 8Александрийская алхимия
Само слово «химия» (и арабское al-kīmiya) обычно считается происходящим от
древнего названия Египта — Кем или Хем; изначально слово, по-видимому, должно
было означать нечто вроде «египетского искусства». Иногда, термин производят от греческого χυμος — сок или χυμενσιζ — литьё.Основными объектами изучения александрийской химии являлись металлы. В александрийский период сформировалась традиционная металлопланетная символика алхимии, в которой каждому из семи известных тогда металлов сопоставлялась соответствующая планета: серебру — Луна, ртути — Меркурий, меди —Венера, золоту — Солнце, железу — Марс, олову — Юпитер, свинцу — Сатурн.
Небесным покровителем химии в Александрии стал египетский бог Тот или его греческий аналог Гермес.
Слайд 9Александрийская алхимия
Среди значительных представителей греко-египетской алхимии, имя которых дошло до
наших дней, можно отметить Болоса Демокритоса, Зосима Панополита, Олимпиодора.
Изображение прибора для перегонки
из рукописи Зосима Панополита Зосим Панополит
даты рождения и смерти неизвестны, вероятно, III – IV вв.
Зосима из Панополиса – греко-египетский алхимик, работавший в Александрийской академии. Считается одним из основателей алхимии. Родился в Панополисе (ныне Акхмим, Египет). Многочисленные мистико-аллегорические сочинения Зосима пользовалось широкой известностью у александрийских, а позднее и у средневековых алхимиков.
Слайд 10Арабская алхимия
Теоретической основой арабской алхимии по-прежнему являлось учение Аристотеля. Однако
развитие алхимической практики потребовало создания новой теории, основанной на химических
свойствах веществ. Джабир ибн Хайян (Гебер) в конце VIII века разработал ртутно-серную теорию происхождения металлов - металлы образованы двумя принципами: Hg (принцип металличности) и S (принцип горючести). Для образования Au — совершенного металла, еще необходимо наличие некоторой субстанции, которую Джабир называл эликсиром (al-iksir, от греческого ξεριον, то есть «сухой»).
Слайд 11Арабская алхимия
Проблема трансмутации, таким образом, в рамках ртутно-серной теории свелась
к задаче выделения эликсира, иначе называемого философским камнем (Lapis Philosophorum).
Эликсир, как считалось, должен был обладать ещё многими магическими свойствами — исцелять все болезни, и, возможно, давать бессмертие.Ртутно-серная теория составила теоретическую основу алхимии на несколько последующих столетий. В началеX века другой выдающийся алхимик — Ар-Рази (Разес), — усовершенствовал теорию, добавив к Ртути и Сере принцип твёрдости (хрупкости), или философскую Соль.
Слайд 12Арабская алхимия
Арабская алхимия, в отличие от александрийской, была вполне рациональна;
мистические элементы в ней представляли собой скорее дань традиции. Помимо
формирования основной теории алхимии, во время арабского этапа был разработан понятийный аппарат, лабораторная техника и методика эксперимента. Арабские алхимики добились несомненных практических успехов — ими выделены сурьма, мышьяк и, по-видимому, фосфор, получены уксусная кислота и разбавленные растворы минеральных кислот. Важной заслугой арабских алхимиков стало создание рациональной фармации, развившей традиции античной медицины.
Слайд 13Европейская алхимия
Научные воззрения арабов проникли в средневековую Европу в XIII веке. Работы
арабских алхимиков были переведены на латынь, а затем и на другие
европейские языки.
Слайд 14Европейская алхимия
Среди крупнейших алхимиков европейского этапа можно отметить Альберта Великого, Роджера Бэкона, Арнальдо
де Вилланову, Раймунда Луллия,Василия Валентина. Р. Бэкон определил алхимию следующим образом:
«Алхимия есть наука о том, как приготовить некий состав, или эликсир, который, если его прибавить к металлам неблагородным, превратит их в совершенные металлы».
Слайд 15Европейская алхимия
В Европе в мифологию и символику алхимии были внедрены элементы христианской мифологии (Петрус
Бонус,Николай Фламель); в целом для европейской алхимии мистические элементы оказались
значительно более характерны, нежели для арабской. Мистицизм и закрытость европейской алхимии породили значительное число мошенников от алхимии; уже Данте Алигьери в «Божественной комедии» поместил в восьмой круг Ада тех, кто «алхимией подделывал металлы». Характерной чертой европейской алхимии стало её двусмысленное положение в обществе. Как церковные, так и светские власти неоднократно запрещали занятия алхимией; в то же время алхимия процветала и в монастырях, и при королевских дворах.
Слайд 16Европейская алхимия
К началу XIV века европейская алхимия добилась первых значительных успехов, сумев превзойти
арабов в постижении свойств вещества. В 1270 году итальянский алхимик Бонавентура, в одной попытке
получения универсального растворителя получил раствор из соляной и азотной кислоты (aqua fortis), который оказался способным растворять золото, царя металлов (отсюда и название — aqua Regis, то есть царская водка). Псевдо-Гебер — один из самых значительных средневековых европейских алхимиков, работавший в Испании в XIV веке и подписывавший свои сочинения именем Гебера, — подробно описал концентрированные минеральные кислоты (серную и азотную). Использование этих кислот в алхимической практике привело к существенному росту знаний алхимиков о веществе.
Слайд 17Европейская алхимия
В середине XIII века в Европе началась выделка пороха; первым его (не позже 1249
года) описал, по-видимому, Р. Бэкон (часто упоминаемого монаха Б. Шварца можно считать основоположником порохового
дела в Германии). Появление огнестрельного оружия стало сильнейшим стимулом для развития алхимии и её тесного переплетения с ремесленной химией.
Слайд 18Техническая химия
Начиная с эпохи Возрождения, в связи c развитием производства всё
большее значение в алхимии стало приобретать производственное и вообще практическое
направление: металлургия, изготовление керамики, стекла и красок. В первой половине XVI века в алхимии выделились рациональные течения: техническая химия, начало которой положили работы В. Бирингуччо,Г. Агриколы и Б. Палисси, и ятрохимия, основателем которой стал Парацельс.Слайд 19Техническая химия
Бирингуччо и Агрикола видели задачу алхимии в поисках способов
совершенствования химической технологии; в своих трудах они стремились к максимально
ясному, полному и достоверному описанию опытных данных и технологических процессов.Слайд 20Техническая химия
Парацельс утверждал, что задача алхимии — изготовление лекарств; при этом
медицина Парацельса основывалась на ртутно-серной теории. Он считал, что в здоровом
организме три принципа — Ртуть, Сера и Соль, — находятся в равновесии; болезнь представляет нарушение равновесия между принципами. Для его восстановления Парацельс ввёл в практику лекарственные препараты минерального происхождения — соединения мышьяка, сурьмы, свинца, ртути и т. п., — в дополнение к традиционным растительным препаратам.Слайд 21Техническая химия
К представителям ятрохимии (спагирикам, как называли себя последователи Парацельса)
можно отнести многих известных алхимиков XVI—XVII веков: А. Либавия (рис.1), Р. Глаубера, Я. Б. Ван Гельмонта, О. Тахения.
Слайд 22Значение технической химии
Техническая химия и ятрохимия непосредственно подвели к созданию
химии как науки; на этом этапе были накоплены навыки экспериментальной
работы и наблюдений, в частности, разработаны и усовершенствованы конструкции печей и лабораторных приборов, методы очистки веществ (кристаллизация, перегонка и др.), получены новые химические препараты.Слайд 23Значение алхимического периода
Главным результатом алхимического периода в целом, помимо накопления
значительного запаса знаний о веществе, явилось зарождение эмпирического подхода к
изучению свойств вещества. Алхимический период стал совершенно необходимым переходным этапом между натурфилософией и экспериментальным естествознанием.Слайд 24Период становления
(XVII – XVIII в.в.)
Вторая половина XVII века ознаменовалась первой научной революцией,
результатом которой стало новое естествознание, целиком основанное на экспериментальных данных.
Создание гелиоцентрической системы мира (Н. Коперник, И. Кеплер), новой механики (Г. Галилей), открытие вакуума и атмосферного давления (Э. Торричелли,Б. Паскаль и О. фон Герике) привели к глубокому кризису аристотелевской физической картины мира. Ф. Бэконвыдвинул тезис о том, что решающим доводом в научной дискуссии должен являться эксперимент; в философии возродились атомистические представления (Р. Декарт, П. Гассенди).Слайд 25Новая химия
Одним из следствий этой научной революции явилось создание новой
химии, основоположником которой традиционно считается Р. Бойль. Бойль, доказав несостоятельность алхимических
представлений об элементах как носителях неких качеств, поставил перед химией задачу поиска реальных химических элементов. Элементы, по Бойлю, — практически неразложимые тела, состоящие из сходных однородных корпускул, из которых составлены все сложные тела и на которые они могут быть разложены. Главной задачей химии Бойль считал изучение состава веществ и зависимости свойств вещества от его составаСлайд 26Создание теоретических представлений о составе тел, способных заменить учение Аристотеля
и ртутно-серную теорию, оказалось весьма сложной задачей. В последней четверти XVII в.
появились т. н. эклектические воззрения, создатели которых пытаются увязать алхимические традиции и новые представления о химических элементах (Н. Лемери, И. И. Бехер).Слайд 27Теория флогистона – движущая сила развития учения об элементах (I-я
половина XVIII в.)
Предложена немецким химиком Г. Э. Шталем. Она объясняла горючесть тел наличием
в них некоего материального начала горючести — флогистона, и рассматривала горение как разложение. Обобщила широкий круг фактов, касавшихся процессов горения и обжига металлов, послужила мощным стимулом для развития количественного анализа сложных тел, без которого было бы абсолютно невозможным экспериментальное подтверждение идей о химических элементах. Она стимулировала также изучение газообразных продуктов горения в частности и газов вообще; в результате появилась пневматическая химия, основоположниками которой стали Дж. Блэк, Д. Резерфорд, Г. Кавендиш, Дж. Пристли и К. В. Шееле. Слайд 28Химическая революция
Процесс превращения химии в науку завершился открытиями А. Л. Лавуазье. С создания
им кислородной теории горения (1777 год) начался переломный этап в развитии химии,
названный «химической революцией». Отказ от теории флогистона потребовал пересмотра всех основных принципов и понятий химии, изменения терминологии и номенклатуры веществСлайд 29
В 1789 году Лавуазье издал свой знаменитый учебник «Элементарный курс химии», целиком
основанный на кислородной теории горения и новой химической номенклатуре. Он привёл
первый в истории новой химии список химических элементов (таблицу простых тел). Критерием определения элемента он избрал опыт, и только опыт, категорически отвергая любые неэмпирические рассуждения об атомах и молекулах, само существование которых невозможно подтвердить опытным путём. Лавуазье сформулировал закон сохранения массы, создал рациональную классификацию химических соединений, основанную, во-первых, на различии в элементном составе соединений и, во-вторых, на характере их свойств.Химическая революция окончательно придала химии вид самостоятельной науки, занимающейся экспериментальным изучением состава тел; она завершила период становления химии, ознаменовала собой полную рационализацию химии, окончательный отказ от алхимических представлений о природе вещества и его свойств.
Слайд 30Период количественных законов: конец XVIII — середина XIX в.
Главным итогом развития химии в период
количественных законов стало её превращение в точную науку, основанную не
только на наблюдении, но и на измерении. Был открыт целый ряд количественных закономерностей — стехиометрические законы:Закон эквивалентов (И. В. Рихтер, 1791—1798)
Закон постоянства состава (Ж. Л. Пруст, 1799—1806)
Закон кратных отношений (Дж. Дальтон, 1803)
Закон объёмных отношений, или закон соединения газов (Ж. Л. Гей-Люссак, 1808)
Закон Авогадро (А. Авогадро, 1811)
Закон удельных теплоёмкостей (П. Л. Дюлонг и А. Т. Пти, 1819)
Закон изоморфизма (Э. Мичерлих, 1819)
Законы электролиза (М. Фарадей, 1830-е гг.)
Закон постоянства количества теплоты (Г. Гесс, 1840)
Слайд 31Химия во второй половине XIX в.
Для данного периода характерно стремительное развитие науки:
были созданы периодическая система элементов, теория химического строения молекул, стереохимия, химическая термодинамика и химическая кинетика;
блестящих успехов достигли прикладная неорганическая химия и органический синтез. В связи с ростом объёма знаний о веществе и его свойствах началась дифференциация химии — выделение её отдельных ветвей, приобретающих черты самостоятельных наук.Слайд 32Периодическая система элементов
В 1869 году Д. И. Менделеев
опубликовал первый вариант своей Периодической таблицы и сформулировал Периодический
закон химических элементов. Менделеев не просто констатировал наличие взаимосвязи между атомными
весами и свойствами элементов, но взял на себя смелость предсказать свойства нескольких неоткрытых ещё элементов. После того, как предсказания Менделеева блестяще подтвердились, Периодический закон стал считаться одним из фундаментальных законов природыСлайд 33Структурная химия
ИЗОМЕРИЯ - существование соединений-изомеров (гл. обр. органических), одинаковых по составу
и мол. массе, но различных по физ. и хим. св-вам.
В итоге полемики Ю. Либиха и Ф. Вёлера было установлено (1823), что существуют два резко различных по св-вам в-ва состава AgCNO - циановокислое и гремучее серебро. Еще одним примером послужили винная и виноградная к-ты, после исследования к-рых И. Берцелиус в 1830 ввел термин "изомерия" и высказал предположение, что различия возникают из-за "различного распределения простых атомов в сложном атоме" (т. е. молекуле). Подлинное объяснение изомерия получила лишь во 2-й пол. 19 в. на основе теории хим. строения A. M. Бутлерова (структурная изомерия) и стереохим. учения Я. Г. Вант-Гоффа (пространственная изомерия). Структурная изомерия - результат различий в хим. строении.Слайд 34Структурная
химия
На протяжении почти всего XIX века структурные представления оказались востребованы, прежде всего,
в органической химии.
Лишь в 1893 году А. Вернер создал теорию строения комплексных соединений, которая
распространила эти представления на неорганические соединения, существенно расширив понятие о валентности элементов Слайд 35Физическая химия
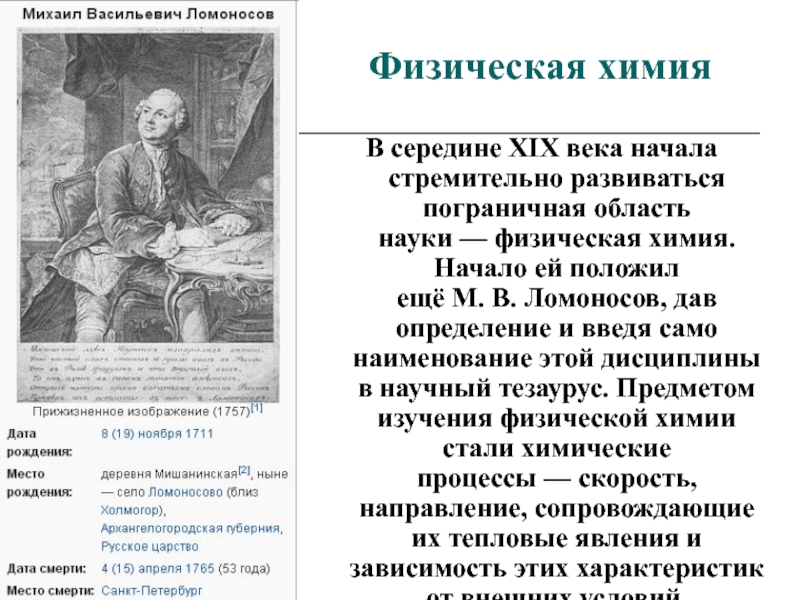
В середине XIX века начала стремительно развиваться пограничная область науки — физическая химия. Начало
ей положил ещё М. В. Ломоносов, дав определение и введя само наименование этой
дисциплины в научный тезаурус. Предметом изучения физической химии стали химические процессы — скорость, направление, сопровождающие их тепловые явления и зависимость этих характеристик от внешних условий.Слайд 36Физическая
химия
Изучение тепловых эффектов реакций
начал А. Л. Лавуазье, сформулировавший совместно с П. С. Лапласом первый
закон термохимии. В1840 году Г. И. Гесс открыл основной закон термохимии («закон Гесса»). М. Бертло и Ю. Томсен в
1860-е годы сформулировали «принцип максимальной работы» (принцип Бертло — Томсена), позволивший предвидеть принципиальную осуществимость химического взаимодействия.Слайд 37К.М. Гульдберг и П. Вааге
В 1867 году К. М. Гульдберг и
П. Вааге открыли закон действующих масс. Представляя равновесие
обратимой реакции как равенство двух сил сродства, действующих в противоположных
направлениях, они показали, что направление реакции определяется произведением действующих масс (концентраций) реагирующих веществ. Теоретическое рассмотрение химического равновесия выполнилиДж. У. Гиббс (1874—1878), Д. П. Коновалов (1881—1884) и Я. Г. Вант-Гофф (1884). Вант-Гофф сформулировал также принцип подвижного равновесия, который обобщили позже А. Л. Ле Шателье и К. Ф. Браун. Создание учения о химическом равновесии стало одним из главных достижений физической химии XIX века, имевшим значение не только для химии, но и для всего естествознания
К.М. Гульдберг и П. Вааге
Анри-Луи
Ле Шателье
Слайд 38Сва́нте А́вгуст Арре́ниус
Важным достижением физической химии в XIX веке стало создание учения
о растворах. Существенные успехи были достигнуты в количественном описании некоторых свойств
растворов (1-й и 2-й законы Ф.М. Рауля,осмотический закон Я. Г. Вант-Гоффа,
теория электролитической диссоциации
С. А. Аррениуса)
Сва́нте А́вгуст Арре́ниус
Слайд 39Современный период:
с начала XX в.
После открытия делимости атома и
установления природы электрона как его составной части возникли реальные предпосылки
для разработки
теорий химической связи.
В конце 20-х — начале 30-х годов XX века сформировались принципиально новые — квантово-механические — представления о строении атома и природе химической связи.
Квантово-механический подход к строению атома привёл к созданию новых теорий, объясняющих образование связи между атомами.
Слайд 40Современный период:
с начала XX в.
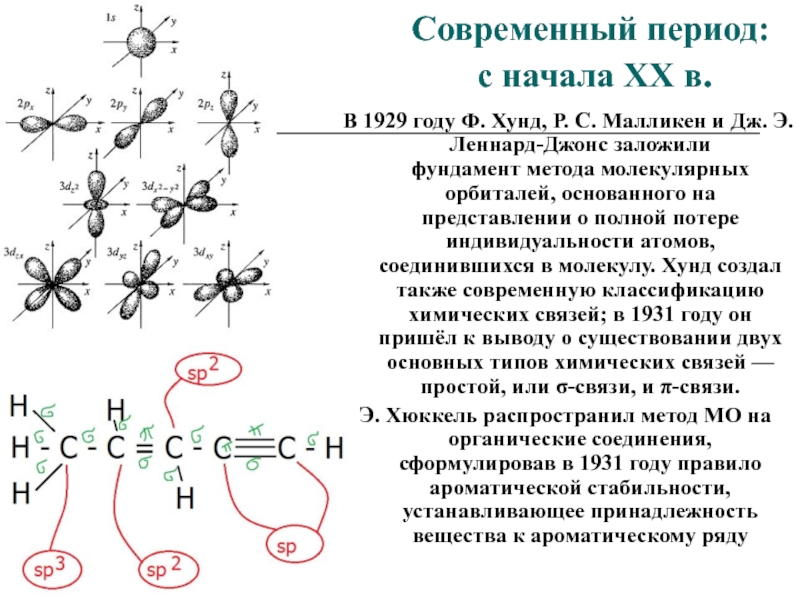
В 1929 году Ф. Хунд, Р. С. Малликен и Дж. Э. Леннард-Джонс заложили фундамент метода
молекулярных орбиталей, основанного на представлении о полной потере индивидуальности атомов,
соединившихся в молекулу. Хунд создал также современную классификацию химических связей; в 1931 году он пришёл к выводу о существовании двух основных типов химических связей — простой, или σ-связи, и π-связи.Э. Хюккель распространил метод МО на органические соединения, сформулировав в 1931 году правило ароматической стабильности, устанавливающее принадлежность вещества к ароматическому ряду
Слайд 41Современный период:
с начала XX в.
Благодаря квантовой механике к 30-м
годам XX века в основном был выяснен способ образования связи между атомами; кроме
того, в рамках квантово-механического подхода получило корректную физическую интерпретацию менделеевское учение о периодичности. Создание надёжного теоретического фундамента привело к значительному росту возможностей прогнозирования свойств вещества. Особенностью химии в XX веке стало широкое использования физико-математического аппарата и разнообразных расчётных методовСлайд 42Современный период:
с начала XX в.
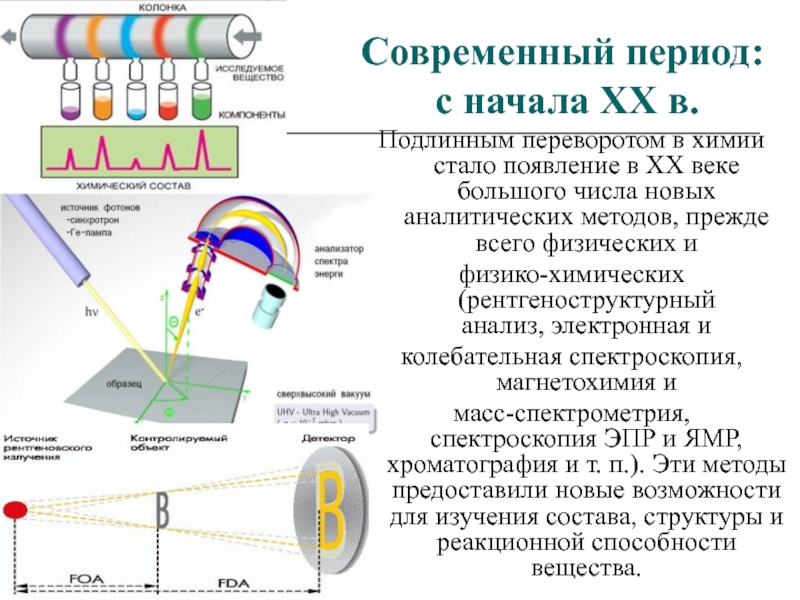
Подлинным переворотом в химии стало
появление в XX веке большого числа новых аналитических методов, прежде
всего физических ифизико-химических (рентгеноструктурный анализ, электронная и
колебательная спектроскопия,магнетохимия и
масс-спектрометрия, спектроскопия ЭПР и ЯМР,хроматография и т. п.). Эти методы предоставили новые возможности для изучения состава, структуры и реакционной способности вещества.