Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сера и ее соединения
Содержание
- 1. Сера и ее соединения
- 2. Сера и ее соединенияЦель работы: Изучение физических
- 3. Сера и ее соединенияСамородная сера известна человеку
- 4. Сера - биогенный элемент. 0,3-1,2 %, 0,5-2 % 1402 г
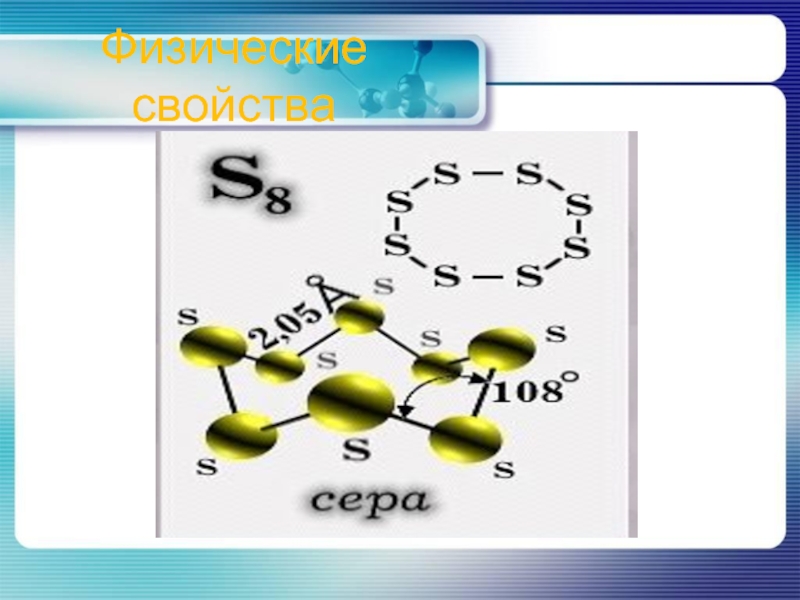
- 5. Физические свойства
- 6. Химические свойстваS + O2= SO2
- 7. Химические свойствасо фтором, S + 3F2 =
- 8. Химические свойстваПри нагревании сера взаимодействует со многими
- 9. СероводородГазбесцветныйзапах тухлых яицядовитхорошо растворим в воде(сероводородная кислота)FeS + 2HCl= FeCl 2 + H 2S
- 10. Диоксид серы 4 Fe S2 + 11
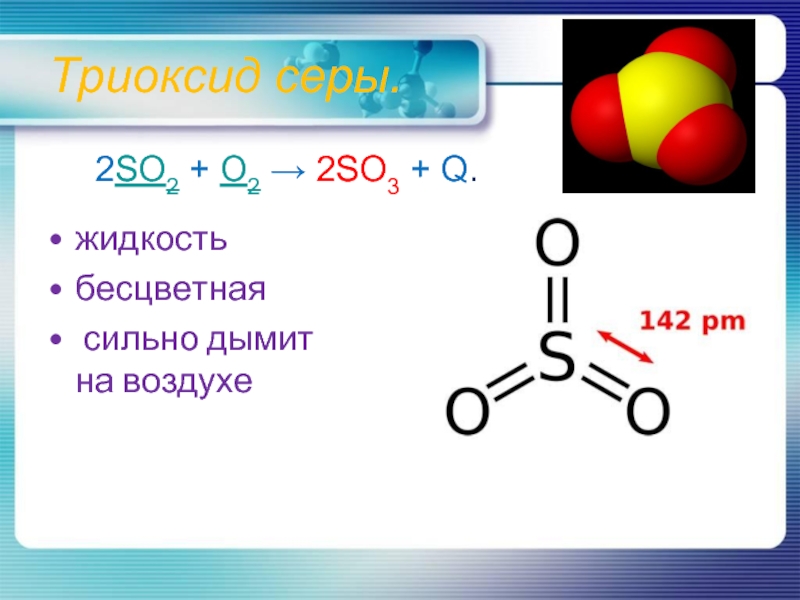
- 11. Триоксид серы. жидкостьбесцветная
- 12. Серная кислотаH2O+SO3 =>H2SO4 Li, К, Ca, Na,
- 13. Взаимодействие серной кислоты с металлами
- 14. Серная кислота-окислительКонцентрированная серная кислота ,особенно горячая ,-
- 15. Сера и окружающая среда.96% серыв виде SО2
- 16. Кислотные дожди.
- 17. Кислотные дожди.Кислотные осадки разрушают сооружения из мрамора
- 18. Сероводород в атмосфере.4-16 млн. тсоединений серы Сероводород
- 19. Зачем нужна сера ?
- 20. 88 из 150
- 21. Спасибо за внимание!
- 22. Скачать презентанцию
Сера и ее соединенияЦель работы: Изучение физических и химических свойства серы и ее соединений. Выявление отрицательного воздействия на окружающую среду и человека соединений серы.
Слайды и текст этой презентации
Слайд 2Сера и ее соединения
Цель работы:
Изучение физических и химических свойства
серы и ее соединений.
Выявление отрицательного воздействия на
окружающую среду и человека соединений серы. Слайд 3Сера и ее соединения
Самородная сера
известна человеку с
древнейших времен.
Считалось, что голубое
пламя и запах,
распространяемый
при горении серы,
отгоняет демонов. Слайд 7Химические свойства
со фтором, S + 3F2 = SF6
Расплав серы реагирует
с хлором,
2S + Cl2 = S2Cl2
При нагревании сера
также реагирует с фосфором, 5S + 2P = P2S5с водородом с водородом, углеродом,
S + H2 = H2S (сероводород)
C + 2S = CS2 (сероуглерод)
Слайд 8Химические свойства
При нагревании сера взаимодействует со многими металлами,
2Na
+ S = Na2S
С концентрированными кислотами-окислителями
S + 6HNO3(конц.) =
H2SO4 + 6NO2 ↑ + 2H2OS + 2H2SO4(конц.) = 3SO2 ↑ + 2H2O
Слайд 9Сероводород
Газ
бесцветный
запах тухлых яиц
ядовит
хорошо растворим в воде
(сероводородная кислота)
FeS + 2HCl= FeCl
2 + H 2S
Слайд 10Диоксид серы
4 Fe S2 + 11 O2 = 2
Fe2 O3 + 8 S O2
газ
Бесцветный
запах резкий, удушающий
tкип = -10С
Слайд 12Серная кислота
H2O+SO3 =>H2SO4
Li, К, Ca, Na, Mg, Al, Mn,
Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag,
AuСлайд 14Серная кислота-окислитель
Концентрированная серная кислота ,особенно горячая ,- энергичный окислитель
8HJ + H2 SO4 = 4 J 2 + H2
S + 4 H2 О ;2HBr + H2 SO4 = Br2 +SO2 + 2H2 О
C + 2 H2 SO4 = CO2 + 2 SO2 + 2 H2 O
3 S + 2 H2 SO4 = 3SO2 + 2 H2 O
Слайд 17Кислотные дожди.
Кислотные осадки разрушают сооружения из мрамора и известняка.
Исторические
памятники Греции и Рима, простояв тысячелетия, за последние годы разрушаются
прямо на глазах.
Теги