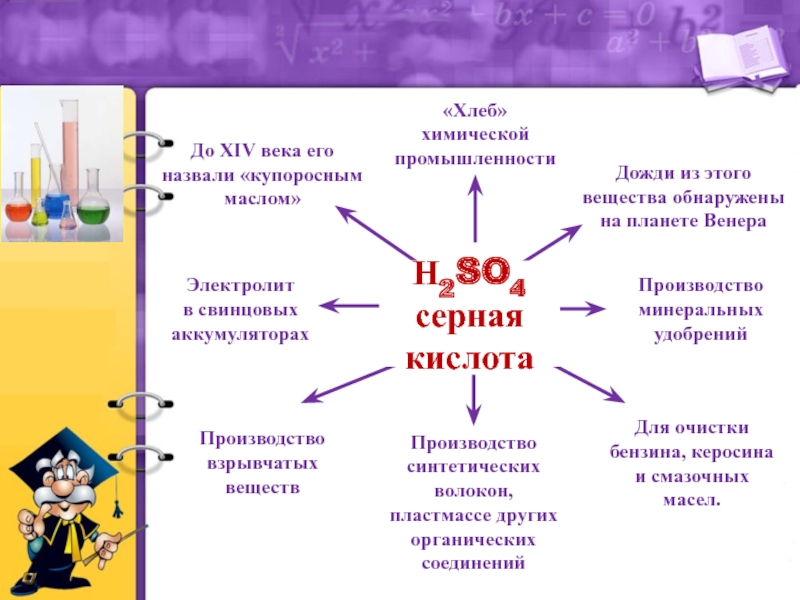
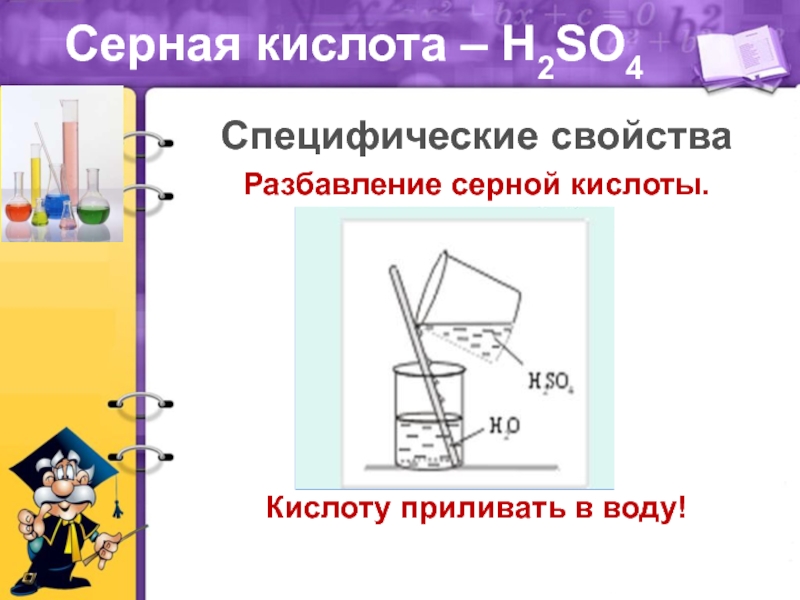
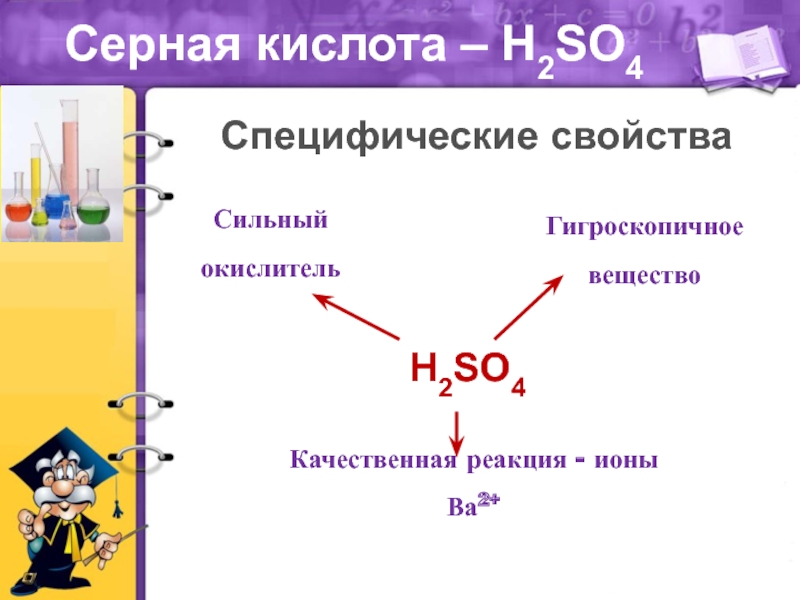
масел.
Электролит
в свинцовых аккумуляторах
Производство минеральных удобрений
Производство синтетических волокон, пластмассе
других органических соединенийДо XIV века его назвали «купоросным маслом»
Дожди из этого вещества обнаружены на планете Венера
Н2SO4
серная кислота