Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Скорость химической реакции
Содержание
- 1. Скорость химической реакции
- 2. Слайд 2
- 3. Скорость химической реакции - это изменение
- 4. Гомогенные реакции - реакции, которые протекают
- 5. Скорость гомогенной химической реакции, протекающей в закрытой
- 6. Факторы, влияющие на скорость химической реакции 1. Площадь поверхности соприкосновения реагирующих веществ
- 7. Влияние площади поверхности соприкосновения реагирующих веществ на
- 8. 2. Природа реагирующих веществ
- 9. Влияние природы реагирующих веществ на скорость
- 10. 3. Концентрация реагирующих веществ
- 11. Влияние концентрации веществ на скорость химической
- 12. 4. Температура
- 13. Влияние температуры на скорость химической реакцииДаны
- 14. Правило Вант-Гоффа (1884 г.)При изменении (повышении или
- 15. 5. Влияние катализатора на скорость химической реакции
- 16. 5. Влияние катализатора на скорость химической
- 17. Катализаторы - вещества, ускоряющие химическую реакцию, но не
- 18. Катализ (от греч. katálysis — разрушение) - изменение
- 19. Слайд 19
- 20. Интернет-ресурсы:http://him.1september.ru/articlef.php?ID=200502003
- 21. Скачать презентанцию
Скорость химической реакции - это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени
Слайды и текст этой презентации
Слайд 1Скорость химической реакции
Факторы,
влияющие на скорость химической реакции
Изотова И.А.
ГБОУ
СОШ № 603
Слайд 3Скорость химической реакции -
это изменение концентрации одного
из реагирующих веществ или одного из продуктов реакции в единицу
времениСлайд 4Гомогенные реакции -
реакции, которые протекают в однородной
среде (нет поверхности раздела между реагирующими веществами)
Например, в смеси газов
или в растворах.Гетерогенные реакции –
реакции, которые протекают между веществами в неоднородной среде (есть поверхность раздела между реагирующими веществами).
Например,
на поверхности твердого вещества и жидкости,
газа и жидкости, твердого вещества и газа…
Слайд 5Скорость гомогенной химической реакции, протекающей в закрытой системе (в системе,
у которой нет обмена массой с окружающей средой), зависит от
5 факторов…Площадь поверхности соприкосновения реагирующих веществ;
Природа реагирующих веществ;
Концентрация реагирующих веществ;
Температура;
Наличие в реакционной системе катализатора.
Слайд 6
Факторы,
влияющие на скорость химической реакции
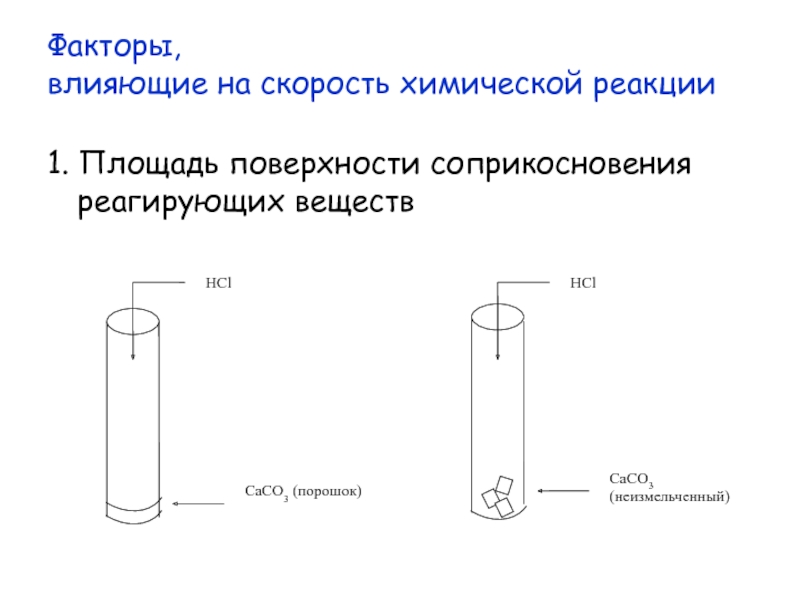
1. Площадь поверхности соприкосновения
реагирующих веществ
Слайд 7Влияние площади поверхности соприкосновения реагирующих веществ
на скорость химической реакции
Даны вещества:
мрамор
или мел СаСО3 (порошок),
мрамор или мел СаСО3 (неизмельченный),
р-р HCl.
1.
С измельченным или неизмельченным мрамором соляная кислота реагирует активнее?2. Почему в измельченном состоянии твердые вещества активнее реагируют с жидкостями и газами?
3. В какой зависимости находятся скорость химической реакции и площадь соприкосновения реагирующих веществ?
Слайд 9Влияние природы реагирующих веществ
на скорость химической реакции
Даны вещества:
Zn,
р-ры
HCl (соляной кислоты) и СН3СООН (уксусной кислоты) одинаковой концентрации.
С какой
из предложенных кислот цинк реагирует активнее?В чем причина того, что с соляной кислотой цинк реагирует активнее, чем с уксусной?
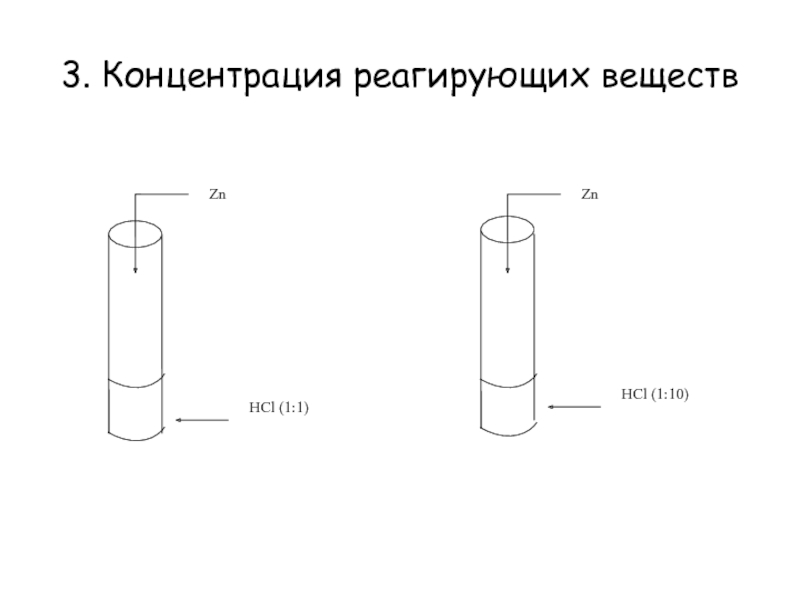
Слайд 11Влияние концентрации веществ
на скорость химической реакции
Даны вещества:
Zn,
р-р HCl
(1:1) (на 1 часть концентрированной HCl приходится 1 часть воды),
р-р HCl (1:10) (на 1 часть концентрированной HCl приходится 10 частей воды).
В какой зависимости находятся скорость химической реакции и концентрация реагирующих веществ?
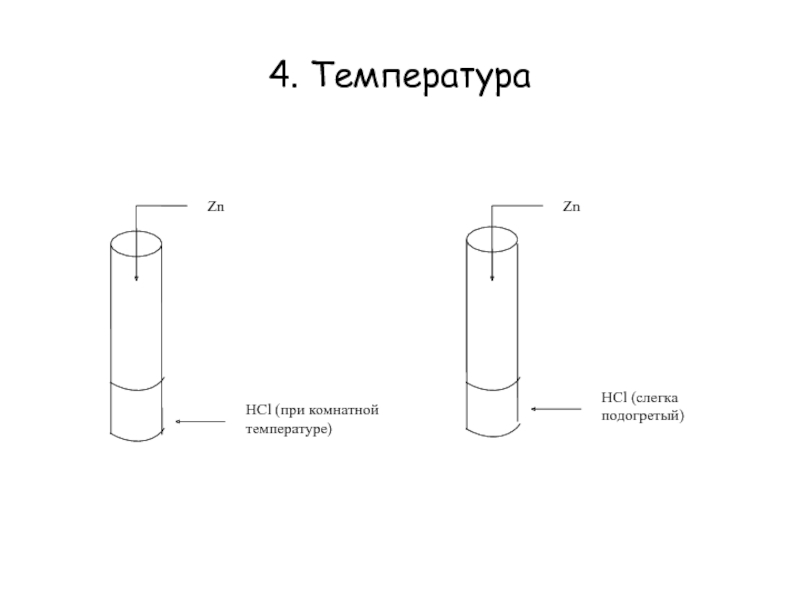
Слайд 13Влияние температуры
на скорость химической реакции
Даны вещества:
Zn,
р-р HCl в
двух пробирках.
1. В какой зависимости находятся скорость химической реакции и
температура?2. Как эта зависимость выражается математически?
Слайд 14Правило Вант-Гоффа (1884 г.)
При изменении (повышении или понижении) температуры на
каждые 10 градусов скорость реакции соответственно изменяется (увеличивается или уменьшается)
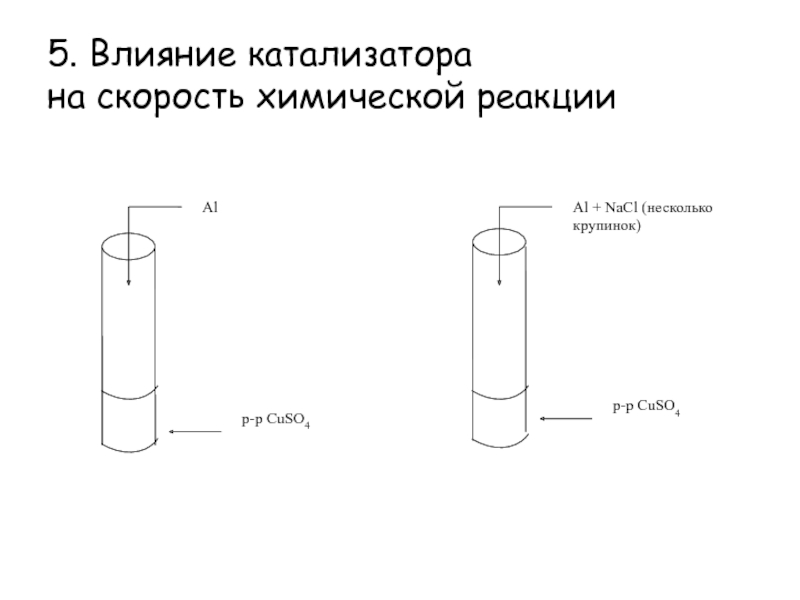
в 2 – 4 раза.Слайд 165. Влияние катализатора
на скорость химической реакции
Даны вещества:
Al,
р-р CuSO4,
поваренная соль NaCl (кристаллическая).
1. Какую роль играет хлорид натрия в
реакции замещения между сульфатом меди (II) и алюминием?2. Что такое катализаторы?
3. Что такое катализ?