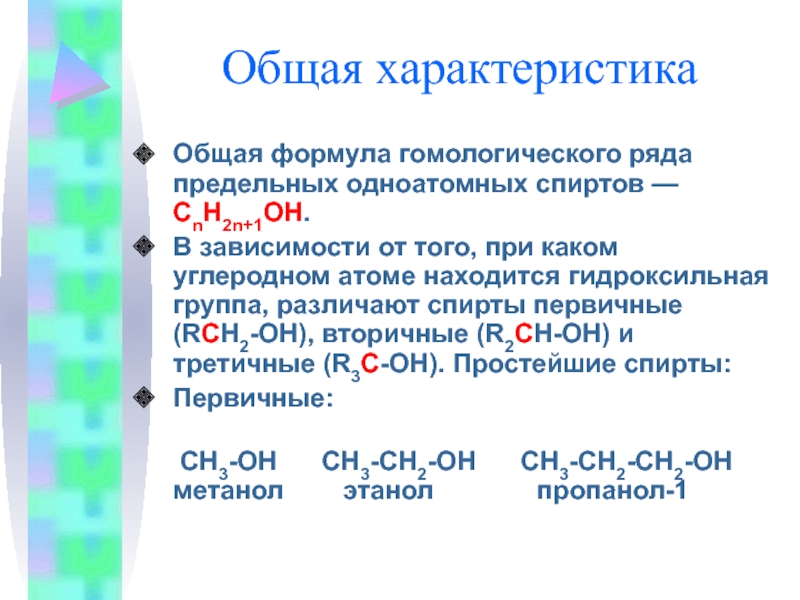
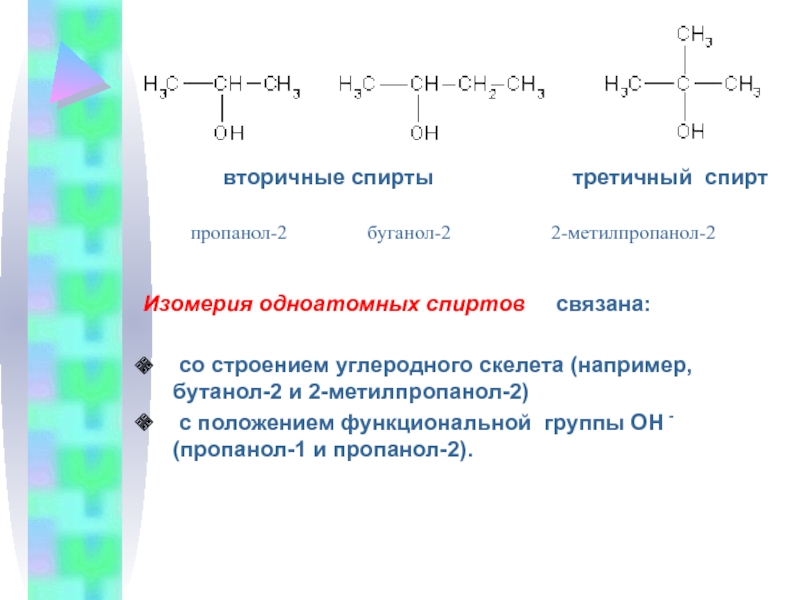
В зависимости от того, при каком углеродном атоме находится гидроксильная
группа, различают спирты первичные (RCH2-OH), вторичные (R2CH-OH) и третичные (R3С-ОН). Простейшие спирты:Первичные:
СН3-ОН СН3-СН2-ОН СН3-СН2-СН2-ОН метанол этанол пропанол-1