п.Приморский м.р.Ставропольский Самарской области
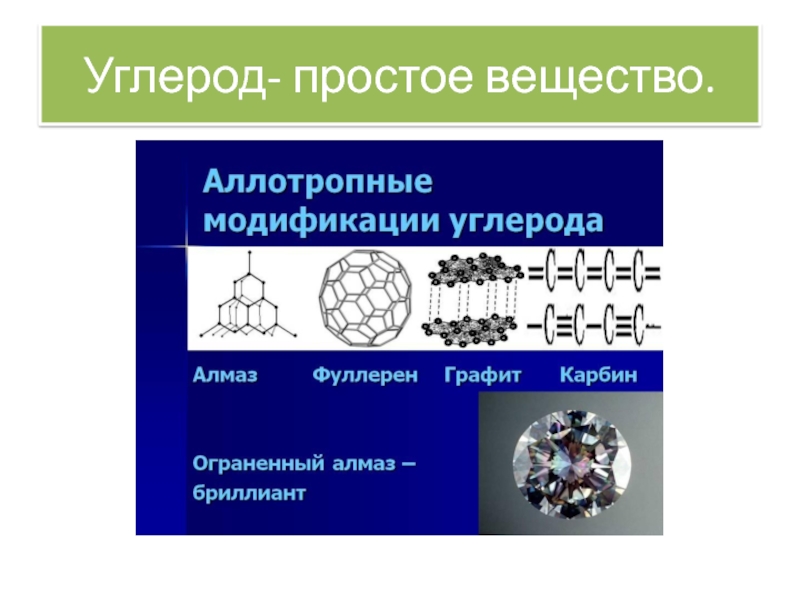
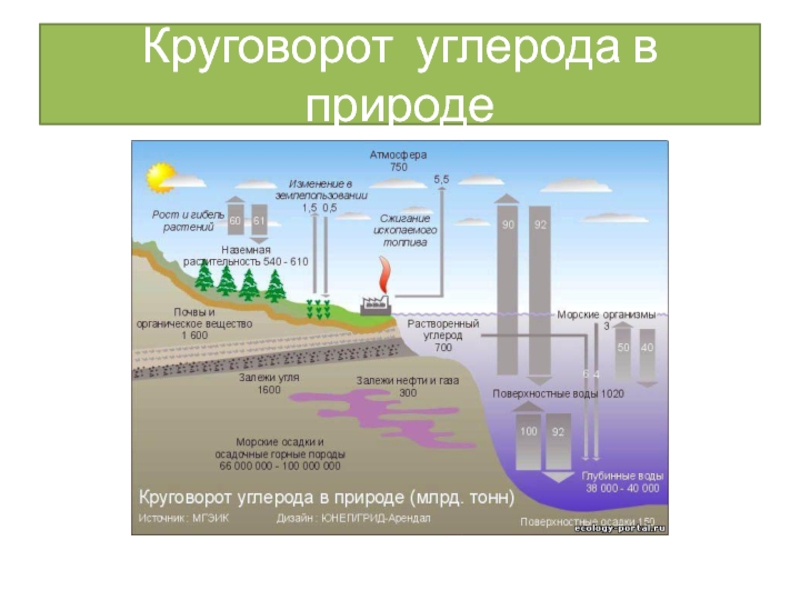
Углерод
Углеро́д — химический элемент 4-ой группы главной
подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса — 12,0107. Символ: C
Атомный номер: 6
Электронная конфигурация: [He] 2s2 2p2
Открытие: 3750 г. до н.э.
Температура кипения: 4 827°C
Атомная масса: 12,0107 ± 0,0008 а. е. м.