Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок химии в 8 классе "Кислоты" презентация
Содержание
- 1. Урок химии в 8 классе "Кислоты" презентация
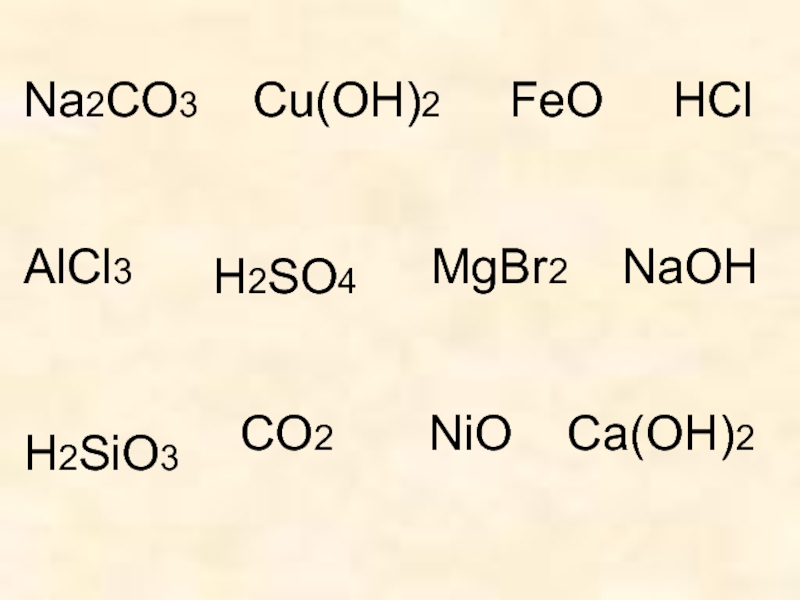
- 2. Распределите формулы по классам в таблицуHCl
- 3. Na2CO3 Cu(OH)2 FeOAlCl3
- 4. КИСЛОТЫТема урока
- 5. Цель урока: познакомиться с классификациями и общими химическими свойствами кислот.
- 6. Кислоты – это сложные вещества
- 7. Что нас объединяет?
- 8. Кислый вкус лимону придает лимонная кислота, яблоку
- 9. По какому признаку кислоты разделены на группы?Design Inc.Contents 1Contents 2
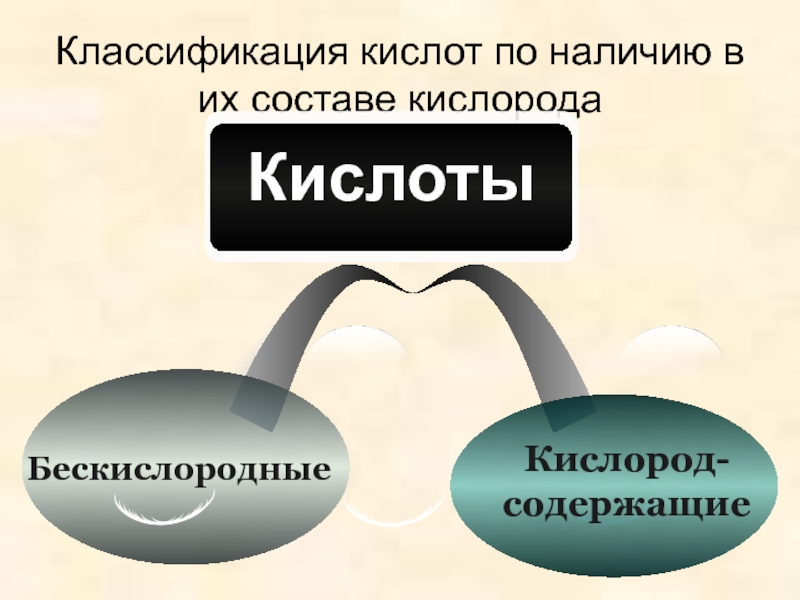
- 10. Классификация кислот по наличию в их составе кислородаКислород-содержащиеБескислородные
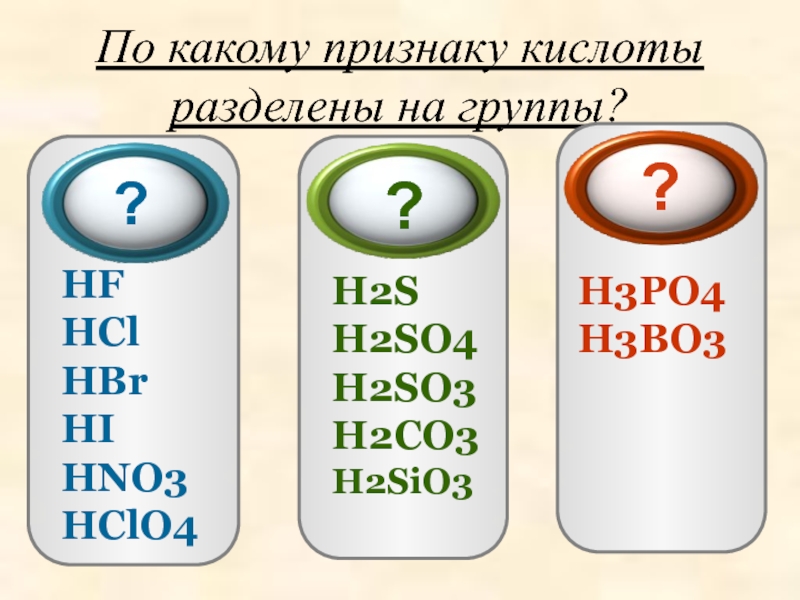
- 11. По какому признаку кислоты разделены на группы?HF
- 12. ОдноосновныеHCl, HNO3ДвухосновныеH2SO4,H2SiO3ТрехосновныеH3PO4Классификация кислот по числу атомов водорода.Кислоты
- 13. Физические свойства кислотПо агрегатному состоянию:Газообразные
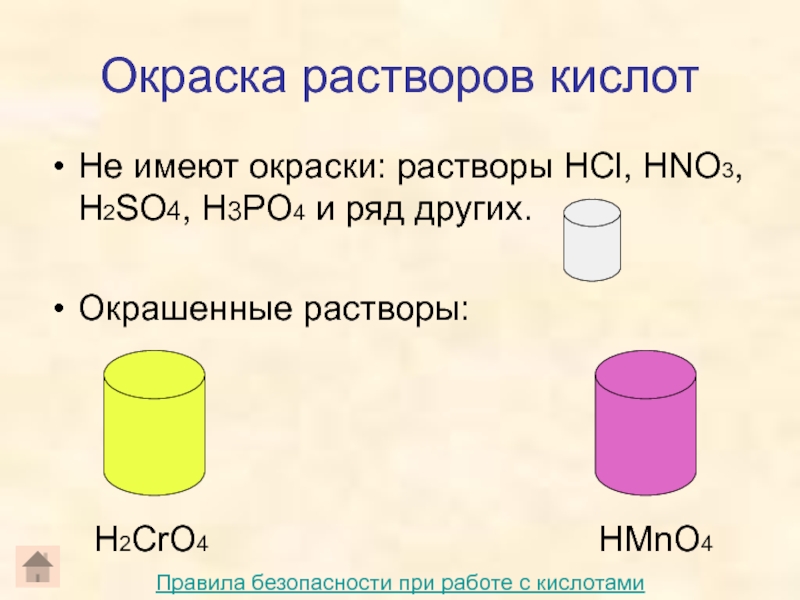
- 14. Окраска растворов кислотНе имеют окраски: растворы HCl,
- 15. ПРАВИЛА БЕЗОПАСНОСТИЕдкое вещество—кислота! Разрушает и раздражает кожу,
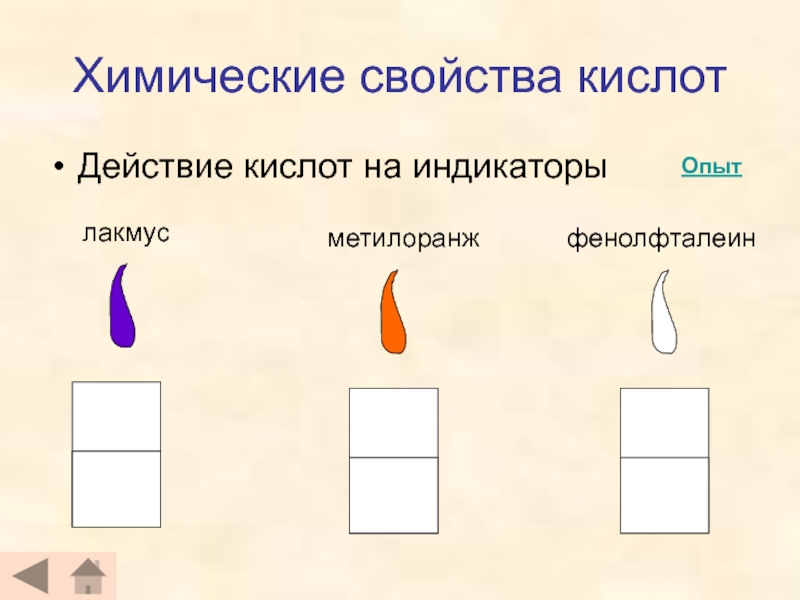
- 16. Химические свойства кислотДействие кислот на индикаторылакмусметилоранжфенолфталеинОпыт
- 17. Химические свойства кислотКислота + металл = соль
- 18. Химические свойства кислот Кислота + основный оксид
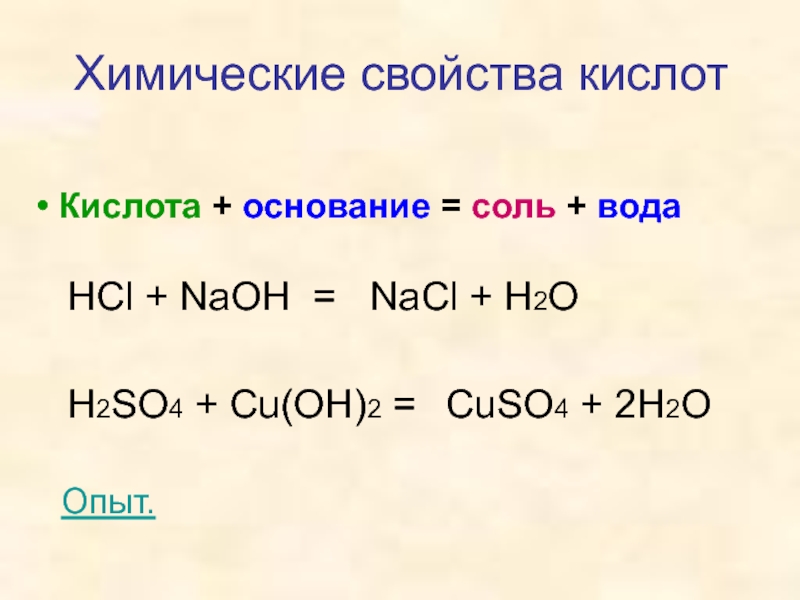
- 19. Кислота + основание = соль +
- 20. Кислоты реагируют с солями, если образуется осадок или газ.
- 21. КИСЛОТЫ
- 22. Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты.
- 23. 2. Подготовить сообщение : «Кислоты в природе»«Польза и вред кислот».
- 24. БЛАГОДАРЮ ЗА УРОК ! УСПЕХА!
- 25. Информационные источники: 3CD-ROM «Химия.8 класс» (Электронный ресурс)
- 26. Скачать презентанцию
Распределите формулы по классам в таблицуHCl HNO3 H2SO4 Ca(OH)2 K2O Na2O Al2O3 Zn(OH)2 Al(OH)3
Слайды и текст этой презентации
Слайд 6 Кислоты – это сложные вещества состоящие из атомов
водорода и кислотных остатков.
НCl HNO3 H2SO4
Слайд 8Кислый вкус лимону придает лимонная кислота, яблоку — яблочная кислота,
скисшему молоку — молочная кислота. Щавель имеет кислый вкус благодаря
наличию в его листьях щавелевой кислоты.Слайд 11По какому признаку кислоты разделены на группы?
HF
HCl
HBr
HI
HNO3
HClO4
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
H3BO3
?
?
?
Слайд 12
Одноосновные
HCl, HNO3
Двухосновные
H2SO4,H2SiO3
Трехосновные
H3PO4
Классификация кислот по числу атомов водорода.
Кислоты
Слайд 13Физические свойства кислот
По агрегатному
состоянию:
Газообразные (HCl, H2S)
Жидкие (HNO3,
H2SO4)
Твердые (H3PO4, H2SiO3)
Цвет кислот – ?
Запах – ?
Вкус – ?
Слайд 14Окраска растворов кислот
Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4
и ряд других.
Окрашенные растворы:
H2CrO4
HMnO4
Правила безопасности при работе с кислотами
Слайд 15ПРАВИЛА БЕЗОПАСНОСТИ
Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на
кожу капли раствора кислоты немедленно смойте сильной струей холодной воды,
а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.Слайд 17Химические свойства кислот
Кислота + металл = соль + водород
Ряд активности
металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn
Pb H Cu Hg Ag Pt AuОпыт 1. Взаимодействие цинка с соляной кислотой
Слайд 18Химические свойства кислот
Кислота + основный оксид = соль +
вода
Опыт. Взаимодействие оксида магния с соляной кислотой
Слайд 19 Кислота + основание = соль + вода
Химические свойства кислот
HCl
+ NaOH =
H2SO4 + Cu(OH)2 =
NaCl + H2O
CuSO4 + 2H2O
Опыт.
Слайд 22Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной
кислоты.
Слайд 25Информационные источники:
3CD-ROM «Химия.8 класс» (Электронный ресурс) – М. «Просвещение»,2004.
Габриелян О.С. Настольная книга учителя. Химия. 8 класс. М.: Дрофа,
2003Маркина И.В. Современный урок химии. Ярославль. Академия развития. 2008
Правила техники безопасности при работе с кислотами. Анимация. http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swf
http://www.logosib.ru/him/HCl.jpg
http://forexaw.com/TERMs/Metal121313/img73211_4-1_Himicheskie_svoystva_zolota-rastvoryi.jpg