Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Водород и его свойства.
Содержание
- 1. Водород и его свойства.
- 2. Вы со мною уже встречались - Я
- 3. ВодородУрок № 1.
- 4. Слайд 4
- 5. Цель:познакомиться с открытием и распространением водорода в
- 6. Схема маршрута путешествия по теме «Водород»Станция «ИСТОРИЧЕСКАЯ»Станция«ГРАФИЧЕСКИЙ ДИКТАНТ»Станция «ПРИРОДНАЯ»Станция«ФИЗИЧЕСКАЯ»Станция «МЕНДЕЛЕЕВСКАЯ»
- 7. Станция «Историческая»В 1766г. известный английский ученый Генри
- 8. Первым стал рассматривать водород как химический элемент
- 9. Станция «Менделеевская»
- 10. Станция «Менделеевская»
- 11. Станция «Менделеевская»
- 12. Физические свойстваГаз, без цвета, без запаха, без
- 13. Транспортируют водород в баллонах под давлением
- 14. Станция «Природная»В космосе водород занимает 1 место
- 15. Водород в космосе
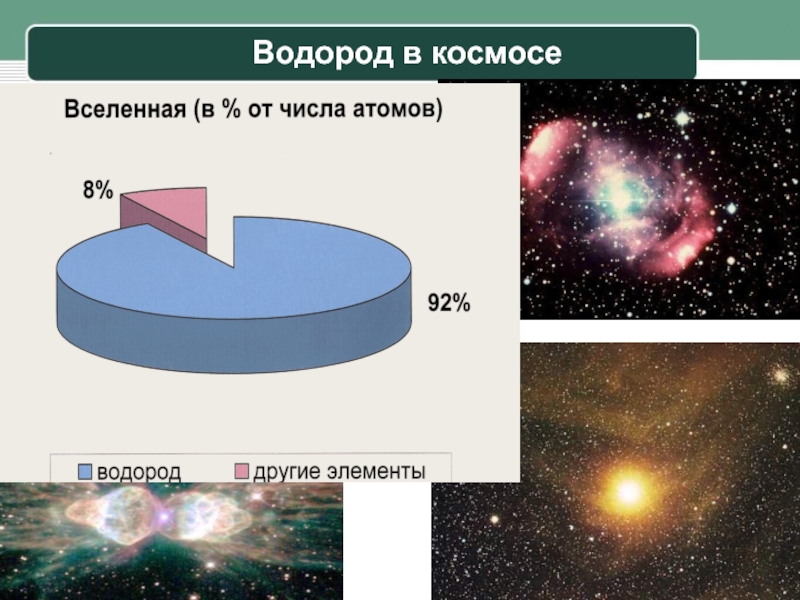
- 16. Водород самый распространенный элемент во Вселенной (92%)
- 17. На долю водорода приходится 50 % массы Солнца и других звезд.
- 18. Водород в природеВодород широко распространен в природе
- 19. Водород на ЗемлеВода Нефть Природный газ
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. В воздухе водорода менее 0,0001 %
- 24. Графический диктант1 вариант выбирает утверждения, верные для
- 25. § 25, 27 (физические свойства) стр. 76; упр. № 1 - 3. Домашнее задание
- 26. Подведем итоги:Что нового узнали сегодня на уроке?В чем испытывали затруднение? Что понравилось на уроке?
- 27. За время существования Солнца, уже около половины
- 28. Каждую секунду на Солнце 4 миллиона тонн водорода превращаются в гелий.
- 29. Этот легкий газ приспособили для воздушных полетов.
- 30. Слайд 30
- 31. ВодородУрок № 2.
- 32. Какое соединение богаче водородом: H2O или CH4?РЕШЕНИЕ:
- 33. Схема маршрута путешествия по теме «Водород»Станция «ИСТОРИЧЕСКАЯ»Станция«ГРАФИЧЕСКИЙ ДИКТАНТ»Станция «ПРИРОДНАЯ»Станция«ФИЗИЧЕСКАЯ»Станция «МЕНДЕЛЕЕВСКАЯ»
- 34. Слайд 34
- 35. Получение водорода.I. В лаборатории.Взаимодействие металлов с кислотами
- 36. Получение водорода.II. В промышленности.Разложение воды электрическим током:
- 37. Станция «ПОЛУЧЕНИЕ ВОДОРОДА» Алгоритм опыта: Подготовить пробирку
- 38. Химические свойства водорода.
- 39. «Я водород, я водородРодитель всех и всяких вод!» Химические свойства
- 40. I. Взаимодействие с простыми веществами.
- 41. в) Взаимодействие
- 42. I. Взаимодействие с простыми веществами. 2.
- 43. II. Взаимодействие со сложными веществами. 1.
- 44. H2Для получения аммиакаNH3Восстановитель металлов из оксидовДля получениясоляной
- 45. Водородная энергетикаВ недалёком будущем основным источником получения
- 46. Водородные автомобилиВ 1979 году компания BMW выпустила
- 47. Слайд 47
- 48. Водород и будущее Слова «дейтерий» и
- 49. Но когда-нибудь настанет время – и это
- 50. Водород – топливо будущего?
- 51. § 26 – 27, стр. 76;
- 52. 1. Я узнал(а) много нового.2. Мне это
- 53. Скачать презентанцию
Вы со мною уже встречались - Я - космический скиталец, Элементов прародитель И отважный предводитель. Я любитель кислорода, Вместе с ним даю я воду.
Слайды и текст этой презентации
Слайд 5Цель:
познакомиться с открытием и распространением водорода в природе;
изучить физические и
химические свойства водорода;
научиться получать водород;
рассмотреть основные области применения водорода.
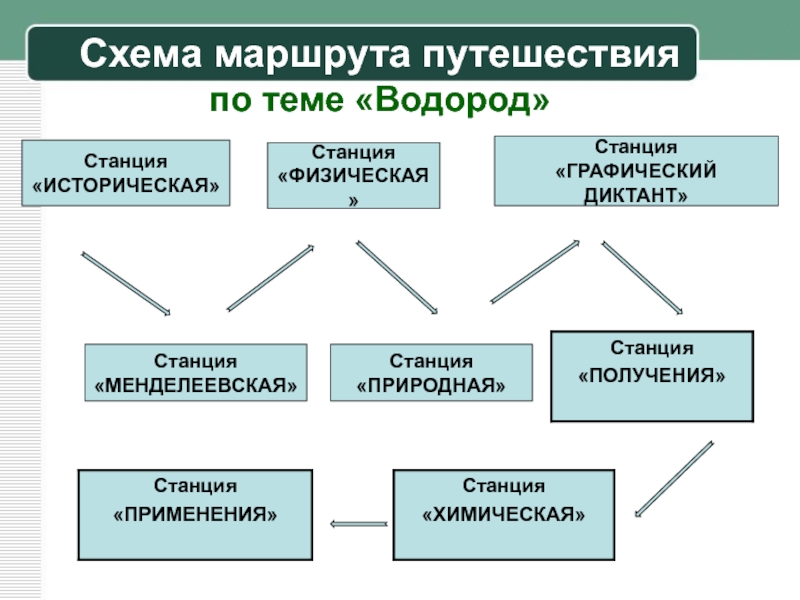
Слайд 6Схема маршрута путешествия
по теме «Водород»
Станция
«ИСТОРИЧЕСКАЯ»
Станция
«ГРАФИЧЕСКИЙ ДИКТАНТ»
Станция
«ПРИРОДНАЯ»
Станция
«ФИЗИЧЕСКАЯ»
Станция
«МЕНДЕЛЕЕВСКАЯ»
Слайд 7Станция «Историческая»
В 1766г. известный английский ученый Генри Кавендиш получил «искусственный
воздух» действием металлов на кислоты.
«Воздух» Кавендиша хорошо горел, поэтому
его назвали «горючим воздухом». При горении «горючего воздуха» на стенках пробирки оставались крохотные капельки росы.
Кавендиш собрал их и провел исследования.
Результат поразил его – это была вода.
Слайд 8
Первым стал рассматривать водород как химический элемент француз А. Лавуазье,
который в 1787 году дал ему название гидрогениум, означающее «рождающий
воду».Русское название (по смыслу одно и тоже): вода род.
Станция «Историческая»
Слайд 12Физические свойства
Газ, без цвета, без запаха, без вкуса;
практически нерастворим в
воде
(в 100 объемах воды растворяется не более 2 объемов водорода при 200 С);водород в 14,5 раз легче воздуха (1 литр весит 0,09 грамм);
теплопроводность в 7 раз больше, чем воздуха;
T0 кип. – 252,80 С;
T0 пл. – 259,10 С.
Слайд 13 Транспортируют водород в баллонах под давлением свыше 150 атм.
Они окрашены в тёмно-зелёный цвет c красной надписью "Водород".
Слайд 14Станция «Природная»
В космосе водород занимает
1 место по распространенности.
Наше
Солнце на 50% состоит из атомов
водорода.
В организме человека содержится
60% водорода.
По числу атомов водород занимает 2 место
среди остальных элементов, что
составляет –17 %.
Слайд 18Водород в природе
Водород широко распространен в природе — содержится в
воде, во всех органических соединениях, в свободном виде — в
некоторых природных газах.Содержание его в земной коре достигает 0,15% ее массы, с учетом гидросферы — 1%, это 9-й по распространенности элемент.
Слайд 24Графический диктант
1 вариант выбирает утверждения, верные для кислорода.
2 вариант –
для водорода.
1) Газ – без цвета, вкуса, запаха.
2) Малорастворим в воде.
3) Легче
воздуха. 4) Тяжелее воздуха.
5) Самый распространенный элемент космоса.
6) Самый распространенный элемент на Земле.
7) Входит в состав воздуха.
8) Входит в состав воды.
9) Молекула простого вещества двухатомна.
10) Имеет самую высокую теплопроводность.
Ответы: О2 – 1, 2, 4, 6, 7, 8, 9.
Н2 – 1, 2, 3, 5, 8, 9, 10.
Слайд 26Подведем итоги:
Что нового узнали сегодня на уроке?
В чем испытывали затруднение?
Что понравилось на уроке?
Слайд 27За время существования Солнца, уже около половины массы водорода в
его центральной области превратилось в гелий.
Вероятно ещё через 5
млрд. лет, когда в центре светила водород будет на исходе – Солнце (жёлтый карлик в настоящее время) увеличится в размерах и станет красным гигантом. Знаете ли вы, что…
Слайд 29Этот легкий газ приспособили для воздушных полетов.
В этом качестве
его применяли вплоть до 1937 года, когда в воздухе сгорел
крупнейший в мире, в два футбольных поля размером, немецкий дирижабль «Гинденбург».Катастрофа унесла жизни 36 человек, и на таком использовании водорода был поставлен крест.
С тех пор аэростаты заправляют исключительно гелием. Гелий — газ, увы, более плотный, но зато негорючий.
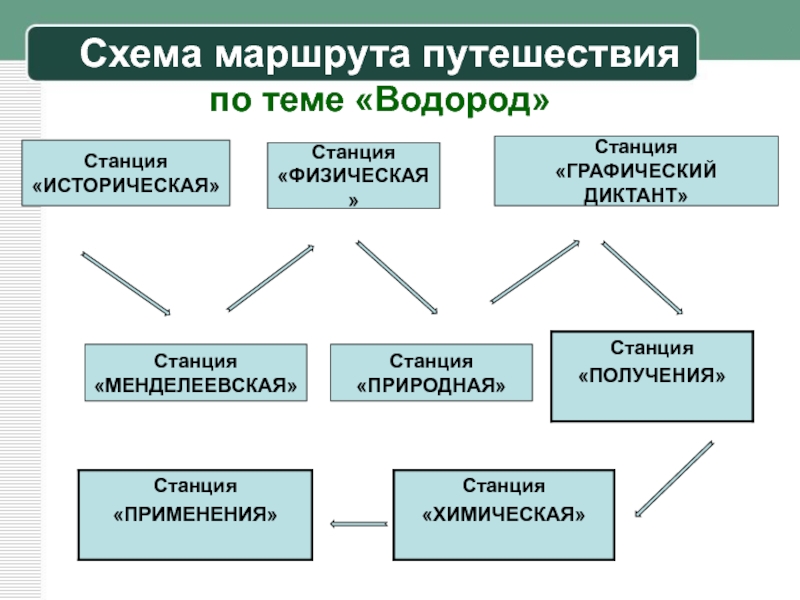
Слайд 33Схема маршрута путешествия
по теме «Водород»
Станция
«ИСТОРИЧЕСКАЯ»
Станция
«ГРАФИЧЕСКИЙ ДИКТАНТ»
Станция
«ПРИРОДНАЯ»
Станция
«ФИЗИЧЕСКАЯ»
Станция
«МЕНДЕЛЕЕВСКАЯ»
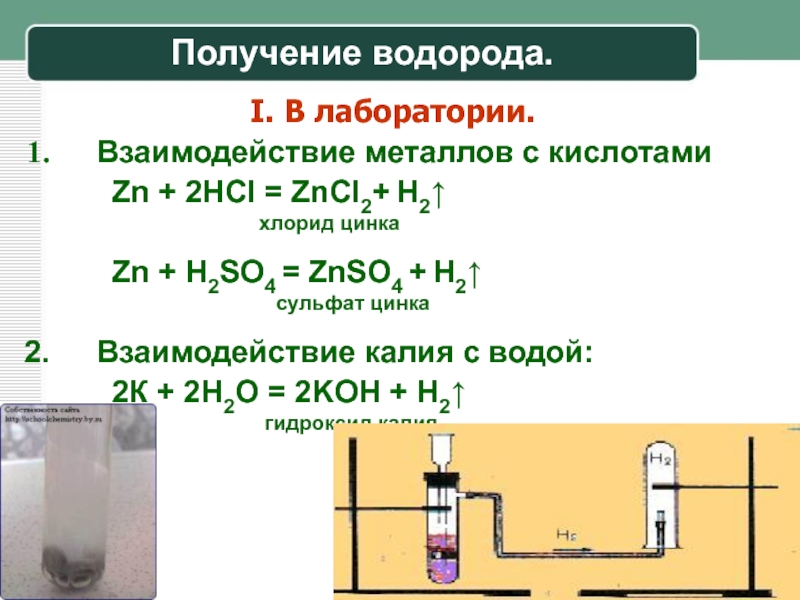
Слайд 35Получение водорода.
I. В лаборатории.
Взаимодействие металлов с кислотами
Zn + 2HCl = ZnCl2+ H2↑
хлорид цинкаZn + H2SO4 = ZnSO4 + H2↑
сульфат цинка
Взаимодействие калия с водой:
2К + 2H2O = 2KOH + H2↑
гидроксид калия
Слайд 36Получение водорода.
II. В промышленности.
Разложение воды электрическим током:
2H2O = 2H2↑+O2↑ - 484 кДж
Из природного газа:
СН4 + 2H2O = СО2↑ + 4H2↑ - 165 кДжСлайд 37Станция «ПОЛУЧЕНИЕ ВОДОРОДА»
Алгоритм опыта:
Подготовить пробирку с газоотводной трубкой.
Поместить в пробирку 2 - 3 кусочка цинка.
Прилить немного соляной
кислоты. Наблюдать выделение пузырьков водорода.
Собирать водород в пробирку - вверх дном.
Проверить на чистоту водород.
Чистый водород сгорает спокойно, с характерным звуком «п–пах».
Слайд 40 I. Взаимодействие с простыми веществами.
1. Взаимодействие с
неметаллами:
а) Взаимодействие с кислородом:
2Н2 + О2 = 2Н2О↑ б) Взаимодействие с азотом:
3H2 + N2 = 2NН3↑
аммиак
Слайд 41 в) Взаимодействие с серой:
Н2 + S = H2S↑
сероводород г) Взаимодействие с галогенами:
Н2 + Cl2 = 2НCl↑
хлороводород
Слайд 42I. Взаимодействие с простыми веществами.
2. Взаимодействие с металлами:
а) Взаимодействие с кальцием:
Са + Н2 = СаН2гидрид кальция
б) Взаимодействие с натрием:
2Nа + Н2 = 2NаН
гидрид натрия
Слайд 43
II. Взаимодействие со сложными веществами.
1. Взаимодействие с оксидами
металлов:
а) Взаимодействие с оксидом
меди: СuO + Н2 = Сu + Н2O
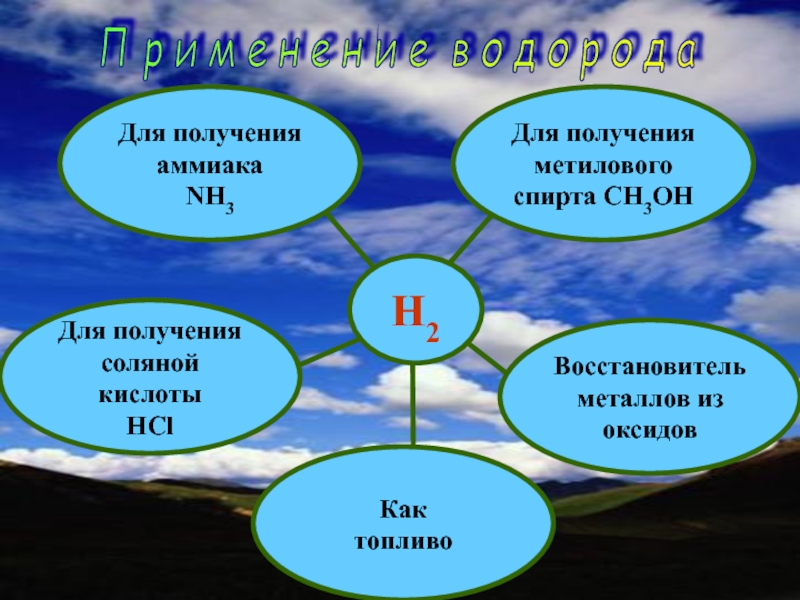
Слайд 44H2
Для получения
аммиака
NH3
Восстановитель
металлов из оксидов
Для получения
соляной кислоты
HCl
Как
топливо
Для получения
метилового
спирта
СH3OH
П р и м е н е н и е
в о д о р о д а Слайд 45Водородная энергетика
В недалёком будущем основным источником получения энергии станет реакция
горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии
(уголь, нефть). При этом предполагалось, что для получения водорода в больших масштабах можно будет использовать электролиз воды.Слайд 46Водородные автомобили
В 1979 году компания BMW выпустила первый автомобиль, вполне
успешно ездивший на водороде, при этом не взрывавшийся и выпускавший
из выхлопной трубы водяной пар.Вслед за BMW в экологическую сторону потянулись и другие производители. К концу века каждая уважающая себя автокомпания имела в запаснике хотя бы один автомобиль, работающий на водородном топливе.
Слайд 48
Водород и будущее
Слова «дейтерий» и «тритий» напоминают нам о том,
что сегодня человек располагает мощнейшим источником энергии, высвобождающейся при реакции.
Эта
реакция начинается при 10 млн градусов и протекает за ничтожные доли секунды при взрыве термоядерной бомбы, причем выделяется гигантское по масштабам Земли количество энергии.Водородные бомбы иногда сравнивают с Солнцем. Однако мы уже видели, что на Солнце идут медленные и стабильные термоядерные процессы. Солнце дарует нам жизнь, а водородная бомба – сулит смерть...
Слайд 49Но когда-нибудь настанет время – и это время не за
горами, – когда мерилом ценности станет не золото, а энергия.
И тогда изотопы водорода спасут человечество от надвигающегося энергетического голода: в управляемых термоядерных процессах каждый литр природной воды будет давать столько же энергии, сколько ее дают сейчас 300 л бензина. И человечество будет с недоумением вспоминать, что было время, когда люди угрожали друг другу животворным источником тепла и света...Слайд 51 § 26 – 27, стр. 76; упр. № 4
- 11.
Творческое задание «Почему Водород называют топливом будущего?»
Домашнее задание
Слайд 521. Я узнал(а) много нового.
2. Мне это пригодится в жизни.
3.
На уроке было над чем подумать.
4. На все возникшие у
меня вопросы, я получил(а) ответы.5. На уроке я поработал(а) добросовестно.