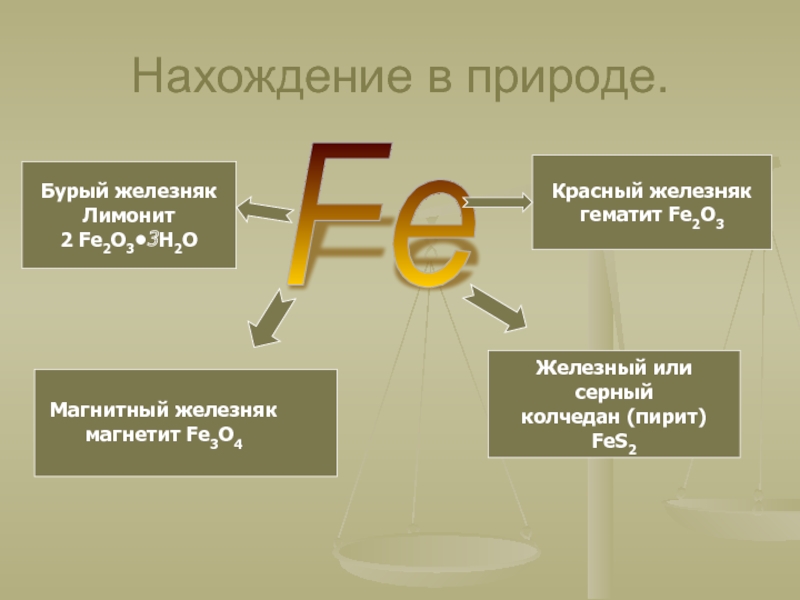
окружающей нас природы, оно – основа культуры и промышленности, оно
– орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества.А. Е. Ферсман.
Методическая разработка урока