Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алгебраический метод решения задач В-9 - элемент решения задач С4
Содержание
- 1. Алгебраический метод решения задач В-9 - элемент решения задач С4
- 2. Задача 1. В 150 г
- 3. Задача 2 . Смешали 120 г раствора
- 4. Задача 3. К 180,0 г 8%-ного раствора
- 5. Задача 4. К 200 г 10%-ного раствора
- 6. Задача 5. Определите массу воды, которую надо
- 7. Разберем решение двух видов задач из С4 ЕГЭ
- 8. Задача 6. Рассчитайте, какую массу оксида серы
- 9. m2(Н2SО4)= m1(Н2SО4)+ m*(Н2SО4),где m*(Н2SО4) – масса серной
- 10. Задача 7. Рассчитайте, сколько граммов карбида алюминия
- 11. Принимаем n(Al4C3)=
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Алгебраический метод решения задач В-9 – элемент решения задач С4
МОУ
«Инзенская средняя общеобразовательная школа №4»
Слайд 2Задача 1. В 150 г воды растворили 50
г фосфорной кислоты. Найти массовую долю кислоты в полученном растворе.
Решение:
ω=m(р.в.)/m(р-ра)×100%
m(р-ра)=m(Н2О)+m(Н3РО4)=50+150=200г
ω=50/(200) ×100%=25%. Ответ: 25%.
150 г
Н2О
50 г
Н3РО4
150 г
Н2О
50 г
Н3РО4
Анализ условия задачи!
Раствор
m(р-ра)=150 +50=200г
ω(Н3РО4)=?
Поиск решения- выдвижение плана решения задачи!
Реализация плана решения!
Слайд 3Задача 2 . Смешали 120 г раствора серной кислоты с
массовой долей 20% и 40 г 50%-ного раствора того же
вещества. Массовая доля кислоты в полученном растворе равна ___ %.ω3=m3(Н2SО4)/ m(р-ра3)×100%
m3(Н2SО4)= m1(Н2SО4)+ m2(Н2SО4)=ω1× m(р-ра1)+
+ ω2× m(р-ра2)=120×0,2 + 40×0,5= 24+20=44 г
ω3= 44/160 × 100% = 27,5%. Ответ: 27,5%.
Н2О
Н2SО4
Раствор 1
m(р-ра1)=120 г
ω1=20%=0,2
Н2О
Н2SО4
Раствор 2
m(р-ра2)=40 г
ω2=50%=0,5
Н2О
Н2SО4
Н2О
Н2SО4
Раствор 3
m(р-ра3)= m(р-ра1)+ m(р-ра2)= 120 +40=160г
ω3=?
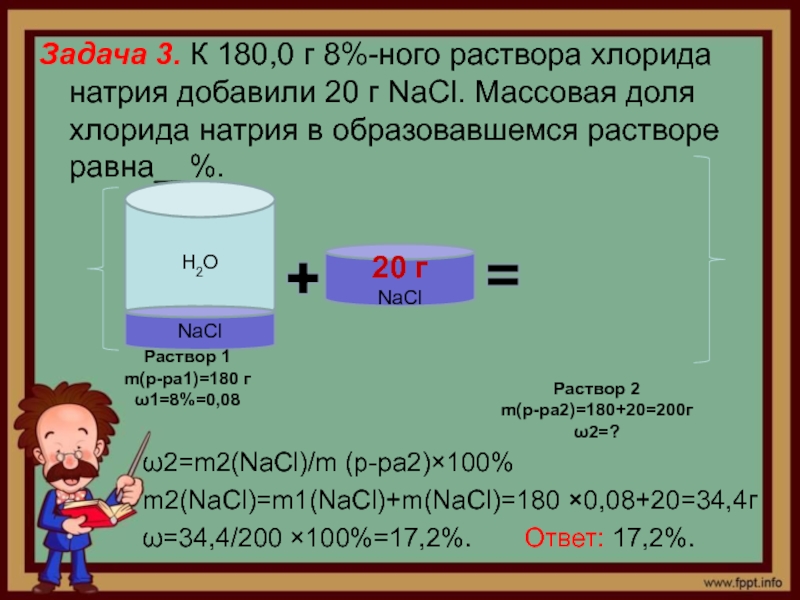
Слайд 4Задача 3. К 180,0 г 8%-ного раствора хлорида натрия добавили
20 г NaCl. Массовая доля хлорида натрия в образовавшемся растворе
равна__%.ω2=m2(NaCl)/m (р-ра2)×100%
m2(NaCl)=m1(NaCl)+m(NaCl)=180 ×0,08+20=34,4г
ω=34,4/200 ×100%=17,2%. Ответ: 17,2%.
Н2О
20 г
NaCl
NaCl
Н2О
NaCl
20 г
NaCl
Раствор 1
m(р-ра1)=180 г
ω1=8%=0,08
Раствор 2
m(р-ра2)=180+20=200г
ω2=?
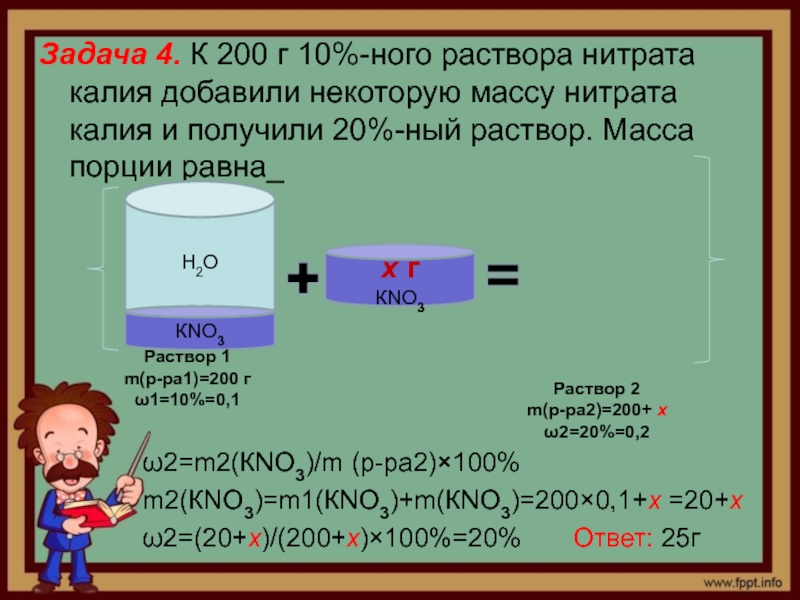
Слайд 5Задача 4. К 200 г 10%-ного раствора нитрата калия добавили
некоторую массу нитрата калия и получили 20%-ный раствор. Масса порции
равна_ω2=m2(КNО3)/m (р-ра2)×100%
m2(КNО3)=m1(КNО3)+m(КNО3)=200×0,1+х =20+х
ω2=(20+х)/(200+х)×100%=20% Ответ: 25г
Н2О
х г
КNО3
КNО3
Н2О
КNО3
х г
КNО3
Раствор 1
m(р-ра1)=200 г
ω1=10%=0,1
Раствор 2
m(р-ра2)=200+ х
ω2=20%=0,2
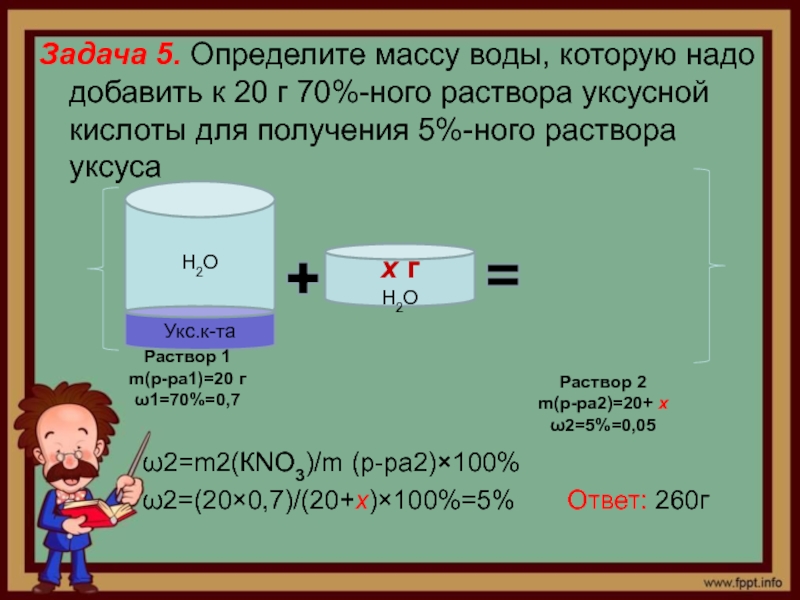
Слайд 6Задача 5. Определите массу воды, которую надо добавить к 20
г 70%-ного раствора уксусной кислоты для получения 5%-ного раствора уксуса
ω2=m2(КNО3)/m (р-ра2)×100%
ω2=(20×0,7)/(20+х)×100%=5% Ответ: 260г
Н2О
х г
Н2О
Укс.к-та
Н2О
Укс.к-та
х г
Н2О
Раствор 1
m(р-ра1)=20 г
ω1=70%=0,7
Раствор 2
m(р-ра2)=20+ х
ω2=5%=0,05
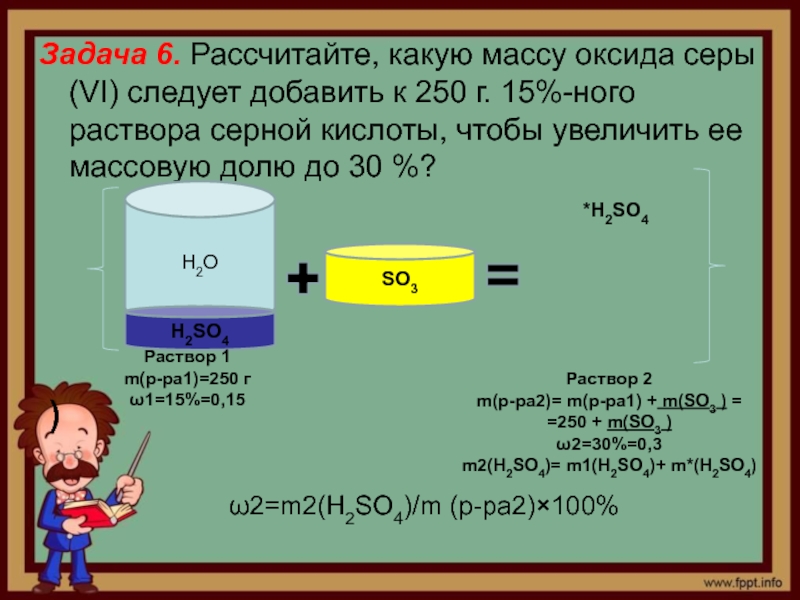
Слайд 8Задача 6. Рассчитайте, какую массу оксида серы (VI) следует добавить
к 250 г. 15%-ного раствора серной кислоты, чтобы увеличить ее
массовую долю до 30 %?)
ω2=m2(Н2SО4)/m (р-ра2)×100%
Н2О
SО3
Н2SО4
Н2О
Н2SО4
SО3
Раствор 1
m(р-ра1)=250 г
ω1=15%=0,15
Раствор 2
m(р-ра2)= m(р-ра1) + m(SО3 ) = =250 + m(SО3 )
ω2=30%=0,3
m2(Н2SО4)= m1(Н2SО4)+ m*(Н2SО4)
*Н2SО4
Слайд 9m2(Н2SО4)= m1(Н2SО4)+ m*(Н2SО4),
где m*(Н2SО4) – масса серной кислоты, образовавшейся в
ходе реакции
SО3 +Н2О = Н2SО4.
m1(Н2SО4)= ω1(Н2SО4) × ω1(Н2SО4)=250 ×0,15=37,5 г
Принимаем
n(SО3)= Х моль, тогда n*(Н2SО4)= Х мольm*(Н2SО4)=М(Н2SО4) × n*(Н2SО4) = 98 Х,
m(SО3)= М(SО3) × n(SО3) = 80 Х.
Подставляем все найденные значения и выражения в исходную формулу для нахождения массовой доли
ω2=m2(Н2SО4)/m (р-ра2)×100% =
=(37,5 + 98 Х)/ (250+ 80 Х) ×100% =30%;
Х=0,51 моль
m(SО3)= 80 Х= 80 ×0,51=40,8 г Ответ: 40,8 г
Слайд 10Задача 7. Рассчитайте, сколько граммов карбида алюминия следует добавить к
150 г 21%-ного раствора азотной кислоты, чтобы ее массовая доля
уменьшилась втрое?Решение:
Al4C3+12HNO3=4Al(NO3)3+3CH4↑
ω2=m2(HNO3)/m (р-ра2)×100%
m2(HNO3)= m1(HNO3)- m*(HNO3),
где m1(HNO3)= 150×0,21= 31.5 г,
m(р-ра2)= m(р-ра1) + m(Al4C3) – m(CH4)
а m*(HNO3) – масса кислоты,
израсходованная на реакцию с Al4C3.
Слайд 11Принимаем n(Al4C3)= Х моль,
тогда n*(HNO3)=12Х моль, n(CH4)=3Х моль.
Соответственно:m(Al4C3) = М(Al4C3)×n(Al4C3)= 144 Х
m*(HNO3)=М(HNO3)×n*(HNO3)=63×12Х=756Х,
m(CH4)=М(CH4)×n(CH4)=16×3Х = 48Х
Поставляем все найденные значения и выражения в исходную формулу
ω2=m2(HNO3)/m (р-ра2)×100% =
=(m1(HNO3)-m*(HNO3))/(m(р-ра1)+m(Al4C3)–m(CH4))
ω2=(31,5-756Х)/(150+ 144 Х - 48Х) = 0,21 / 3
Х = 0,027 моль
m(Al4C3) = 144 Х =144 × 0,027 = 3,96 г.