Слайд 1Брэнды и дженерики
Потапов Александр Петрович
врач-кардиолог, к.м.н.
Слайд 2Зачем фармацевту информация об особенностях дженериков?
Исключение претензий со стороны потребителей
после приобретения ими в аптеке «кота в мешке»
Повышение уровня продаж
оригинальных препаратов – увеличение прибыли предприятия
Предотвращение ситуаций сообщения пациентам неполной или недостоверной информации о препарате
Слайд 3Особенности национальной любви к дженерикам
Недостаточная осведомленность населения в области фармакологии
и фармакотерапии
Низкий уровень разъяснительной работы среди населения в области лекарственной
безопасности
Низкая покупательная способность пациентов
Более доступная цена
Возможная сопоставимая терапевтическая эффективность (все-таки они помогают)
Коммерческая эффективность
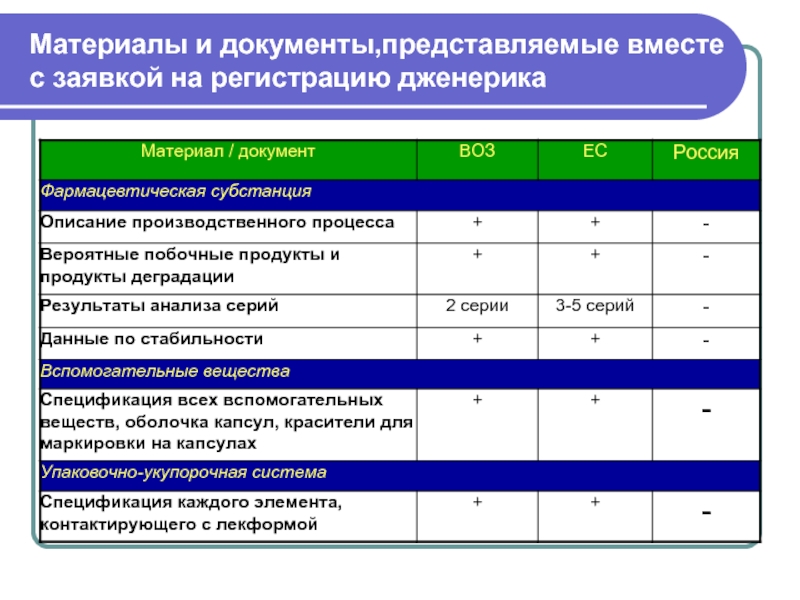
Слайд 4Материалы и документы,представляемые вместе
с заявкой на регистрацию дженерика
Слайд 5«Засилие» дженериков
В Российской Федерации зарегистрировано более 17 000 наименований лекарственных
препаратов
78% из них являются «аналогами» оригинальных препаратов
Слайд 6Примеры сравнения брэндов и дженериков
Амлодипин и норваск
Амиодарон и кордарон
Ренитек и
энам
Козаар и лозап
Конкор и бисогамма
Диротон и лизиноприл
Верапамил и изоптин
Коринфар и
адалат
Седуксен и реланиум
Эгилок, беталок ЗОК и метопролол
Слайд 7Оригинальный препарат
Original (англ.) – первый, новый, истинный, прежде неизвестный, предшествующий,
исходный…
Новый препарат, произведенный на основе разработки новых активных субстанций
Патент и
эксклюзивные права 20 лет принадлежат компании-создателю
Регистрируется на основании доказательных данных многоцентровых рандомизированных исследования
Слайд 8Дженерик
Generic (англ.) – общий, родовой, групповой
Дже́нерик (иногда — генерик, женерик)
—лекарственное средство, которое выпускается без лицензии компании-разработчика инновационного лекарственного средства,
и размещается на рынке после окончания срока действия патента или других исключительных прав
Все воспроизведения оригинального препарата, непатентованные копии
Регистрируются на основании «биоэквивалентности*»
В России в большинстве случаев патентное право защищает не молекулу, а процесс
Состав таблетки НЕ идентичен оригиналу
* - исследования по биоэквивалентности часто не проводятся
Слайд 9Критерии сравнения
Дженерик содержит то же активное лекарственное вещество (субстанцию), что
и оригинальный (патентованный) препарат.
Дженерик отличается от оригинального препарата вспомогательными (?)
веществами (неактивными ингредиентами, наполнителями, консервантами, красителями и др.).
Различия наблюдаются и в самом технологическом процессе производства дженериков.
Соблюдение технологии производства и контроль качества выпускаемой продукции у брендов всегда на более высоком уровне
Слайд 10Эквивалентность брэндов и дженериков (требования FDA)
Фармацевтически эквивалентные лекарственные препараты содержат
одинаковые активные ингредиенты в одинаковой лекарственной форме, предназначены для одного
способа введения и идентичны по силе действия или концентрации активных веществ (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000).
Биоэквивалентные лекарственные препараты — это фармацевтически эквивалентные или фармацевтически альтернативные препараты, которые имеют сравнимую биодоступностъ при исследовании в сходных экспериментальных условиях (FDA, Electronic Orange Book, Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000).
Эквивалентность препаратов оценивается также по уровню требований к контролю качества производства (соответствие стандартам GMP), к инструкциями к лекарствам, к этикетированию и т.д.
Эквивалентность лекарств оценивается также по физико-химическим свойствам действующих веществ (степень дисперсности, полиморфизм и др.), свойствам вспомогательных веществ, особенностям технологического процесса, условиям хранения, упаковке (стекло, пластмасса, бумага и т.п.).
Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000).

Слайд 11Фармацевтическая эквивалентность
Фармацевтически эквивалентные лекарственные препараты содержат одинаковые активные ингредиенты в
одинаковой лекарственной форме, предназначены для одного способа введения и идентичны
по силе действия или концентрации активных веществ (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000).
Стоимость субстанции (действующего вещества) составляет 50% себестоимости лекарственного средства
Дженериковые компании постоянно совершенствуют способы снижения стоимости вспомогательных веществ
Вспомогательные вещества могут на 50% изменять терапевтическую эффективность и биодоступность фармацевтического средства
Выявление многих токсических примесей возможно только благодаря специальному химическому анализу, не предусмотренному в фармакопейных статьях РФ
Слайд 12Дженерики содержат примеси в количестве несколько раз превышающем содержание таковых
в оригинальном Липримаре®1,2
Слайд 13Electronic Orange Book – результаты поиска
Периндаприл (Perindapril)– не зарегистрирован
Аторвастатин –
кодуэт, липитор (PFIZER)
Квинаприл – квинаретик (ACTAVIS); квинаприл (AUROBINDO, MYLAN, GENPHARM,
INVAGEN, LUPIN, RANBAXY, SANDOZ, TEVA, TORPHARM, WATSON LABS FLORIDA); аккуретик*, аккуприл* (PFIZER)
Амлодипин – норваск* (PFIZER) + 22 фирмы (в т.ч. DR REDDYS LABS LTD и GEDEON RICHTER USA)
Ренитек – нет (в т.ч. и поиск по эналаприлам)
Лизиноприл – 42 фирмы
Бисопролол – 7 фирм
Лозартан – козаар*, гизаар* (MERCK)
Симвастатин – зокор 80* (MERCK), симвастатин (15 фирм)
Триметазидин (Trimetazidine) – нет регистрации
Клонидин (клофелин) – 11 фирм
Слайд 14Рекомендации ВОЗ в отношении биоэквивалентности
Биоэквивалентность дженерика следует определять по
отношению к оригинальному лекарственному препарату.
Если он не представлен на
национальном рынке, то его берут из указанного в перечне (первичный рынок), где, по мнению компании-производителя, он более всего отвечает требованиям, предъявляемым к качеству, безопасности, эффективности и маркировке.
При невозможности использования оригинального лекарственного препарата стандартом может служить лекарственный препарат, лидирующий на рынке страны, если подтверждены его качество, безопасность и эффективность.
При отсутствии препарата-лидера регистрируемый дженерик производят в соответствии с местными, государственными или региональными стандартами, в том числе Международной фармакопеей и Руководством ВОЗ по регистрационным требованиям для определения взаимозаменяемости лекарственных препаратов, выпускаемых несколькими производителями (WorldHealth Organization, 1996, WHO Expert Expert Committee on Specifications for Pharmaceutical Preparations: thirty-fourth report. WHO Technical Report Series No. 863, Geneva, pp. 114-154).

Слайд 15Терапевтическая эквивалентность
Терапевтически эквивалентными лекарственные препараты могут считаться только в том
случае, если они фармацевтически эквивалентны и можно ожидать, что они
будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000).
В отличие от биоэквивалентности, определение которой регламентируется жесткими стандартами и не вызывает, как правило, неоднозначностей в трактовке результатов, отсутствие четких определений терапевтической эквивалентности приводит к неуверенности как врачей, так и пациентов в правильности выбора тех или иных препаратов генерического ряда.
В опубликованном в 1998 году FDA проекте правил оценки терапевтической эквивалентности дженериков предлагается указывать на этикетке препарата наличие или отсутствие терапевтической эквивалентности, а также препарат, с которым производилось сравнение (как правило, это оригинальный препарат).
Слайд 16Мнение специалиста
Марцевич Сергей Юрьевич Профессор, доктор медицинских наук.
Профессор кафедры
доказательной медицины ФДПОП ММА им М.И. Сеченова. Председатель секции рациональной
фармакотерапии ВНОК,
член-корреспондент Российской академии естественных наук
«Знакомство с данными … исследований по сравнению клинической эффективности оригинальных препаратов и дженериков показывает, что в их действии могут наблюдаться весьма существенные отличия…»
«…все крупные исследования, оценивающие влияние препарата на прогноз жизни и заболевания, в огромном большинстве используют только оригинальные лекарственные препараты…»
Слайд 17Эффективность ренитека и его дженериков (Петров В.И., Недогода С.В., 1999)
Энап: Акрихин/КРКА, Словения/РФ; Энам: Д-р Редис Лабораторис Лтд, Индия
Слайд 18Дженерики: преимущества и недостатки
Таблиц взаимозаменяемости дженерических препаратов в РФ не
существует.
В Интернете можно воспользоваться таблицами из базы FDA (Electronic
Orange Book FDA).
Дженерики не хуже и не лучше оригинальных ЛС, они - иные ЛС. Пример: дженерики аторвастатина -
аторвастатин в аморфной форме
распад в течение 7 недель в 10 раз быстрее оригинального препарата
содержат примеси от 2 до 10% (оригинальный препарат менее 1%).
ЗЫРЯНОВ Сергей Кенсоринович,
доц. кафедры клинической фармакологии РГМУ
Слайд 19
Electronic Orange Book
Approved Drug Products
with
Therapeutic Equivalence Evaluations
Current through December 2008**
** In
order to provide timely consumer information on generic drugs,
the
Electronic Orange Book is updated daily as new generic approvals occur.
Refer to FAQ for additional information.
Оранжевая книга FDA
U.S. Department of Health and Human Services
Food and Drug Administration
Center for Drug Evaluation and Research
Office of Pharmaceutical Science
Office of Generic Drugs
Слайд 20Сравнение терапевтической эффективности липримара и его дженериков
Эффективная дозировка – от
20 мг/сут
Скорость наступления клинических эффектов – 25-40 дней постоянного приема
Клинические
эффекты:
Урежение приступов загрудинных болей, повышение порога переносимых физических нагрузок
Снижение среднесуточного АД
Уменьшение и полное исчезновение аритмий
На фоне применения аториса, атомакса и торвакарда подобных клинических эффектов не зарегистрировано
Слайд 21при принятии врачом решения о переводе пациента с оригинального препарата
на генерический у 2/3 больных возникали проблемы,
средний показатель при
других видах замен ЛС (с дженерика на оригинальный, с дженерика на дженерик) составил 10%.
Результаты исследования FDA 1996 г.
Слайд 22Мнение Association of American Physicians (основана в 1885 г.)
Американская ассоциация
врачей не рекомендует в качестве замены отпускать лекарственный препарат, которому
FDA присвоило код «В» (в США к категории препаратов с кодом «В» FDA относит лекарственные средства, которые по разным причинам в данный момент нельзя считать терапевтически эквивалентными соответствующим препаратам сравнения) (Drug evaluations annual, American Medical Association, 1999, p. 7).
Любой врач в США может легко узнать код нужного ему рецептурного лекарственного препарата, заглянув в ежегодно переиздаваемую «Оранжевую книгу», доступную и в сети Интернет.
В руководстве ВОЗ по регистрационным требованиям, предъявляемым для определения взаимозаменяемости генерических лекарственных препаратов, также указывается, что «невозможность гарантировать взаимозаменяемость (лекарственных препаратов) может нанести вред здоровью и безопасности пациентов»
(WHO Technical Report Series, No. 863, 1996).
Слайд 23Особенности отечественного амлодипина
Компания «Pfizer» не передавала лицензию на производство и
распространение «Норваска»
Действие глобального патента на Норваск завершилось лишь в 2008
году!
Существующие на российском рынке другие амлодипины («дженерики») были выпущены до завершения действия глобального патента
Слайд 24Особенности дженериков аторвастатина
Компания «Pfizer» не передавала лицензию на производство и
распространение «Липримара»
Глобальный патент на «Липримар» действует до 2011 года
Все другие
аторвастатины («дженерики») являются непатентованными копиями
Слайд 25Что общего между ЛИПРИМАРОМ® и его дженериками?
Что общего между
алмазом
и углем?
Слайд 26Почему все-таки
Оригинальный препарат?
Оригинальный препарат:
Стабильность физико-химических свойств действующего
вещества
Высококачественные наполнители и оболочка
Доказательства высокой эффективности и безопасности
Копия
(дженерик):
Наличие токсических веществ, продуктов деградации и распада
Меньший срок годности
Измененные показатели биодоступности
Высокий риск токсических и аллергических реакций
Риск неожиданных межлекарственных взаимодействий
Отсутствие доказательств эффективности и безопасности
Слайд 28Е.М. Тареев
«Для того, чтобы в наш век лечиться, нужно иметь
хорошее здоровье!»
Академик Академии медицинских наук СССР (1948), Герой Социалистического Труда
(1965), лауреат Сталинской (1946), Ленинской (1974), и Государственной премий СССР (1983), заслуженный деятель науки РСФСР(1948). Один из основоположников советской нефрологии, гепатологии, ревматологиии паразитологии.
Слайд 29иАПФ, зарегистрированные в США
(результаты поиска в Electronic Orange Book
по “…pril”
Беназеприл - 20
Каптоприл - 16
Эналаприл - 25
Фозиноприл - 10
Лизиноприл
– 42
Моэксиприл - 11
Квинаприл - 28
Рамиприл – 24
Трандалоприл - 20
Периндаприл (PERINDAPRIL)– нет
Цилазаприл (CILAZAPRIL) - нет
Спираприл (SPIRAPRIL) - нет
Зофеноприл (ZOFENOPRIL) - нет
Слайд 30Сравнение количества ТН иАПФ, зарегистрированных в США
Слайд 31Маркировка лекарственных средств по системе FDA
A Drug products that FDA
considers to be therapeutically equivalent to other pharmaceutically equivalent products, i.e., drug
products for which:
(1) there are no known or suspected bioequivalence problems. These are designated AA, AN, AO, AP, or AT, depending on the dosage form; or
(2) actual or potential bioequivalence problems have been resolved with adequate in vivo and/or in vitro evidence supporting bioequivalence. These are designated AB.
B Drug products that FDA at this time, considers NOT to be therapeutically equivalent to other pharmaceutically equivalent products, i.e.,
drug products for which actual or potential bioequivalence problems have not been resolved by adequate evidence of bioequivalence. Often the problem is with specific dosage forms rather than with the active ingredients. These are designated BC, BD, BE, BN, BP, BR, BS, BT, BX, or B*.AA Products in conventional dosage forms not presenting bioequivalence problems
Products coded as AA contain active ingredients and dosage forms that are not regarded as presenting either actual or potential bioequivalence problems or drug quality or standards issues. However, all oral dosage forms must, nonetheless, meet an appropriate in vitro bioequivalence standard that is acceptable to the Agency in order to be approved.
Код «А» - препарат с подтвержденной терапевтической эквивалентностью (сведения о прблемах биоэквивалентности препарата отсутствуют)
Код «АВ» - то же, что и код «А», но сведения о прблемах биоэквивалентности имели место (но были опровергнуты дополнительными исследованиями)
Код «В» - терапевтическая эквивалентность препарата не подтверждена