Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гормоны поджелудочной железы
Содержание
- 1. Гормоны поджелудочной железы
- 2. ИнсулинИнсули́н (от лат. insula — остров) —
- 3. Синтез инсулина в клеткеСинтез и выделение инсулина
- 4. Структурная формулаНа схеме показана последовательность аминокислот в
- 5. Секреция инсулинаБета-клетки островков Лангерганса поджелудочной железы чувствительны
- 6. Регуляция образования и секреции инсулина Главным стимулятором
- 7. Механизм действия инсулина Так или иначе, инсулин
- 8. Эффекты вызываемые инсулиномФизиологические эффекты инсулина Инсулин оказывает
- 9. Регуляция уровня глюкозы в кровиПоддержание оптимальной концентрации
- 10. Заболевания, связанные с действием инсулинаГипергликемия — увеличение
- 11. ГлюкагонГлюкагон (син. гипергликемическо-гликогенолитический фактор) - белково-пептидный гормон
- 12. Секреция и синтез глюкагонаГормон синтезируется в альфа-клетках
- 13. Механизм действия и эффекты глюкагонаГлюкагон воздействует главным
- 14. Действие глюкагонаГлюкагон оказывает сильное инотропное и хронотропное
- 15. ЗаключениеИнсулин – гормон поджелудочной железы. Необходимость в
- 16. Скачать презентанцию
ИнсулинИнсули́н (от лат. insula — остров) — гормон пептидной природы. Молекула инсулина образована двумя полипептидными цепями, содержащими 51 аминокислотный остаток: A-цепь состоит из 21 аминокислотного остатка, B-цепь образована 30 аминокислотными остатками.
Слайды и текст этой презентации
Слайд 3Синтез инсулина в клетке
Синтез и выделение инсулина представляют собой сложный
процесс, включающий несколько этапов. Первоначально образуется неактивный предшественник гормона, который
после ряда химических превращений в процессе созревания превращается в активную форму. Ген, кодирующий первичную структуру предшественника инсулина, локализуется в коротком плече 11 хромосомы. На рибосомах шероховатой эндоплазматической сети синтезируется пептид-предшественник - т.н. препроинсулин. Он представляет собой полипептидную цепь, построенную из 110 аминокислотных остатков и включает в себя расположенные последовательно: L-пептид, B-пептид, C-пептид и A-пептид. Почти сразу после синтеза в ЭПР от этой молекулы отщепляется сигнальный (L) пептид - последовательность из 24 аминокислот, которые необходимы для прохождения синтезируемой молекулы через гидрофобную липидную мембрану Эндоплазматический ретикулум (ЭПР). Образуется проинсулин, который транспортируется в комплекс Гольджи, далее в цистернах которого происходит так называемое созревание инсулина. Созревание является наиболее длительным этапом образования инсулина. В процессе созревания из молекулы проинсулина с помощью специфических эндопептидаз вырезается C-пептид - фрагмент из 31 аминокислоты, соединяющий B-цепь и A-цепь. То есть молекула проинсулина разделяется на инсулин и биологически инертный пептидный остаток. В секреторных гранулах инсулин, соединяясь с ионами цинка, образует кристаллические гексамерные агрегаты.Слайд 4Структурная формула
На схеме показана последовательность аминокислот в молекуле инсулина: А-цепь
содержит 21 аминокислотный остаток, Б-цепь – 30.
Для сравнения показана структурная
формула инсулина в виде объемной шаростержневой модели.Слайд 5Секреция инсулина
Бета-клетки островков Лангерганса поджелудочной железы чувствительны к изменению уровня
глюкозы в крови; выделение ими инсулина в ответ на повышение
концентрации глюкозы реализуется по следующему механизму:Глюкоза свободно транспортируется в бета-клетки специальным белком-переносчиком GluT 2
В клетке глюкоза подвергается гликолизу и далее окисляется в дыхательном цикле с образованием АТФ; интенсивность синтеза АТФ зависит от уровня глюкозы в крови.
АТФ регулирует закрытие ионных калиевых каналов, приводя к деполяризации мембраны.
Деполяризация вызывает открытие потенциал-зависимых кальциевых каналов, это приводит к току кальция в клетку.
Повышение уровня кальция в клетке активирует фосфолипазу C, которая расщепляет один из мембранных фосфолипидов - фосфатидилинозитол-4,5-бифосфат - на инозитол-1,4,5-трифосфат и диацилглицерат.
Инозитолтрифосфат связывается с рецепторными белками ЭПР. Это приводит к высвобождению связанного внутриклеточного кальция и резкому повышению его концентрации.
Значительное увеличение концентрации в клетке ионов
кальция приводит к высвобождению заранее синтезированного
инсулина, хранящегося в секреторных гранулах. В зрелых
секреторных гранулах кроме инсулина и C-пептида находятся
ионы цинка и небольшие количества проинсулина и промежуточных
форм. Выделение инсулина из клетки происходит путём
экзоцитоза - зрелая секреторная гранула приближается
к плазматической мембране и сливается с ней, и содержимое
гранулы выдавливается из клетки. Изменение физических свойств
среды приводит к отщеплению цинка и распаду кристаллического
неактивного инсулина на отдельные молекулы, которые и обладают
биологической активностью.
Слайд 6Регуляция образования и секреции инсулина
Главным стимулятором освобождения инсулина является повышение
уровня глюкозы в крови. Дополнительно образование инсулина и его выделение
стимулируется во время приёма пищи, причём не только глюкозы или углеводов. Секрецию инсулина усиливают аминокислоты, особенно лейцин и аргинин, некоторые гормоны гастроэнтеропанкреатической системы: холецистокинин, ГИП, ГПП-1, а также такие гормоны, как глюкагон, АКТГ, СТГ, эстрогены и др., препараты сульфонилмочевины. Также секрецию инсулина усиливает повышение уровня калия или кальция, свободных жирных кислот в плазме крови. Понижается секреция инсулина под влиянием соматостатина. Бета-клетки также находятся под влиянием автономной нервной системы.Парасимпатическая часть (холинергические окончания блуждающего нерва) стимулирует выделение инсулина
Симпатическая часть (активация α2-адренорецепторов) подавляет выделение инсулина. Причём синтез инсулина заново стимулируется глюкозой и холинергическими нервными сигналами.
Слайд 7Механизм действия инсулина
Так или иначе, инсулин затрагивает все виды обмена
веществ во всём организме. Однако в первую очередь действие инсулина
касается именно обмена углеводов. Основное влияние инсулина на углеводный обмен связано с усилением транспорта глюкозы через клеточные мембраны. Активация инсулинового рецептора запускает внутриклеточный механизм, который напрямую влияет на поступление глюкозы в клетку путём регуляции количества и работы мембранных белков, переносящих глюкозу в клетку. В наибольшей степени от инсулина зависит транспорт глюкозы в двух типах тканей: мышечная ткань (миоциты) и жировая ткань (адипоциты) - это т.н. инсулинозависимые ткани. Составляя вместе почти 2/3 всей клеточной массы человеческого тела, они выполняют в организме такие важные функции как движение, дыхание, кровообращение и т. п., осуществляют запасание выделенной из пищи энергии.Подобно другим гормонам своё действие инсулин осуществляет через белок-рецептор. Инсулиновый рецептор представляет собой сложный интегральный белок клеточной мембраны, построенный из 2 субъединиц (a и b), причём каждая из них образована двумя полипептидными цепочками. Инсулин с высокой специфичностью связывается и распознаётся а-субъединицей рецептора, которая при присоединении гормона изменяет свою конформацию. Это приводит к появлению тирозинкиназной активности у субъединицы b, что запускает разветвлённую цепь реакций по активации ферментов, которая начинается с самофосфорилирования рецептора.
Весь комплекс биохимических последствий взаимодействия инсулина и рецептора ещё до конца не вполне ясен, однако известно, что на промежуточном этапе происходит образование вторичных посредников: диацилглицеролов и инозитолтрифосфата, одним из эффектов которых является активация фермента - протеинкиназы С, с фосфорилирующим (и активирующим) действием которой на ферменты и связаны изменения во внутриклеточном обмене веществ. Усиление поступления глюкозы в клетку связано с активирующим действием посредников инсулина на включение в клеточную мембрану цитоплазматических везикул, содержащих белок-переносчик глюкозы GluT 4. Комплекс инсулин-рецептор после образования погружается в цитозоль и в дальнейшем разрушается в лизосомах. Причём деградации подвергается лишь остаток инсулина, а освобождённый рецептор транспортируется обратно к мембране и снова встраивается в неё.
Слайд 8Эффекты вызываемые инсулином
Физиологические эффекты инсулина Инсулин оказывает на обмен веществ
и энергии сложное и многогранное действие. Многие из эффектов инсулина
реализуются через его способность действовать на активность ряда ферментов. Инсулин - единственный гормон, снижающий содержание глюкозы в крови, это реализуется через:усиление поглощения клетками глюкозы и других веществ;
активацию ключевых ферментов гликолиза;
увеличение интенсивности синтеза гликогена - инсулин форсирует запасание глюкозы клетками печени и мышц путём полимеризации её в гликоген;
уменьшение интенсивности глюконеогенеза - снижается образование в печени глюкозы из различных веществ
Анаболические эффекты инсулина
усиливает поглощение клетками аминокислот (особенно лейцина и валина);
усиливает транспорт в клетку ионов калия, а также магния и фосфата;
усиливает репликацию ДНК и биосинтез белка;
усиливает синтез жирных кислот и последующую их этерификацию - в жировой ткани и в печени инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина происходит обратное - мобилизация жиров.
Антикатаболические эффекты инсулина
подавляет гидролиз белков - уменьшает деградацию белков;
уменьшает липолиз - снижает поступление жирных кислот в кровь.
Слайд 9Регуляция уровня глюкозы в крови
Поддержание оптимальной концентрации глюкозы в крови
- результат действия множества факторов, сочетание слаженной работы почти всех
систем организма. Однако главная роль в поддержании динамического равновесия между процессами образования и утилизации глюкозы принадлежит гормональной регуляции. В среднем уровень глюкозы в крови здорового человека колеблется от 2,7 до 8,3 ммоль/л, однако сразу после приёма пищи концентрация резко возрастает на короткое время. Две группы гормонов противоположно влияют на концентрацию глюкозы в крови:единственный гипогликемический гормон - инсулин
и гипергликемические гормоны (такие как глюкагон, гормон роста и адреналин), которые повышают содержание глюкозы в крови
Когда уровень глюкозы опускается ниже нормального физиологического значения, высвобождение инсулина из B-клеток замедляется (но в норме никогда не останавливается). Если же уровень глюкозы падает до опасного уровня, высвобождаются так называемые контринсулярные (гипергликемические) гормоны (наиболее известный - глюкагон α-клеток панкреатических островков), которые вызывают высвобождение глюкозы из клеточных запасов в кровь.
Адреналин и другие гормоны стресса сильно подавляют выделение инсулина в кровь. Точность и эффективность работы этого сложного механизма является непременным условием нормальной работы всего организма, здоровья. Длительное повышенное содержание глюкозы в крови (гипергликемия) является главным симптомом и повреждающим фактором сахарного диабета. Гипогликемия - понижение содержания глюкозы в крови - часто имеет ещё более серьёзные последствия. Так, экстремальное падение уровня глюкозы может быть чревато развитием гипогликемической комы и смертью.
Слайд 10Заболевания, связанные с действием инсулина
Гипергликемия — увеличение уровня сахара в
крови. В состоянии гипергликемии увеличивается поступление глюкозы как в печень,
так и в периферические ткани. Как только уровень глюкозы зашкаливает, поджелудочная железа начинает вырабатывать инсулин.Гипогликемия — патологическое состояние, характеризующееся снижением уровня глюкозы периферической крови ниже нормы (обычно, 3,3 ммоль/л). Развивается вследствие передозировки сахароснижающих препаратов, избыточной секреции инсулина в организме. Гипогликемия может привести к развитию гипогликемической комы и привести к гибели человека.
Инсулинома — доброкачественная опухоль из бета-клеток поджелудочной железы, вырабатывающая избыточное количество инсулина. Клиническая картина характеризуется эпизодически возникающими гипогликемическими состояниями.
Инсулиновый шок — симптомокомплекс развивающийся при однократно введенной избыточной дозе инсулина. Наиболее полное описание можно встретить в учебниках по психиатрии, так как инсулиновые шоки применяли для лечения шизофрении.
Синдром хронической передозировки инсулина (синдром Сомоджи) — симптомокомплекс, развивающийся при длительном избыточном введении препаратов инсулина.
Слайд 11Глюкагон
Глюкагон (син. гипергликемическо-гликогенолитический фактор) - белково-пептидный гормон поджелудочной железы, участвующий
в регуляции углеводного обмена. Он является мощным контринсулярным гормоном и
его эффекты реализуются в тканях через систему вторичного посредника аденилатциклаза—цАМФ. В отличие от инсулина, глюкагон повышает уровень сахара крови, в связи с чем его называют гипергликемическим гормоном.Молекула глюкагона состоит из 29 аминокислот и имеет молекулярный вес 3485 дальтон. Глюкагон был открыт в 1923 году Кимбеллом и Мерлином.
Первичная структура молекулы глюкагона следующая:
Слайд 12Секреция и синтез глюкагона
Гормон синтезируется в альфа-клетках островков Лангерганса.
В
организме продуцируется также кишечный глюкагон (в толстой и тощей кишке,
двенадцатиперстной кишке), который иммунологически отличается от панкреатического глюкагона и имеет, по крайней мере, два компонента с молекулярным весом 7000 и 3000. Содержание глюкагона в крови в норме составляет 2 нг/мл. Он инактивируется во многих тканях, но особенно в печени.Физиологически секреция глюкагона стимулируется гипогликемией, например в условиях голодания. С другой стороны, после приема пищи секреция глюкагона также повышается, и обычно считают, что данный механизм стимулирует секрецию инсулина.
Предполагают, что в этом случае секретируется кишечный глюкагон, который не усиливает гликогенолиз. Кроме того, секреция глюкагона стимулируется при увеличении в крови аминокислот и подавляется при повышении концентрации жирных кислот или гипергликемии. Последний эффект относится к панкреатическому глюкагону, тогда как секреция кишечного глюкагона под влиянием гипергликемии стимулируется.
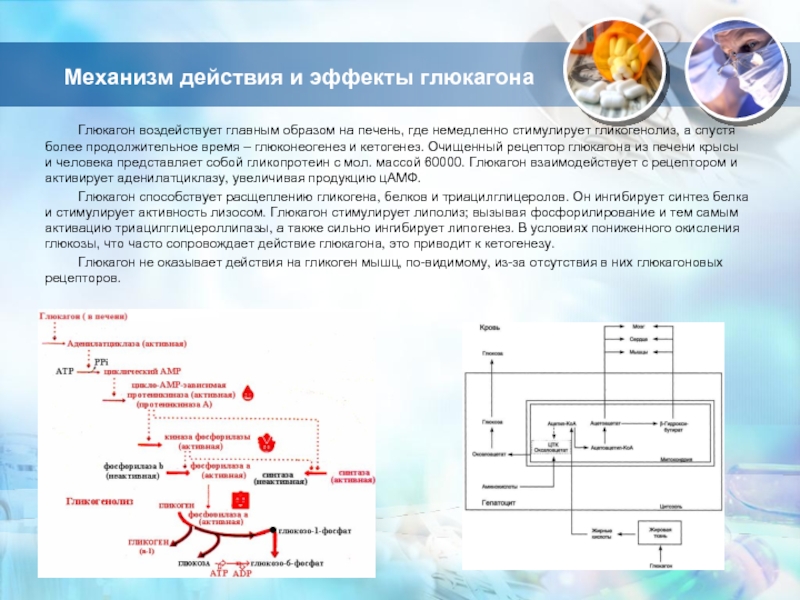
Слайд 13Механизм действия и эффекты глюкагона
Глюкагон воздействует главным образом на печень,
где немедленно стимулирует гликогенолиз, а спустя более продолжительное время –
глюконеогенез и кетогенез. Очищенный рецептор глюкагона из печени крысы и человека представляет собой гликопротеин с мол. массой 60000. Глюкагон взаимодействует с рецептором и активирует аденилатциклазу, увеличивая продукцию цАМФ.Глюкагон способствует расщеплению гликогена, белков и триацилглицеролов. Он ингибирует синтез белка и стимулирует активность лизосом. Глюкагон стимулирует липолиз; вызывая фосфорилирование и тем самым активацию триацилглицероллипазы, а также сильно ингибирует липогенез. В условиях пониженного окисления глюкозы, что часто сопровождает действие глюкагона, это приводит к кетогенезу.
Глюкагон не оказывает действия на гликоген мышц, по-видимому, из-за отсутствия в них глюкагоновых рецепторов.
Слайд 14Действие глюкагона
Глюкагон оказывает сильное инотропное и хронотропное действие на миокард
вследствие увеличения образования цАМФ (то есть оказывает действие, подобное действию
агонистов β-адренорецепторов, но без вовлечения β-адренергических систем в реализацию этого эффекта). Результатом является повышение артериального давления, увеличение частоты и силы сердечных сокращений;В высоких концентрациях глюкагон вызывает сильное спазмолитическое действие, расслабление гладкой мускулатуры внутренних органов, в особенности кишечника, не опосредованное аденилатциклазой;
Гипергликемия – при избытке и не своевременной секреции глюкагона;
Гипогликемия – при недостаточной секреции глюкагона.
О чём может сигнализировать избыток и недостаток глюкагона:
Значительное увеличение концентрации глюкагона в крови является признаком глюкагономы — опухоли а-клеток островков Лангерганса. Так же концентрация глюкагона в плазме крови может повышаться при сахарном диабете, феохромоцитоме, циррозе печени, болезни и синдроме Ицен-ко-Кушинга, почечной недостаточности, панкреатите, травме поджелудочной железы. Тем не менее повышение его содержания в несколько раз выше нормы отмечают только при глюкагон-секретирующих опухолях.
Низкая концентрация глюкагона в крови может отражать общее снижение массы поджелудочной железы, вызванное воспалением, опухолью или панкреатэктомией.
Слайд 15Заключение
Инсулин – гормон поджелудочной железы. Необходимость в котором возникает тогда,
когда в крови повышается содержание глюкозы. Бетта-клетки в этом случае
усиливают выброс инсулина, и он, попав в кровяное русло, начинает активно действовать. Во-первых, он делает мембраны клеток организма более проницаемыми для глюкозы, и клетки начинают поглощать ее, а во-вторых, способствует превращению глюкозы в гликоген, который откладывается в печени и мышцах. Благодаря этим мерам содержание сахара в крови снижается.Есть у инсулина антагонист. В роли его противника выступает гормон глюкагон, продуцируемый Альфа-клетками островков Лангерганса. Глюкагон все делает "наоборот". Если инсулин способствует отложению глюкозы в печени и мышцах в виде гликогена и снижает содержание сахара в крови, то глюкагон, напротив, включает механизмы, извлекающие гликоген из депо и повышающие содержание сахара в крови. Эти два гормона являются не только главными регуляторами уровня глюкозы в крови, но принимают участие в управлении деятельностью самой поджелудочной железы. При этом инсулин, в частности, стимулирует синтез пищеварительных ферментов железистыми клетками, а глюкагон тормозит их продукцию и блокирует выделение ферментов из клеток.
Теги