Слайд 2Водний об’єм організму тісно пов’язаний з електролітами.
Саме електролітам належить головна
роль в підтриманні осмотичного гомеостазу.
Електроліти беруть активну участь в утворенні
біоелектричного потенціалу клітин, переносі кисню, утворенні енергії тощо.
Електроліти перебувають у водних секторах організму в диссоційованому стані у вигляді іонів: катіонів та аніонів.
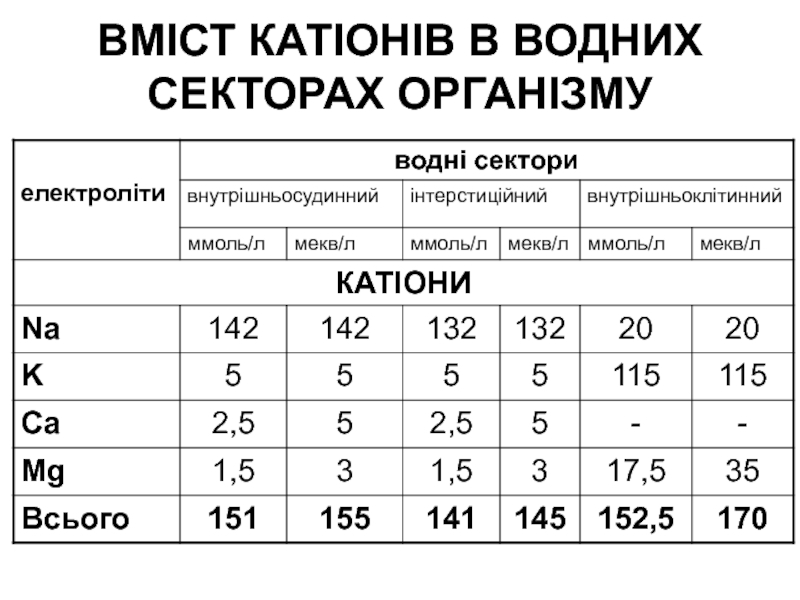
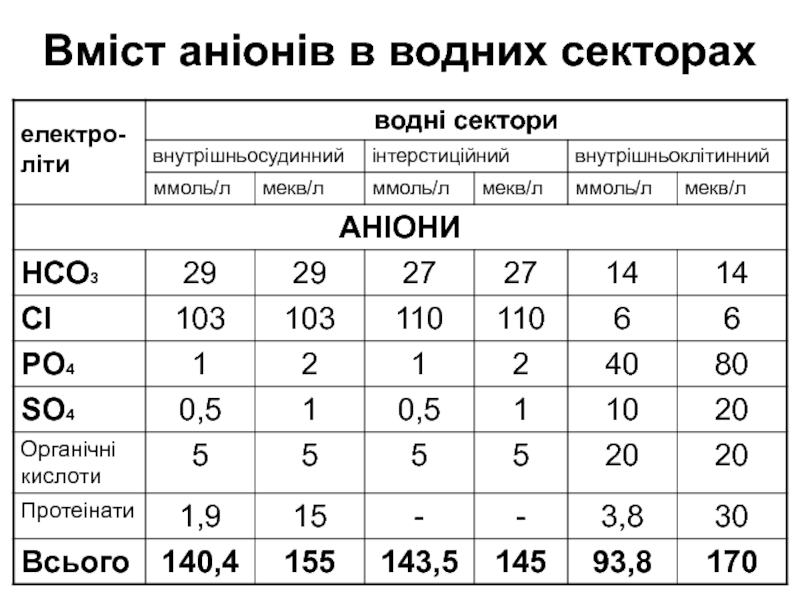
Основними катіонами позаклітинного простору є іони К та Na, їхня частка складає 95%.
Основними аніонами є хлориди та бікарбонати, частка яких становить близько 85%.
Слайд 3У внутрішньосудинному та інтерстиційному секторах рівномірно розподілені лише катіони кальцію
(Ca) та аніони бікарбонату (НСО3).
Концентрації решти електролітів суттєво різняться, що
залежить від їх специфічних функцій.
Слайд 4ВМІСТ КАТІОНІВ В ВОДНИХ СЕКТОРАХ ОРГАНІЗМУ
Слайд 5Вміст аніонів в водних секторах
Слайд 7З 1976 року, у відповідності до міжнародної системи (СІ), кількість
речовин в розчині прийнято виражати в міллімолях на один літр
(ммоль/л).
Поняття “осмолярність” є еквівалентним поняттю “молярність” або “молярна концентрація”.
Мілліеквівалентами користуються в тому випадку, коли бажають відобразити електричну зарядність розчину.
Слайд 8Міллімолі використовують для вираження молярної концентрації, тобто числа часток в
розчині, не залежно від того, несуть вони електричний заряд чи
то вони є електрично нейтральними.
Мілліосмолі – застосовують для того, щоб показати осмотичну силу розчину.
Поняття “міллімоль” та “мілліосмоль” для біологічних розчинів є ідентичними.
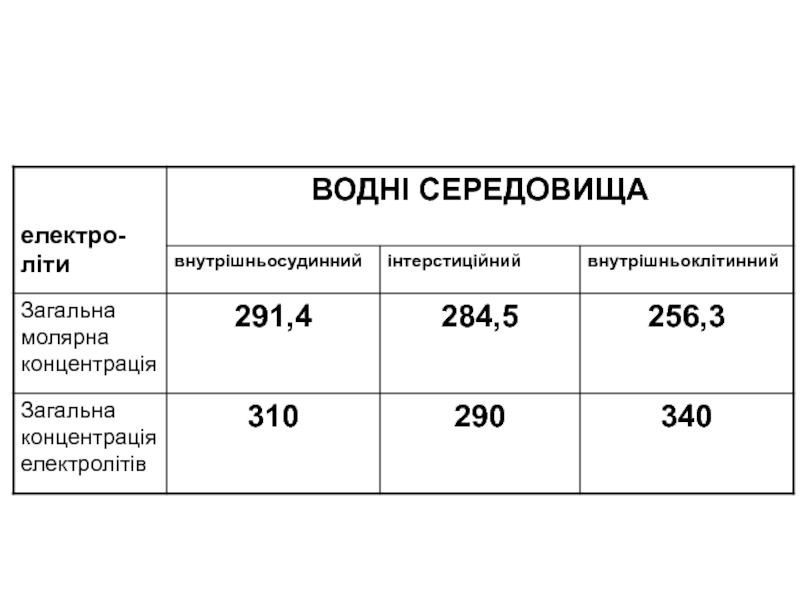
Слайд 9Осмолярність розчину виражають в міліосмолях (мосмоль), вона визначається кількістю міліосмолей,
розчинених в 1 літрі води іонів, та недисоційовані субстанції, такі,
як глюкоза, сечовина або речовини, що слабо дисоціюють, як то білок (саме концентрація білку визначає онкотичний тиск).
Осмолярність плазми в нормі є величиною сталою та становить 285-295 мосмоль/л.
Слайд 10Головними компонентами плазми, які обумовлюють її осмолярність, є розчинені в
ній іони Na (близько 140 мосмоль) та Cl (близько 100
мосмоль).
Міліеквівалент (м/екв) – це 1/1000 еквіваленту, тобто кількості хімічного елементу, яка з’єднується з однією ваговою частиною водороду або заміщує її. Для розрахунку даної величини необхідно знати іонну массу та величину заряду (валентність).
Слайд 11Моль (мілімоль = 1:1000 моль) – одиниця молярності, що відповідає
розчину, в 1 літрі якого розчинений 1 моль речовини.
Приклад. 1
молярний розчин глюкози означає, що в 1 літрі води розчинено 180 гр. глюкози, що відповідає її одномолярній концентрації.
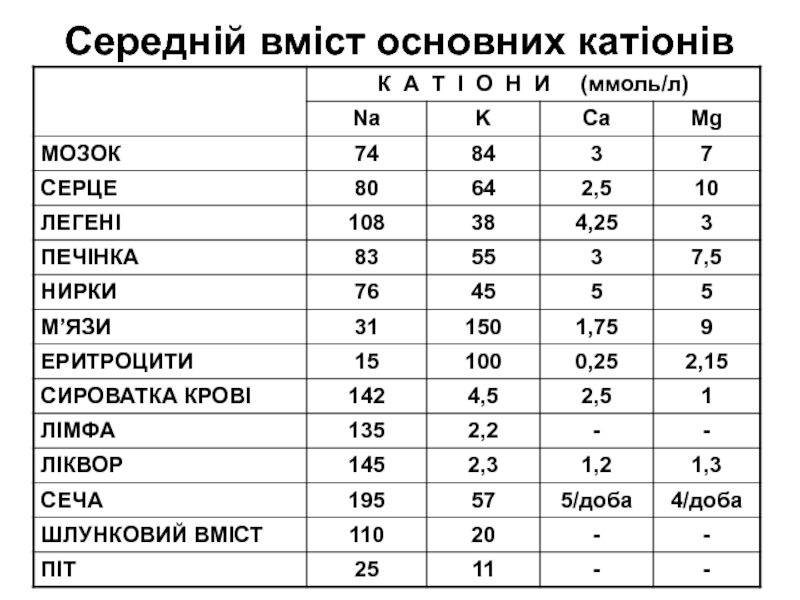
Слайд 12Середній вміст основних катіонів
Слайд 14ОБМІН НАТРІЮ
Знання величин середнього вмісту основних катіонів в деяких органах
та рідинах організму дозволяє провести правильну оцінку порушень електролітного обміну
при різній патології.
НАТРІЙ є найбільш важливим катіоном інтерстиційного простору.
При зменшенні його концентрації відбувається зниження осмотичного тиску з одночасним зменшенням об’єму інтерстиційного простору.
Слайд 15В організмі людини, яка важить 70 кг - загальний вміст
Na становить 4200 ммоль.
Лише 2,5 % зазначеної кількості Na знаходиться
в клітинах організму.
Близько 35% іонів Na щільно пов’язані з кристалічними структурами кісток та практично виключені з процесів обміну.
Решта частина іонів Na перебуває в так званій дифузійній рівновазі з Na плазми крові, що дозволяє компенсувати короткочасні втрати Na.
Слайд 16При зростанні концентрації натрію, відбувається зворотній процес.
Дефіцит Na не можна
компенсувати жодним іншим катіоном.
Існує лінійна залежність між дефіцитом плазми та
дефіцитом натрія.
Добова потреба в натрії для дорослої людини становить 5-10 гр.
Виведення натрію з організму здійснюється головним чином через нирки, незначна частина виділяється з потом.
ОБМІН НАТРІЮ
Слайд 17Раціон харчування та умови життя середньостатистичної людини Центральної Європи забезпечують
середньодобове вживання натрію на рівні 160-200 ммоль, це в свою
чергу відповідає 5-6% натрію, що бере участь в обміні. Швидкість такого обігу надмірно висока, та є однією з причин високої захворюваності на артеріальну гіпертензію у мешканців індустріально розвинених країн.
У мешканців країн, що розвиваються (Африка), які набагато рідше страждають на АГ обмін натрію в половину повільніший.
Слайд 18Рівень натрію крові зростає при тривалому лікуванні кортикостероїдами, проведенні тривалої
ШВЛ в режимі гіпервентиляції, нецукровому діабеті, при гіперальдостеронізмі.
Зниження концентрації натрію
в крові може спостерігатись у хворих, які тривалий час приймають сечогінні препарати, на тлі тривалої гепаринотерапії, у пацієнтів з хронічною серцевою недостатністю, при гіперглікемії, цирозі печінки, тощо.
1 мекв Na – 1 ммоль – 23 мг.
1 г Na – 43,5 ммоль.
ОБМІН НАТРІЮ
Слайд 19ОБМІН НАТРІЮ
РЕФЕРЕНТНІ ЗНАЧЕННЯ НОРМАЛЬНОГО РІВНЯ НАТРІЮ ПЛАЗМИ СТАНОВЛЯТЬ:
від 135 ммоль/л
до
146 ммоль/л
Слайд 20Гіпернатріемія – підвищення вмісту Na плазми крові понад 150 ммоль/л.
Гіпернатріемія
виникає за умови підвищення вмісту Na в інерстиційному просторі.
Гіпернатріемія супроводжується
перерозподілом рідини з внутрішньоклітинного сектору в позаклітинний, що призводить до дегідратації клітни.
В клінічній практиці описаний вище стан може виникати внаслідок підвищеного потовиділення, довенної інфузії гіпертонічного розчину NaCl, а також у пацієнтів з гострою нирковою недостатністю (ГНН).
ГІПЕРНАТРІЕМІЯ
Слайд 21Гіпонатріемія – зниження концентрації Na плазми крові менше 130 ммоль/л.
Розвиток
гіпонатріемії супроводжується гіпергідратацією клітин та зменшенням ОЦК.
Гіпонатріемія може виникати при
надлишковій секреції АДГ (зокрема, внаслідок впливу стресового або больового факторів), при патологічних втратах з ШКТ, надлишковій інфузії розчинів глюкози та/або безсольових розчинів.
ГІПОНАТРІЕМІЯ
Слайд 23В протилежність Na, практично весь калій, що міститься в організмі
(3300 ммоль) включений в метаболізм.
Лише 2,5 % іонів Калію знаходиться
в позаклітинному просторі.
Даний електроліт бере активну участь у всіх обмінних процесах організму, його обмін тісно пов’язаний з обміном НАТРІЮ.
Добова потреба дорослої людини в калії становить 60-80 ммоль (2,3 – 3,1 г).
КАЛІЙ
Слайд 24Калій – це основний внутрішньоклітинний катіон. В клітинах різних органів
і тканин міститься 98% зазначеного електроліту.
Калій, так само, як і
натрій відіграє провідну роль у формуванні мембранних потенціалів. Калій чинить значний вплив на рН та утилізацію глюкози.
1 гр. калія – 25,6 ммоль
в 1 гр. KCl міститься 13,4 ммоль К
1 мекв калія – 1 ммоль – 39,1 мг.
КАЛІЙ
Слайд 25Оскільки втрати К з позаклітинної рідини (при діареї, зловживанні сечогінними
засобами, внаслідок ацидозу, тощо) швидко компенсуються за рахунок його притоку
з клітин, концентрація К в позаклітинному просторі, як правило, тривалий час лишається в межах референтних значень.
В результаті, критичний дефіцит К, що може призводити до серцево-судиних та нервово-м’язових порушень, може лишатись непоміченим при звичайних дослідженнях (визначенні плазматичної концентрації К).
КАЛІЙ
Слайд 26Гіпокаліемія – зниження рівня калію плазми крові менше 3,5 ммоль/л.
Гіпокаліемія
розвивається на тлі надлишку натрію при метаболічному алкалозі, при гіпоксії,
підвищеному катаболізмі білка, проносі (діареї), тривалому блюванні, тощо.
При внутрішньоклітинному дефіциті калія в клітину починають проникати іони Na та Н, що в свою чергу призводить до розвитку внутрішньоклітинного ацидозу та гіпергідратації на фоні позаклітинного метаболічного алкалозу.
Клінічно цей стан проявляється порушенням серцевого ритму гіпотензією, зниженням тонусу посмугованих м’язів, парезом кишківника, а також порушеннями психічного стану.
ГІПОКАЛІЕМІЯ
Слайд 27ГІПОКАЛІЕМІЯ
На ЕКГ проявляються характерні зміни:
- тахікардія;
звуження комплексу QRS;
сплощення та інверсія
зубця Т;
зростання амплітуди зубця U.
Лікування гіпокаліемії слід розпочинати з ліквідації
етіологічного чинника, що призвів до зниження рівня К плазми, після чого можна розпочинати коригування концентрації калію плазми крові.
Слайд 28Дефіцит калію визначається за формулою:
ДК=(5,0 – К плазми хворого (ммоль/л)
х 0,2 масси тіла хворого (кг)
! Корекцію гіпокаліемії слід
проводити вкрай обережно та повільно!
Швидка інфузія препаратів К або введення останнього у великій кількості може призвести до ускладнень з боку ССС до зупинки серцевої діяльності.
Загальна добова кількість введеного К не повинна перевищувати 3 ммоль/кг/доба!
Швидкість інфузії препаратів К повинна бути не більше 20 ммоль/год!
ГІПОКАЛІЕМІЯ
Слайд 29Для корекції гіпокаліемії оптимальним є використання розчинів, що містять калій,
розведених до 40 ммоль К на 1 літр розчину.
Лікування препаратами
калію слід проводити під щоденним лабораторним контролем біохімічних показників крові.
Оптимальним розчином для корекції гіпокаліемії вважають поляризуючу суміш, що складається з глюкози, калію та інсуліну.
ГІПОКАЛІЕМІЯ
Слайд 30У хворого вагою 70 кг. на тлі хвороби визначають помірну
гіпокаліемію, калій плазми крові становить 2,7 ммоль/л.
Враховуючи викладені вище принципи
корекції гіпокаліемії (добова доза інфузії калію не повинна перевищувати 3 ммоль/кг/добу), розраховуємо максимальну добову дозу К для даного хворого:
3 ммоль/л х 70 кг за добу = 210 ммоль/70 кг/доба,
Час введення даної кільості К повинен становити не менше 10,5 годин.
210 ммоль : 20 ммоль/год = 10,5 годин.
КЛІНІЧНИЙ ПРИКЛАД
Слайд 31Гіперкаліемія – збільшення калію плазми крові більше 5,2 ммоль/л.
Найбільш частими
причинами розвитку гіперкаліемії є процеси, що призводять до порушення виділення
калію з організму, це може бути: ГНН, або масивний вихід даного електроліту з ушкоджених клітин: гемоліз еритроцитів, травматичні пошкодження, опіки, синдром позиційного та тривалого стискання, тощо.
Синдром гіперкаліемії можливий також при гіпертермії, судомах, застосуванні гепарину, амінокапронової кислоти та ін.
ГІПЕРКАЛІЕМІЯ
Слайд 32Діагностика гіперкаліемії має грунтуватись на наявності етіологічних чинників (ГНН, травма).
За
умови гіперкаліемії реєструють певні зміни з боку ССС, як то:
-
синусова брадікардія (що може призводити до зупинки серцевої діяльності);
- шлуночкова екстрасистолія;
- значне уповільнення внутрішньошлуночкової та атріовентрикулярної провідності.
Для гіперкаліемії характерні типові зміни ЕКГ, які проявляються у вигляді:
- високого та гострокінцевого зубця Т;
- розширення комплексу QRS;
- зменшення амплітуди зубця Р.
ГІПЕРКАЛІЕМІЯ
Слайд 33Терапію гіперкаліемії слід розпочинати з усунення етіологічного чинника та корекції
ацидозу.
Для корекції рівня калію можливе застосування препаратів кальцію.
Гарного результату,
який досягається шляхом переводу надлишку калію плазми крові в клітину можна досягти, застосовуючи 10-20 % розчини глюкози з інсуліном, з розрахунку 1 ОД інсуліну на 3-4 гр. глюкози.
ТЕРАПІЯ ГІПЕРКАЛІЕМІЇ
Слайд 34У випадку, якщо запропоновані вище заходи є неефективними, а гіперкаліемія
зростає, необхідно застосовувати гемодіаліз.
Слайд 36Кальцій складає близько 2 % маси тіла, з яких 99%
знаходяться в зв’язаному стані в кістках та в нормальних умовах
не беруть участі в електролітному обміні.
Близько 1% кальцію в організмі людини знаходиться в розчиненому стані, з цього відсотку приблизно половина (50-60 %) знаходиться в іонізованому стані.
Іонізований кальцій бере участь в нервово-м’язовій передачі імпульсів, процесах згортання крові, роботі міокарду, утворенні електричного потенціалу клітинних мембран, а також продукції ряду ферментів.
КАЛЬЦІЙ
Слайд 37ОБМІН КАЛЬЦІЮ
Добова потреба в кальції становить 700-800 мг (у вагітних
жінок – до 1500 мг).
Потрапляє кальцій в організм з їжею,
виводиться переважно через ШКТ та з сечею.
Обмін кальцію тісно пов’язаний з обміном фосфору, рівнем білка плазми крові та рН крові.
1 мекв кальція = 0,5 ммоль
1 ммоль = 40 мг,
1 гр. = 25 ммоль.
Слайд 38Кальцій плазми крові менш ніж 2,1 ммоль/л.
Гіпокальціемія розвивається при гіпоальбумінемії,
панкреатиті, переливанні великої кількості цитратної крові, тривало існуючих жовчних норицях,
дефіциті вітаміну D, порушенні всмоктування в тонкому кишківнику, після тривалих та/або травматичних оперативних втручань, тощо.
Клінічно гіпокальциемія проявляється підвищенням нервово-м’язової збудливості, появою парестезій, проявами пароксизмальної тахікардії, тетанією.
За умови гіпокальціемії на ЕКГ спостерігатиметься подовження інтервалу Q-T та вкорочення інтервалу P-Q. Також буде зниженою амплітуда зубця Т.
ГІПОКАЛЬЦІЕМІЯ
Слайд 39ГІПОКАЛЬЦІЕМІЯ
Корекцію гіпокальціемії проводять після лабораторного визначення рівня кальцію плазми крові,
шляхом внутрішньовенного введення препаратів, які містять іонізований кальцій, це такі
препарати, як:
Глюконат кальцію;
Лактат кальцію;
Хлорид кальцію;
Карбонат кальцію.
Однак, слід зауважити, що всі ці препарати матимуть слабо виражений ефект, або взагалі будуть неефективними, якщо у хворого триватиме гіпоальбумінемія.
Слайд 40Гіперкальциемія має місце за умови, якщо рівень кальцію плазми крові
перевищує 2,6 ммоль/л.
Гіперкальциемія розвивається при будь-яких процесах, що супроводжуються посиленим
руйнуванням кісткової тканини (пухлини кісток, остеомієліт), захворюваннях паращитоподібної залози (аденома, паратиреоїдит), надлишковому введенні кальцій-вмісних препаратів.
Клінічно гіперкальциемія проявляється підвищеною стомлюваністю, м’язовою слабкістю, загальмованістю. За умови наростання гіперкальціемії з’являються симптоми атонії шлунково-кишкового тракту (нудота, блювання, закрепи, метеоризм).
ГІПЕРКАЛЬЦИЕМІЯ
Слайд 41ГІПЕРКАЛЬЦИЕМІЯ
На ЕКГ реєструється скорочення інтервалу Q-T, порушення серцевого ритму та
провідності, синусова брадикардія, уповільнюється атріо-вентрикулярна провідність.
Зміни зубця Т можуть проявлятись
таким чином, що він може стати:
- негативним;
- двофазним;
- зниженим;
- заокругленим.
Слайд 42Лікування гіперкальціемії перш за все, полягає в усуненні патогенетичного фактору.
При вираженій гіперкальціемії (більш 3,7 ммоль/л) слід проводити цілеспрямовану корекцію,
яка полягає у введенні 2 гр динатрієвої солі етилендиамінтетраоцтової кислоти (ЕДТО), яка попередньо розводиться на 500,0 мл ізотонічного розчину глюкози (5% р-н).
Зазначений препарат слід вводити внутрішньовенно, повільно, крапельно, під контролем рівня кальцію плазми крові. Кратність введення – 2-4 рази на добу.
КОРЕКЦІЯ ГІПЕРКАЛЬЦІЕМІЇ
Слайд 43Основний аніон позаклітинного простору. Рівень даного іону регулюється альдостероном.
В організмі
хлор перебуває в еквівалентних співвідношеннях з натрієм.
Хлориди чинять осмотичний ефект
на воду, тобто відбувається переміщення води в напрямку аніонів хлору.
В організм хлор потрапляє у вигляді NaCl, який в шлунку дисоціює на катіони натрію та аніони хлору.
Хлор в сполученні з воднем утворює соляну кислоту, а натрій – бікарбонат натрію.
1 мекв хлора = 1 ммоль = 35,5 мг.
1 гр. хлора = 28,2 ммоль
ХЛОР
Слайд 44Гіпохлоремія – зменшення концентрації хлору в плазмі менше 95 ммоль/л.
Гіпохлоремічний
синдром розвивається при тривалому блюванні, перитоніті, стенозі воротаря, високій кишковій
непрохідності, підсиленому потовиділенні.
Розвиток даного синдрому супроводжується зростанням гідрокарбонатного буфера та проявами алкалозу.
ГІПОХЛОРЕМІЯ
Слайд 45ГІПОХЛОРЕМІЯ
Клінічно, даний синдром проявляється у вигляді дегідратації, порушеннями дихання та
серцевої діяльності.
Можливий розвиток порушень свідомості та коми.
Лікування полягає в цілеспрямованому
впливі на патогенетичний фактор та проведенні інфузійної терапії хлоридами (найчастіше це NaCl) під контролем лабораторних показників.
Слайд 46Гіперхлоремія – збільшення концентрації хлору в плазмі понад 110 ммоль/л.
Гіперхлоремія
розвивається за умови загальної дегідратації, при порушенні виведення рідини з
інтерстиційного простору(ГНН), зростанні переходу рідини з судинного русла в інтерстиційний сектор (гіпопротеінемія), інфузії великої кількості рідини, що містить високу концентрацію іонів хлору.
ГІПЕРХЛОРЕМІЯ
Слайд 47ГІПЕРХЛОРЕМІЯ
Розвиток гіперхлоремічного синдрому супроводжується зменшенням буферної ємкості крові та проявами
метаболічного ацидозу.
Клінічні прояви гіперхлоремії проявляються у вигляді набрякового синдрому (інтерстиційний
набряк легенів).
Основним напрямком терапії є дія на патогенетичний фактор в сукупності з синдромною терапією.
Слайд 49БІКАРБОНАТНІ АНІОНИ
Бікарбонатні аніони входять до складу вкрай важливого бікарбонатного буферу
позаклітинного простору. Концентрація даного буферу в організмі людини регулюється нирками
та залежить від концентрації хлору та інших іонів.
В артеріальній крові рівень бікарбонатного буферу складає 18-23 ммоль/л, в плазмі артеріальної крові – 21-28 ммоль/л, в венозній крові – 22-29 ммоль/л.
Слайд 50Зменшення концентрації бікарбонатного аніону супроводжується розвитком метаболічного ацидозу, а зростання
призводить до виникнення метаболічного алкалозу.
1 мекв гідрокарбонату = 1 ммоль
= 80 мг.
1 гр. гідрокарбонату = 12,5 ммоль.
БІКАРБОНАТНІ АНІОНИ
Слайд 52Багато сполук, які відіграють ключове значення в метаболізмі клітини –
це фосфати (АТФ, цАМФ, креатинфосфосфат, ДНК, фосфоліпіди, тощо).
Внутрішньоклітинний вміст фосфатів
та реакції, в яких ці сполуки беруть участь, практично не залежать від коливань концентрації фосфату в позаклітинному середовищі, в результаті чого концентрація фосфатів в позаклітинному середовищі, регулюється не так суворо, як концентрація іонів кальцію.
Більша частина фосфатів в тілі людини знаходиться в кістках, частково у вигляді аморфного фосфату кальцію, але головним чином – у формі кристалів гідроксиапатиту.
ФОСФАТИ
Слайд 53Фосфати є основним аніоном внутрішньоклітинного сектору.
В плазмі крові вони перебуває
у вигляді моногідрофосфатного та гідрофосфатного аніонів та складають в нормі
від 0,65 до 1,3 ммоль/л.
Головною функцією фосфатів є участь в енергетичному обміні, крім того фосфати беруть активну участь в обміні білків та вуглеводів.
ФОСФАТИ
Слайд 54Кістки – є найбільш важливим резервуаром іонів кальцію, з якого
при зниженні його позаклітинної концентрації в будь-який час може вивільнюватись
фосфат кальцію.
Швидкий та ефективний механізм цього процесу зумовлений дією паратгормону (ПГ), який синтезується паращитоподібними залозами. Вивільнення ПГ індукується гіпокальциемією. В кістках гормон стимулює секрецію остеокластами органічних кислот (лимонної, молочної та бурштинової), які розчиняють лужний апатит з утворенням вільних іонів кальцію та фосфату.
РЕГУЛЯЦІЯ БАЛАНСУ ФОСФАТУ КАЛЬЦІЮ
Слайд 55Цей ефект оптимізується одночасною та двобічною дією паратгормону на нирки:
ПГ призводить до зростання реабсорбції іонів кальцію в дистальному канальці,
попереджуючи при цьому втрату кальцію з сечею та знижує поріг для фосфату в проксимальному канальці, посилюючи його екскрецію.
ПГ чинить на виведення кальцію та фосфатів протилежну дію.
Розчинність фосфату кальцію досить низька, отже, якщо концентрація іонів кальцію та фосфат іонів зростає, виникає небезпека утворення фосфату кальцію поза кістками.
Слайд 56Виведення фосфатів з сечею, запобігає цій небезпеці та є необхідним
для сталого підвищення позаклітинної концентрації іонів кальцію.
Крім того, мобілізація потужного
лужного фосфату кальцію загрожує порушенням кислотно-лужної рівноваги.
Розвиток метаболічного алкалозу попереджається іншою дією ПГ, а саме, інгібуванням карбоангідрази в проксимальному канальці , яке призводить до посилення виведення бікарбонату.
Слайд 57При тривалій дії ПГ висока його ефективність та швидкість регуляції
позаклітинної концентрації кальцію потенційно могла б призвести до мінералізації кісток.
Цьому протидіє інший механізм, також пов’язаний з дією ПГ. Протягом короткого проміжку часу, доки ПГ зберігає активність, він ініціює довготривалу стабілізацію фосфату кальцію за рахунок активації (вітамінD) гормону попередники якого потрапляють до організму з їжею або синтезуються в шкірі та печінці.
Слайд 58Його дія проявляється в деякій мірі в самій нирці, де
він посилює реабсорбцію кальцію та фосфату.
Основна роль – індукція деяких
ефекторних білків в кишківнику, які забезпечують сталу реабсорбцію фосфату кальцію, який отриманий з їжею.
Завдяки цьому ж гормону, фосфат кальція включається до кісткової тканини.
Слайд 59Третій гормон, що відіграє особливу роль в регуляції балансу фосфату
кальцію – кальцитонін. Він вивільнюється щитоподібною залозою при гіперкальціемії та
сприяє зменшенню концентрацій кальцію та фосфату в плазмі крові за рахунок стимуляції мінералізації кісток та одночасного пригнічення реабсорбції зазначених іонів в нирках та кишківнику.
Слайд 60ФОСФАТИ
Недостатність фосфатів виникає при ГНН, тривалому голоданні, сепсисі, хронічних захворюваннях
ШКТ, ацидозі та тривалій терапії стероїдними гормонами.
Клінічні прояви гіпофосфатемії проявляються
швидкою втомою, слабкістю, гіпо- та адинамією, гіпорефлексією.
Лікування гіпофосфатемії є патогенетичним.
Слайд 62Магній є внутрішньоклітинним катіоном. Концентрація магнію в плазмі крові становить
1,5 ммоль/л, в той час, як у внутрішньоклітинній рідині -
17,5 ммоль/л.
Магній чинить гальмуючий вплив на збудливість нервово-м’язової системи та скоротливість міокарду, викликає депресію ЦНС.
Важливу роль магній відіграє у ферментативних процесах, перш за все таких, як засвоєння кисню та продукція енергії.
Потрапляє магній в організм з їжею, виводиться через ШКТ та з сечею.
1 мекв магнію = 0,5 ммоль
1 ммоль = 24,4 гр.
1 гр. = 41 ммоль
МАГНІЙ
Слайд 63Історія магнію
Природні магнійвмісні матеріали магнезит і доломіт здавна використовувались у
будівництві.
Під час засухи в Англії літом 1618 р. Генрі Уікер
виявив на пасовищі в Епсомі невелику ямку, заповнену водою, яку тварини відмовлялися пити. Пізніше виявилось, що при зовнішньому і внутрішньому застосуванні ця вода виявляє лікувальні властивості. З середини XVII віку Епсом набуває слави як курорт з джерелом мінеральної води.
Слайд 64Згодом натуральної солі з цього джерела стало не вистачати, що
привело до посилених пошуків її штучного замінника. Каспар Неуманн (1683–1757)
заявив, що приготував штучну епсомську сіль шляхом додавання H2SO4 до водного розчину морської солі, що виготовлялася в Іспанії та Португалії. Він відрізнив епсомську сіль (MgSO4) від “мірабілітової солі Глаубера” (Na2SO4) і вказав, що “земля гіркої послаблювальної солі називається magnesia alba (біла магнезія)”, за назвою місцевості в гірському районі Греції, де вперше було виявлено дану сполуку. Магнезію довго не могли відрізнити від вапна; лиш в XVIII ст. німецький лікар-терапевт Фрідріх Гоффман (1660–1742) встановив, що ці сполуки різні.
Слайд 65Виділити металеву основу магнезії спробував на початку XIX ст. відомий
англійський фізик і хімік Гемфрі Деві (1778–1829). Він змішав вологу
магнезію з оксидом ртуті і помістив на пластинку з платини, пропустивши через неї струм; видалив ртуть і отримав новий метал. Таким же чином він отримав барій, калій і стронцій.
Деві назвав новий метал magnium, так як вважав, що слово magnesium легко сплутати з manganese, тобто з марганцем. Але назва magnesium війшла в користування в багатьх мовах, тому новий метал лише короткий час був відомий під назвою, яку йому дав Деві. Щоправда, українська назва цього металу дуже близька до первинної.
Слайд 66 Хімічні властивості
Магній – один з найбільш поширених на
Землі елементів. В земній корі міститься 1,87 – 2,1% .
Зустрічається тільки у вигляді сполук.
Порядковий номер в періодичній системі – 12 (ІІа група і 3 період).
Молекулярна маса – 24 ммоль/л.
Валентність – 2.
Електронна конфігурація: 1s²2s²2p⁶3s².
Іон володіє значною поляризуючою дією і здатен до утворення як іонних, так і ковалентно-полярних зв’язків, а за рахунок своєї вільної 3d-орбіталі ще й донорно-акцепторних. Тому магній, використовуючи чотирьохпелюсткові 3d-орбіталі, входить в чотирьохпірольне кільце порфірину і утворює систему хлорофілу.
Слайд 67
Входить до групи лужно-земельних металів, але за властивостями не належить
до них (гідроксид магнію випадає восад).
З милом утворює важкорозчинні солі.
Вода з гідрокарбонатами магнію і кальцію називається жорсткою і ній мило не милиться. Шляхи уникнення жорсткості:
метод іонообмінних смол (постійний)
метод хімічної очистки (тимчасовий)
Отримують магній шляхом електролізу. Металічний магній використовують для виготовлення різних легких сплавів, в фотографії, виробництві освітлювальних ракет і снарядів, в органічному синтезі, в будівнициві (вогнестійкі цементи і цегла)
Слайд 68СПОЛУКИ МАГНІЮ В МЕДИЦИНІ
Магнію-алюмінію силікат – колоїд, який використовують у
фармацевтичній практиці при виготовленні суспензій.
Магнію карбонат – застосовують як протикислотний
(антацидний) засіб.
Магнію хлорид – один з поповнювачів електролітів при їх нестачі в організмі і необхідний фармацевтичний компонент рідин, які використовують для гемодіалізу і очеревинного діалізу.
Магнію цитрат – сольовий проносний засіб.
Двоосновний магнію фосфат – сіль, що застосовується як сольовий проносний засіб.
Магнію гідроксид – білий порошок, що застосовується як протикислотний та як м’яко діючий проносний засіб.
Магнію лактат – сіль магнію, яку застосовують у складі рідин, призначених для поповненя електролітів при їх нестачі в організмі.
Магнію оксид – білий порошок, застосовується у фармацевтичних препаратах як сорбент, а також як протикислотний і м’яко діючий проносний засіб.
Слайд 69
Магнію пероксид – білий порошок, нерозчинний у
воді; ступенево розпадається, звільняючи кисень. Використовується як протикислотний засіб.
Магнію фосфат – білий порошок, що застосовується як протикислотний засіб.
Магнію силікат – магнієва сіль саліцилової кислоти, що застосовується як протиартритичний засіб.
Магнію силікат- силікатна сіль магнію (азбест і тальк). Викликає силікатоз.
Магнію стеарат – застосовується як речовина з мастильними властивостями при виготовленні фармацевтичних препаратів у формі таблеток.
Магнію сульфат – протисудомний засіб і один з поповнювачів магнію при його недостатності. Входить до складу електролітних розчинів. Застосовується внутрішньом’язово і внутрішньовенно. Також його вживають як проносний і протизапальний засіб для місцевого застосування.
Магнію сульфат – висушений гідратований магнію сульфат; проносний засіб.
Магнію трисилікат – вокористовується як протикислотна речовина.
Всі їх поділяють в залежності від розчинності у воді на дві групи:
Добре розчинні (магнію сульфат, магнію тіосульфат, магнію аскорбінат)
Практично нерозчинні (магнію карбонат, магнію оксид, магнію пероксид, магнію трисилікат)

Слайд 70Основні групи методів визначення магнію:
І. Хімічні методи
1.титриметричний
2.колориметричний
3.вогнева фотометрія
4.атомно-абсорбційна спектрофотометрія
ІІ. Спектрографічні методи
ІІІ. Флюориметричні
Слайд 71Обмін магнію в нормі
Добова потреба: 300-500 мг (засвоюється 30-40%)
Збалансованість у
харчових продуктах: P:Са:Mg=1:1:0,3
Оптимальна збалансованість у молоці, молочних продуктах та рослинах.
Найбагатші на магній овочі і фрукти: морква, петрушка, зелень, шпинат, квасоля, чорниці, вишні, сливи, а найбільше у кавунах, тому ці продукти посилюють перистальтику і жовчовиділення.
Основне джерело магнію – вода.
Магній - другий за значенням внутрішньоклітинний катіон.
Тільки 1-2% загальних запасів його знаходиться ву позаклітинній рідині, 67% - в кістках, і 31% - в клітинах.
Слайд 72Всмоктування магнію відбувається шляхом пасивної дифузії переважно у дистальній частині
тонкої кишки, а частково він переноситься транспортним білком у проксимальній
частині тонкої кишки. Транспортний білок ще остаточно не ідентифікований. Механізми регуляції обміну магнію теж повністю не з’ясовані.
Екскреція магнію в основному здійснюється нирками і в середньому складає 6-12 мекв/добу. Реабсорбція в нирках відбувається надзвичайно єфективно: 25% фільтрованого в клубочках магнію піддається реабсорбції в проксимальних ниркових канальцях, а ще 50-60% - в товстому сегменті висхідної частини петлі Генле.
Фактори, що стимулюють реабсорбцію магнію:
1.гіпомагніємія
2.ПТГ
3.гіпокальціємія
4.зниження об’єму позаклітинної рідини
5.метаболічний алкалоз
Слайд 73Фактори, що стимулюють екскрецію магнію нирками:
1.гіпермагніємія
2.гостра гіповолемія
3.гіперальдостеронізм
4.гіперкальціємія
5.кетоацидоз
6.прийом діуретиків
7.зниження вмісту фосфатів
8.прийом
алкоголю
Концентрація магнію в плазмі підтримується в межах 1.5-2.1 мєкв/л (0.7-1.0
ммоль/л або 1.7-2.4 мг/100мл). Приблизно 50-60% магнію знаходиться в незв’язаному стані і здатні переміщуватися з одного рідинного компартменту в інший. Решта зв’язана з білками, в основному з альбуміном. Тому гіпоальбумінемія може привести до дефіциту магнію. В нормі з сечею виходить 9 ммоль магнію за добу.
Слайд 74Фізіологічне значення магнію
Магній - неохідний компонент каталітичних реакцій майже 300
ферментних систем і багатьох обмінних процесів, сприяє утворенню і гідролізу
АТФ, креатинфосфату.
Грає важливу роль в процесах гліколізу, включається в різні ланки цитратного циклу, окислювального фосфорилювання, бере участь в активації фосфатаз, нуклеаз, пептидаз.
Холінестераза активується виключно магнієм, синтез холестерину і його естерифікація (утворення розчинних форм) здійснюється за наявності магнію.
В результаті такої сумарної дії на велику кількість ензимних процесів магній гальмує передачу в нервово-м’язових синапсах, подібно кураре, викликає депресію ЦНС. Тому солі магнію потенціюють наркоз. При його концентрації в крові 8 мекв/л виникає поверхневий наркоз, при концентрації 16 мекв/л – глибокий наркоз, а при концентрації 20 мекв/л і вище – параліч дихання і смерть.
Слайд 75За своїм впливом на нервово-м’язову збудливість іони поділяються на дві
групи. Іони Na, K, OH підвищують її, іони Ca,Mg i
H знижують, тому останні називають іонами гальмування. Якщо перші впливають на нервово-м’язову збудливість тільки поперечно-посмугованих м’язів, то останні ще і гладких м’язів. Тому магній застосовують при лікуванні гіпертонічної хвороби. Він послаблює контрактильні властивості гладких м’язів і серцевого м’яза, пригнічує збудливість синусового вузла і проведення імпульсу в передсердях, а у великих дозах може зупинити серце в діастолі.
При внутрішньовенному введенні великих доз солей магнію дихання пригнічується раніше втрати свідомості. Тому при цьому завжди необхідно мати засоби для проведення ШВЛ.
Прийом великої кількості магнію, особливо магнію сульфату, веде до підвищення осмолярності кишкового вмісту і переміщення води з інтерстицію в просвіт кишок, в результаті чого реалізується послаблювальний ефект.
Слайд 76Дефіцит внутрішньоклітинного магнію може привести до підвищення вмісту в клітинах
натрію і кальцію, а також втрати калію. Передбачається, що у
населення, що проживає в регіонах з низьким вмістом магнію у воді, частіше виникають захворювання серця. У жителів екваторіальних областей розвивається гіпомагніємічний ендоміокардіальний фіброз. Дефіцит магнію грає важливу роль в патогенезі ішемічної хвороби серця. Нітрати нормалізують рівень магнію в сироватці крові. Є докази, що таким же ефектом володіють β-блокатори. В експериментах доведено, що прийом магнію знижує частоту розвитку атеросклерозу.
При цукровому діабеті спостерігаються посилені втрати магнію з сечею, тому прийом препаратів магнію допомагає лікувати обидва типи даного захворювання. Багато ферментів, які беруть участь в гліколізі, залежні від магнію. У експериментах виявлено підвищену стимуляцію синтезу глюкагону, знижену секрецію інсуліну і знижене його захоплення при дефіциті магнію. Інсулін веде до переміщення магнію в клітину.
Слайд 77Магній нормалізує ліпідний обмін, знижує в плазмі рівень холестерину і
ЛПНЩ і підвищує концентрацію ЛПВЩ, зменшує поступлення кальцію в клітини.
Дефіцит магнію в організмі веде до перевантаження гладком’язових клітин судин натрієм і кальцієм, внаслідок чого підвищується периферичний судинний опір і виникає судинний спазм. Але прямого зв’язку з магнезіальним статусом і артеріальною гіпертензією поки не встановлено. Є достовірні дані, що дефіцит магнію може викликати спазм коронарних артерій. Його можна розглядати в якості природнього блокатора кальцієвих каналів біологічних мембран. Хворих зі стенокардією Принцметала вдавалося успішно лікувати введенням препаратів магнію.
Галогенати магнію пригнічують агрегацію тромбоцитів, залежну від АДФ.
Інфузія препаратів магнію хворим з підозрою на наявність інфаркту міокарда може знизити потребу міокарда в кисні і обмежити розміри інфаркту. Також дефіцит магнію небезпечний в післяінфарктному періоді (аритмії)
Слайд 78Виявлений позитивний ефект препаратів магнію при лікуванні порушень ритму серця
(шлуночкова екстрасистолія, аритмія типу ”пірует”, надшлуночкові тахіаритмії) В цих ситуаціях
магній сульфат вводять зазвичай у дозі 2 г протягом хвилини. Також він показаний при лікуванні дигіталісом та при гіперкаліємії.
Магній виявляє певний антагонізм до кальцію. Їхнє співвідношення впливає на внутрішньоклітинний метаболізм.
Підвищене надходження кальцію в ішемізовані нейрони здійснюється задяки надлишку в мозковій тканині глютамату, який активує специфічні N-метил-D-аспартатні рецептори. Було виявлено, що магній пригнічує продукцію глютамату і, таким чином, здійснює протекторну дію при ішемії і гіпоксії мозку.
Слайд 79Порушення обміну магнію
Гіпермагніємія (концентрація Mg в плазмі вища 3 мекв/л,
1.5 ммоль/л)
Причини:
1.надмірне вживання магнію (антациди, послаблювальні)
2.ниркова недостаність
(ШКФ нижче 30 мл/хв)
3.ятрогенна (лікування гіпертензії вагітних)
4.наднирникова недостатність
5.гіпотиреоз
6.рабдоміоліз
7.прийом препаратів літію
Слайд 80
Клінічні прояви
Клінічно гіпермагніємія проявляється враженням нервової і серцево-судинної системи, а
також нервово-м’язової функції. Характерні симптоми:
*гіпорефлексія
*пригнічення свідомості
*слабкість скелетних м’язів
Порушується вивільнення ацетилхоліну
і знижується чутливість рухової кінцевої пластинки м’язового волокна до ацетилхоліну.
При вираженій гіпермагніємії (>100 ммоль/л) виникає вазодилатація, брадикардія і депресія міокарда, що супроводжується виникненням артеріальної гіпотонії. ЕКГ-ознаки непостійні, але часто включають подовження інтервалу PQ і розширення комплексу QRS. При вираженій гіпермагніємії може відбутися зупинка дихання!
Слайд 81Лікування гіпермагніємії:
*Необхідно припинити надходження магнію до організму
*Кальцій (1г глюконату кальцію
в/в ) тимчасово гальмує більшість ефектів гіпермагніємії
*Петльові діуретики у поєднанні
з інфузією 0.45% розчину NaCl в 5% розчині глюкози стимулюють ниркову екскрецію магнію. Не рекомендується проводити інфузію 0.9% розчину NaCl через ризик розвитку ятрогенної гіпокальціємії, яка в свою чергу потенціює ефекти гіпермагніємії
*При вираженій дисфункції нирок інколи проводять гемодіаліз
Анестезія
При гіпермагніємії необхідний постійний моніторинг ЕКГ, АТ і нервово-м’язевої провідності. Гіпермагніємія потенціює вазодилатуючу і негативну інотропну дію анестетиків. Дозу міорелаксантів рекомендується знижувати на 25-50%. Якщо необхідний форсований діурез, то показана катетеризація сечового міхура. Вимірюється концентрація кальцію і магнію в динаміці.
Слайд 82Гіпомагніємія (концентрація Mg плазми не перевищує
1 мекв/л)
Причини:
1. недостатнє вживання (тривале
голодування, парентеральне харчування)
2. порушеня всмоктування з ШКТ (мальабсорбція, тонкокишкові чи жовчні нориці, тривала назогастральна аспірація, виражена діарея)
3. підвищенні втрати нирками (посилений діурез, діабетичний кетоацидоз, гіперпаратиреоз, гіперальдостеронізм, гіпофосфатемія, побічна дія лікарських препаратів: аміноглікозиди, амфотирецин В, етанол; постобструктивний діурез)
4. багатофакторні причини (алкоголізм, білкове голодування, тиреотоксикоз, панкреатит, опіки)
Слайд 83Клінічні прояви
У більшості випадків гіпомагніємія протікає безсимптомно, але може викликати
анорексію, м’язову слабкість, фасцикуляції, парестезії, сплутаність свідомості, атаксію і судоми.
Гіпомагніємія
часто поєднується з гіпокальціємією (порушення секреції ПТГ) і гіпокаліємією (при посиленій нирковій екскрекції калію).
Кардіологічні прояви гіпомагніємії полягають в електричній нестабільності серця і підвищенні токсичності дигоксину; обидва ефекти посилюються супутньою гіпокаліємією.
Нерідко подовжуються інтервали PQ i QT, що вказує на супутню гіпокальціємію
Слайд 84Лікування гіпокаліємії
При безсимптомній гипомагніємії препарати магнію призначають всередину (гептагідрат сульфату
магнію, оксид магнію) чи в/м (сульфат магнію). При виражених клінічних
проявах (судоми) в/в повільно протягом 15-60 хв вводять 1-2 г сульфату магнію ( 8-16 мекв, чи 4-8 ммоль).
Анестезія
Специфічний вплив гіпомагніємії на анестезію не описаний, але її часто супроводжують гіпокаліємія, гіпофосфатемія і гипокальціємія, наявність яких необхідно своєчасно розпізнати і усунути до операції.
Якщо операція планова, то ізольована гіпомагніємія теж повинна бути усунена до індукції анестезії внаслідок небезпеки виникнення аритмії. Необхідно пам’ятати, що магній володіє антиаритмічним ефектом, а також здійснює захисну дію при ішемії головного мозку.