Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
03-2 Коллигативные свойства.ppt
Содержание
- 1. 03-2 Коллигативные свойства.ppt
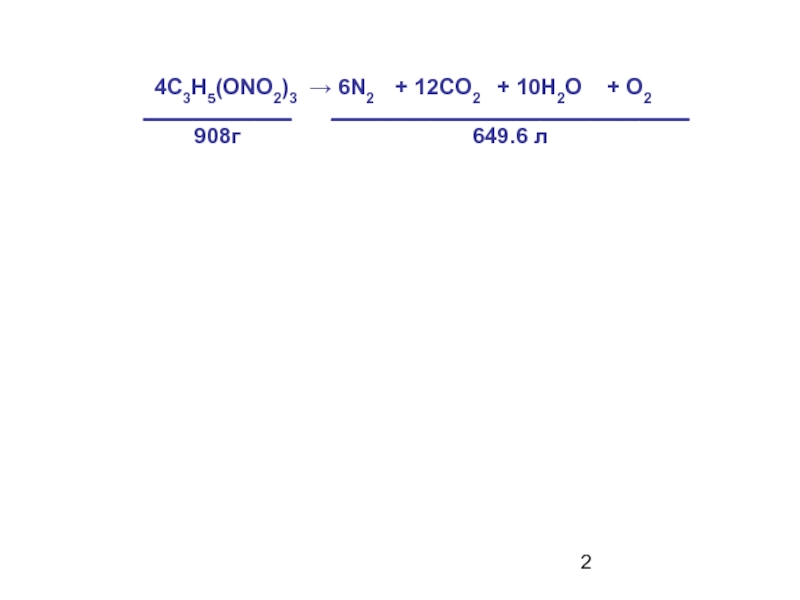
- 2. 4C3H5(ONO2)3 → 6N2 + 12CO2 + 10H2O + O2 _____________________________649.6 л____________908г
- 3. Шведский инженер-химик, изобретатель, промышленник. С 1843 по
- 4. Закон Менделеева-Клайперона
- 5. Общее давление газовой смеси Робщ равно сумме
- 6. Больной приходит в сознание после хирургической операциис
- 7. Анестезирующее давление некоторых газов для
- 8. Поскольку при 20° давление паров
- 9. Растворимость газов в жидкостяхРастворимость газов в жидкостях
- 10. 2) от характера жидкости
- 11. 3) от температуры -
- 12. Закон Генри(растворенное вещество более летуче, чем растворитель).
- 13. а) Растворимость газа в жидкости
- 14. 1. Отношение концентрации газа, растворенного в жидкости,
- 15. Реальные газы отклоняются от закона Генри, и тем сильнее, чем выше парциальное давление газа.
- 16. (в математическое выражение закона Генри вместо общего
- 17. Закон Сеченова (1859)(в растворителе присутствует электролит)
- 18. Одной из причин уменьшения
- 19. 1. Расчет прочности тары для газосодержащих напитков
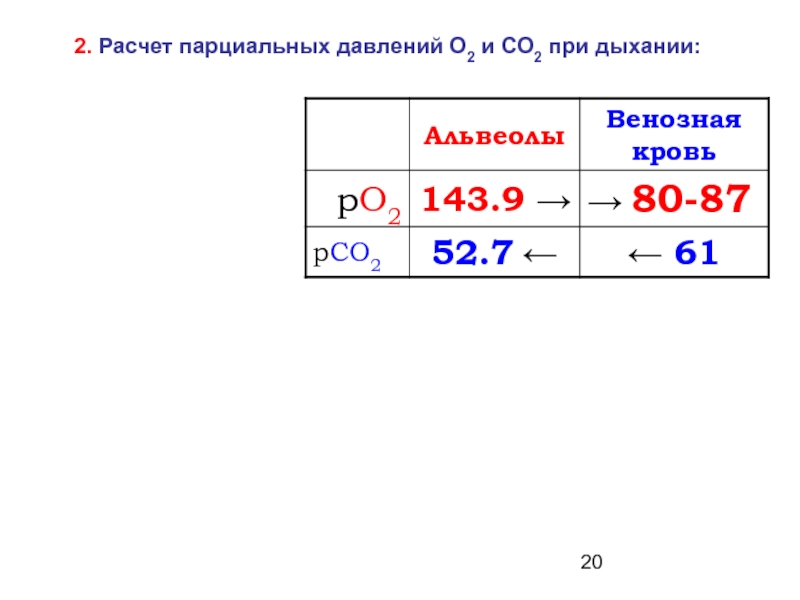
- 20. 2. Расчет парциальных давлений О2 и СО2 при дыхании:
- 21. В среде с повышенным
- 22. Во избежание кессонной болезни водолазам приходитсямедленно возвращаться
- 23. Кесонная болезнь может возникнуть
- 24. Барокамера используется не только для декомпрессии, но и для насыщения организма кислородом при различных заболеваниях.
- 25. 4. Расчет содержания газов в жидкостях
- 26. 6. Озонотерапия (О3)Одним из интересных примеров растворимости
- 27. Доказано, что озон в терапевтических концентрациях оказывает следующие действия: детоксицирующееантигипоксическоеиммуномодулирующеепротивовоспалительноебактерицидноевирусолитическоефунгицидноеанальгезирующееОзон эффективно справляется со многими вирусами !!!!
- 28. "Коллигативные свойства растворов."
- 29. Граф структуры
- 30. Коллигативные (коллективные) - зависят от
- 31. Закон Рауля: а) Парциальное давление насыщенного
- 32. Причины:а) уменьшение поверхности испарения:б) уменьшение концентрации растворителя:
- 33. Для идеальных растворов понижение
- 34. 2. Эбулиоскопия – повышение ТкипПрисутствие растворенного вещества повышает температуру кипения раствора
- 35. Кэ – эбулиоскопическая константа (град/моль·кг);m – моляльность
- 36. Значения Кэ
- 37. 3. Криоскопия – понижение Т замерзанияПрисутствие растворенного
- 38. Криоскопия - способ определения М вещества
- 39. Значения Ккр
- 40. Растворы различных веществ в воде замерзают при
- 41. Слайд 41
- 42. Определение температуры замерзания неорганические: хлориды аммония,
- 43. 4. Осмос. Осмотическое давление.Осмос - самопроизвольная диффузия
- 44. Осмотическое давление – минимальное гидравлическое давление, которое
- 45. Уравнение осмотического давления находит широкое применение,
- 46. Одномолярный раствор создает давление 22,4 атм!!!
- 47. За счет осмотического давления мог бы удерживаться
- 48. Ученые предполагают, что египтяне откалывали гранитные глыбы,
- 49. Осмотическое давлениеплазмы крови человека - 7.4-7.8 атм(
- 50. i показывает, во сколько
- 51. Осмометрыа) с животной мембранойб) с фарфоровой мембраной, пропитанной феррицианидом меди в) для прямого измерения осмотического давления
- 52. Онкотическое давление – осмотическое давление, создаваемое за
- 53. Осмолярная концентрация - суммарное
- 54. Физиологические растворы 0,9%-ный ( 0,15 М )
- 55. Изоосмия Изоосмия - постоянство осмотического давления
- 56. Изо-, гипер- и гипотонические растворы Изотонические
- 57. Осмотический стресс (конфликт) : пребывание в воде,
- 58. Осмотический шок: внезапное изменение концентрации растворенных солей
- 59. Изменения, происходящие с кровяными тельцами в растворах
- 60. Рабочие «горячих» цехов должны пить подсоленную воду,
- 61. Лизис, плазмолиз, гемолиз.
- 62. 0,9 % NaClизотонический раствор1.2 % NaClгипертонический раствор0,3
- 63. Немецкие ученые Эрвин Неер и Берт Сакманн
- 64. При целлюлите концентрация ионов
- 65. Движущей силой "внедрения" является
- 66. Типичные для целлюлита выпячивания жировой тканиПосле восстановления ионного равновесия выпячивания исчезают.
- 67. По мнению диетологов, ирония кроется в том,
- 68. Консервирование продуктов питания происходит
- 69. Тургор – осмотическое набухание клетки
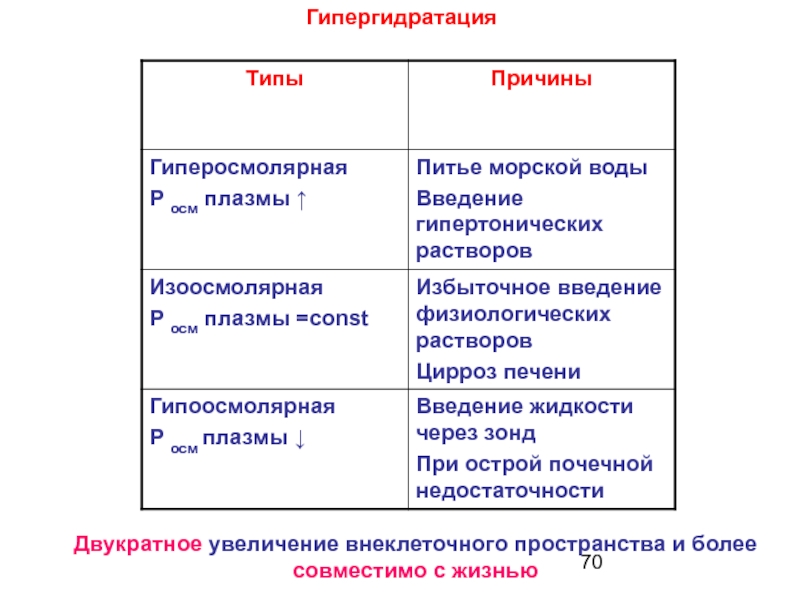
- 70. ГипергидратацияДвукратное увеличение внеклеточного пространства и более совместимо с жизнью
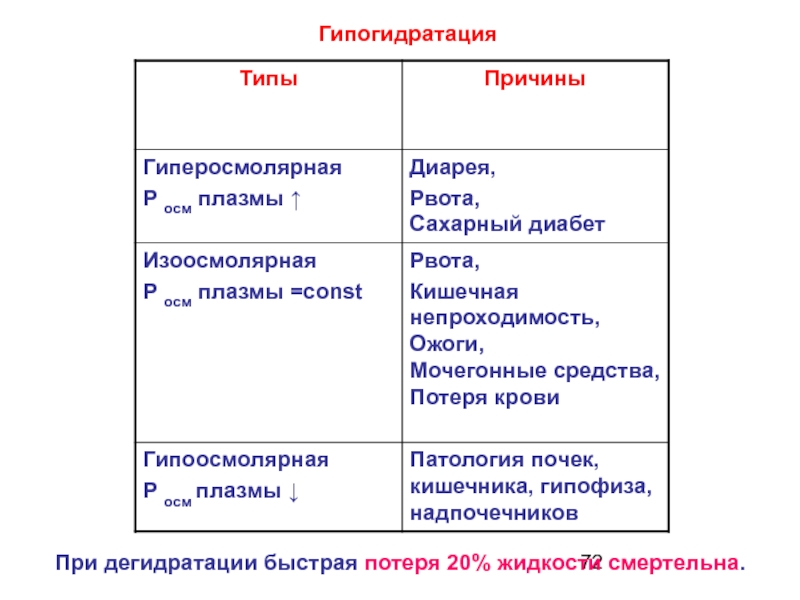
- 71. Гипогидратация – обезвоживание организма вследствие значительного снижения поступления воды в организм, либо чрезмерные её потери.
- 72. ГипогидратацияПри дегидратации быстрая потеря 20% жидкости смертельна.
- 73. Значение осмотического давления 1. Слабительное
- 74. Desalination system that uses reverse osmosis. When
- 75. 3. Перитонеальный диализ. При острых
- 76. 4. При очистке ран
- 77. 6. Осмос и диализ - основа
- 78. Спасибо за внимание!
- 79. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Шведский инженер-химик, изобретатель, промышленник.
С 1843 по 1850 вместе с
родителями жил в Петербурге. С 1850 года - в Германии,
Италии, Франции, США.В 1853 году вернулся в Россию и работал в принадлежавшей его отцу фирме «Нобель», которая представляла вооружение русской армии.
Проводил исследования в области электрохимии, оптики, биологии.
Завещал 33 млн. шведских крон на создание фонда международных премий за работы в области физики, химии, физиологии и медицины, литературы, а также за деятельность по укреплению мира - Нобелевские премии.
Разработал бездымный порох. Изобрел динамит
(нитроглицерин, адсорбированный кизельгуром – SiO2).
Слайд 5Общее давление газовой смеси Робщ равно сумме парциальных давлений всех
входящих в нее газов:
Закон Дальтона
(для газовых смесей)
Дальтон Джон
(6.09.1766 –
27.07.1844) Парциальное давление Pi/Робщ. - часть общего давления в газовой смеси. Оно равно тому давлению газа, которым он обладал бы, занимая один весь объем смеси.
Закон Дальтона не выполняется при высоких давлениях и низких температурах.
Слайд 6Больной приходит в сознание
после хирургической операции
с применением общей анестезии.
Галогенорганическое соединение галотан (2-бром-2-хлор-1,1,1-трифторэтан) находит широкое применение
в хирургической практике.
Нефтяные
газы, воздух используются при синтезе ряда веществ. Природный, доменный, генераторный газы являются хорошим топливом
Анестезирующее давление -
парциальное давление
анестезирующего газа,
необходимое для
достижения анестезии.
Смеси газов используются при анестезии
Слайд 7 Анестезирующее давление некоторых газов для мышей
Анестезирующие давления для
других млекопитающих и человека имеют значения, довольно близкие к указанным.
Слайд 8 Поскольку при 20° давление паров воды равно 17,5
мм рт. ст., в дождливый день при 20° парциальное давление
постоянных газов воздуха равно 760 – 17,5 = 742,5 мм рт. ст. Воздух представляет собой смесь
78% азота,
21% кислорода
1% аргона (по объему)
Слайд 9Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от:
1) от природы
Высокая растворимость аммиака, хлористого водорода,
сернистого газа и хлора объясняется их химическим взаимодействием с водой (например, NH3 или SO2) или диссоциацией на ионы (HCl).Растворимость различных газов в воде
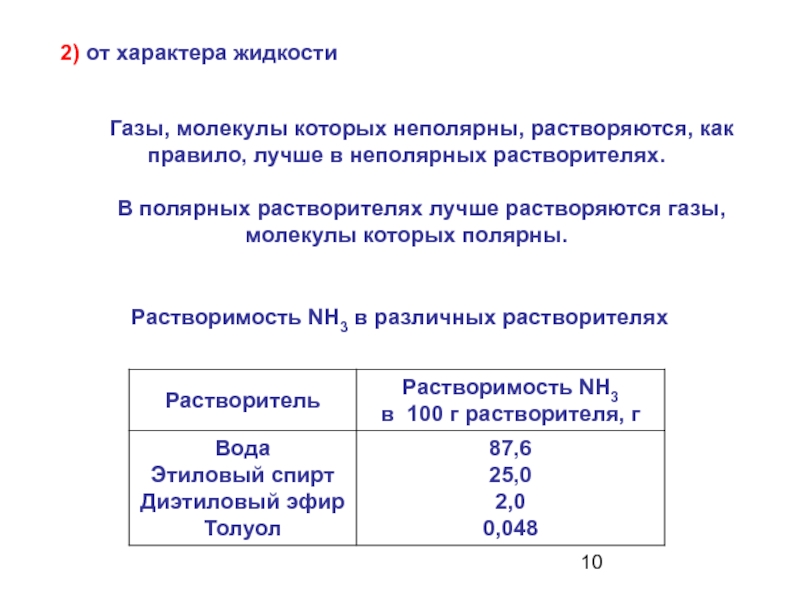
Слайд 10 2) от характера жидкости
Газы,
молекулы которых неполярны, растворяются, как правило, лучше в неполярных растворителях.
В полярных растворителях лучше растворяются газы,
молекулы которых полярны. Растворимость NH3 в различных растворителях
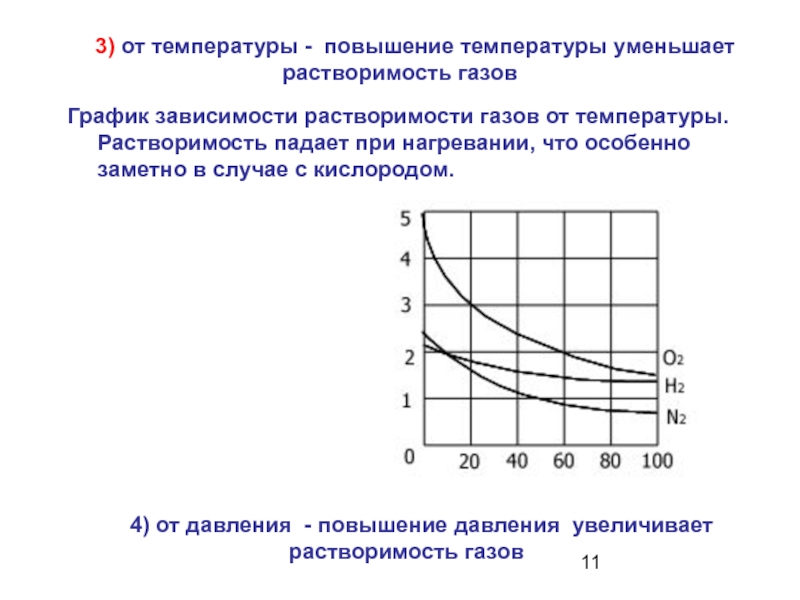
Слайд 11 3) от температуры - повышение температуры уменьшает
растворимость газов
4) от давления - повышение давления
увеличивает растворимость газовГрафик зависимости растворимости газов от температуры. Растворимость падает при нагревании, что особенно заметно в случае с кислородом.
Слайд 13 а) Растворимость газа в жидкости прямо пропорциональна его
давлению над жидкостью.
Сж - концентрация газа в жидкости,
Р
– его давление над раствором,К – коэффициент, зависящий от природы газа, растворителя и температуры.
б) Парциальное давление газа над раствором прямо пропорционально его мольной доле.
po – давление пара чистого растворенного вещества
Слайд 141. Отношение концентрации газа, растворенного в жидкости, к концентрации его
над раствором при постоянной температуре есть величина постоянная
2. Объем растворенного
газа не зависит от внешнего давления
(при увеличении давления в одинаковое число раз возрастает как концентрация растворенного газа, так и концентрация газа над раствором )Следствия из закона Генри
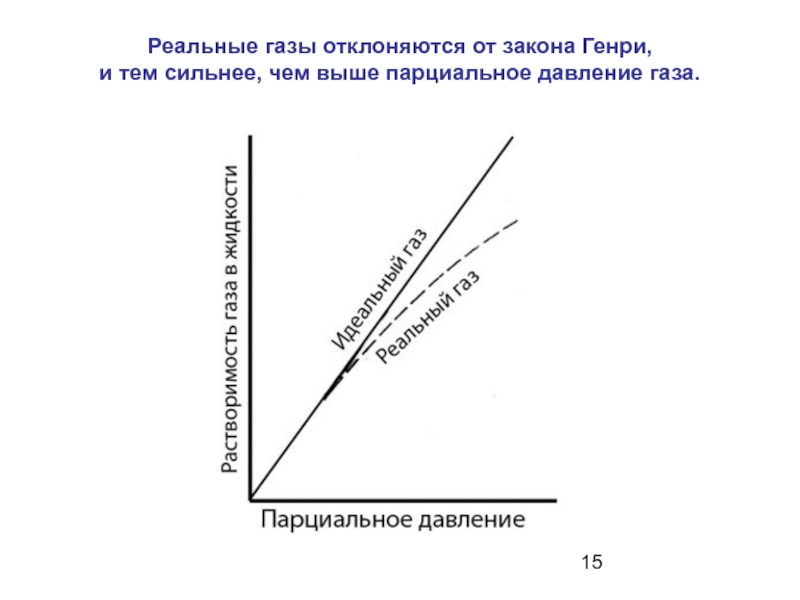
Слайд 15Реальные газы отклоняются от закона Генри, и тем сильнее, чем
выше парциальное давление газа.
Слайд 16(в математическое выражение закона Генри вместо общего подставляют парциальное давление
Pi, данного компонента)
Закон Дальтона
(для смеси газов)
Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью:
Слайд 17Закон Сеченова (1859)
(в растворителе присутствует электролит)
Растворимость газов в
жидкостях в присутствии электролитов понижается
So растворимость газа в
воде S - растворимостью газа в растворе электролита
С - концентрация растворенного вещества
е — основание натурального логарифма k — константа, значение которой зависит от природы газа, электролита и температуры
Слайд 18 Одной из причин уменьшения растворимости газов является
гидратация ионов электролитов, в результате чего уменьшается число свободных молекул
растворителя и понижается его растворяющая способность. В крови концентрация электролитов, белков, липидов может меняться в известных пределах и оказывает влияние на растворимость О2 и СО2 в крови.
Добавление кристаллов соли или сахара в шампанское приводит к интенсивному выделению СО2
Слайд 191. Расчет прочности тары для газосодержащих напитков
Проявлением
закона Генри–Дальтона и моделью эмболии является образование обильной пены при
откупоривании бутылки шампанского.Значение законов Дальтона, Генри и Сеченова
Слайд 21 В среде с повышенным давлением кровь и
ткани насыщаются N2 и CO2.
При переходе в
среду с более низким давлением (декомпрессии) избыточные газы не успевают диффундировать из крови через легкие наружу и образуют газовые пробки в кровеносных капиллярах, жировой клетчатке, в костях, суставах, костном мозге и тканях нервной системы.3. Предотвращение кессонной болезни
Слайд 22Во избежание кессонной болезни водолазам приходится
медленно возвращаться с глубины
Гелий не вызывает кессонной болезни, поскольку его растворимость
в крови гораздо меньше, чем у азота, поэтому водолазы пользуются при погружении вместо обычного воздуха смесью, содержащей 80% гелия и 20% кислорода.Кесонная болезнь сопровождается:
- головокружением
- кожным зудом
- суставными, мышечными и загрудинными болями
- нарушением нормальных функций сердечно-сосудистой системы и системы дыхания
- расстройством речи
- удушьем, помрачением сознания и параличом ( в наиболее тяжелых случаях )
Слайд 23 Кесонная болезнь может возникнуть также в результате
резкого уменьшения давления при разгерметизации скафандров летчиков-высотников, кабин самолетов и
спускаемых аппаратов.Слайд 24Барокамера используется не только для декомпрессии, но и для насыщения
организма кислородом при различных заболеваниях.
Слайд 25 4. Расчет содержания газов в жидкостях (из закона Генри)
Содержание кислорода и азота в воде при 0° и 1
атм:азот - 63,3%
кислород - 34,9%
Количество N2, растворенного в воде при 10 атм может достигать 6,4·10–3 моль/л. Этот факт важен для живущих в воде организмов
Если глубоководная рыба окажется внезапно на поверхности, избыток азота должен будет выделиться из ее организма.
Слайд 266. Озонотерапия (О3)
Одним из интересных примеров растворимости газов в жидкостях
может послужить раствор озона в дистиллированной воде, который широко используется
медицинских целях.Озононасыщенные растворы позволяют избежать ряд осложнений, связанных с применением газообразного озона, и уменьшить его вредное ингаляционное воздействие.
Слайд 27
Доказано, что озон в терапевтических концентрациях оказывает следующие действия:
детоксицирующее
антигипоксическое
иммуномодулирующее
противовоспалительное
бактерицидное
вирусолитическое
фунгицидное
анальгезирующее
Озон
эффективно справляется
со многими вирусами !!!!
Слайд 30 Коллигативные (коллективные) - зависят от количества имеющихся молекул
или ионов растворенного вещества, а не от природы растворенных частиц
Понижение давления пара растворителя.
Повышение температуры кипения растворителя.
Понижение температуры замерзания растворителя.
Явление осмотического давления.
Коллигативные свойства позволили Аррениусу показать, что молекулы растворенного вещества в растворе диссоциируют на ионы.
Коллигативные свойства используются главным образом для определения молекулярных масс неизвестных веществ.
Слайд 31Закон Рауля:
а) Парциальное давление насыщенного пара данного компонента
над раствором прямо пропорционально его мольной доле:
б) Относительное
понижение давления растворителя равно мольной доле растворенного вещества.1. Понижение давления пара растворителя:
(нелетучее вещество в летучем растворителе)
Слайд 33 Для идеальных растворов понижение давления насыщенного пара
растворителя не зависит от природы растворенного нелетучего вещества.
Для
реальных растворов, где имеют место межмолекулярные взаимодействия, в это уравнение необходимо ввести изотонический коэффициент:для электролитов
для неэлектролитов
для веществ, склонных к диссоциации
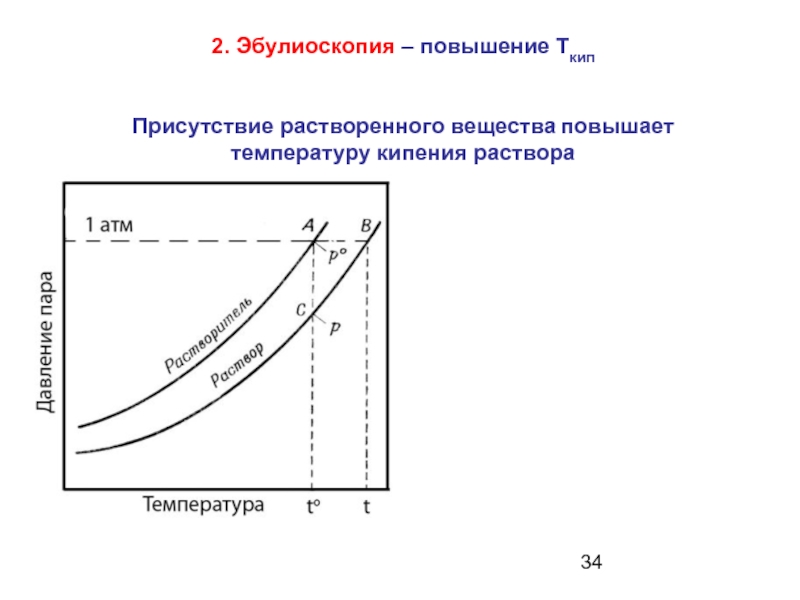
Слайд 342. Эбулиоскопия – повышение Ткип
Присутствие растворенного вещества повышает
температуру кипения
раствора
Слайд 35Кэ – эбулиоскопическая константа (град/моль·кг);
m – моляльность (число моль вещества
в 1000 г растворителя;)
Эбулиоскопия - способ определения М вещества
Слайд 373. Криоскопия – понижение Т замерзания
Присутствие растворенного вещества понижает
температуру
замерзания раствора.
Причина - молекулам растворителя сложней образовать
гомогенные кристаллы
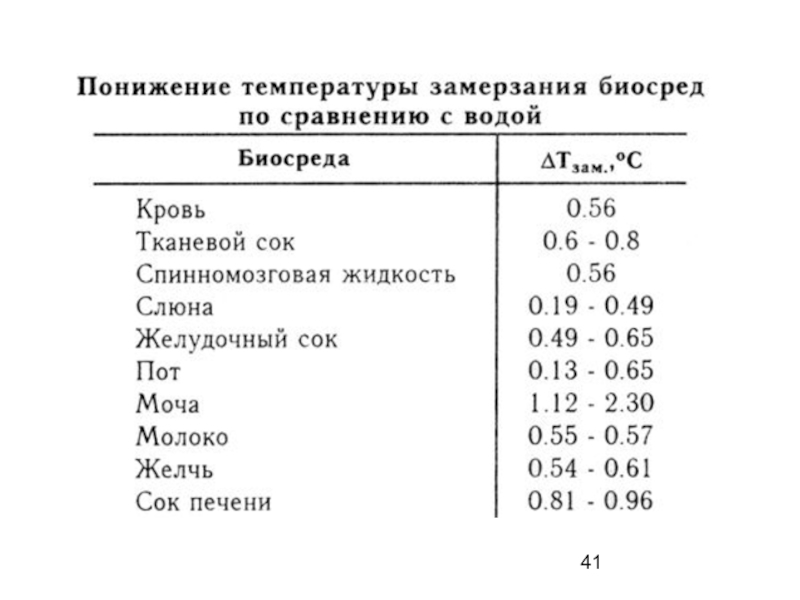
твердой фазы.Слайд 40Растворы различных веществ в воде замерзают при температуре ниже 0oС
Одномоляльные
растворы различных веществ в воде замерзают при температуре
-1.86oС
Слайд 42Определение температуры замерзания
неорганические: хлориды аммония, натрия, магния, кальция,
а также карбонат калия.
органические: этиловый спирт, глицерин и
этиленгликоль. Насыщенный раствор хлористого кальция остается жидким до - 55 °С.
Антифризы - вещества, понижающие температуру замерзания водных растворов
Слайд 434. Осмос. Осмотическое давление.
Осмос - самопроизвольная диффузия молекул растворителя
через
полупроницаемую мембрану
Мембрана пропускает молекулы растворителя,
но задерживает молекулы растворенного вещества.
Слайд 44Осмотическое давление – минимальное гидравлическое давление, которое нужно приложить к
раствору, чтобы осмос прекратился
Причина осмоса - стремление вещества распределяться равномерно
по всему объему растворителя.Слайд 45 Уравнение осмотического давления находит широкое применение, при определении молекулярных
весов макромолекул (каучук, целлюлоза, белки)
Закон Вант-Гоффа
Осмотическое
давление вещества в растворе равно тому давлению, которое оно оказывало, если бы находилось в том же объеме, будучи в газообразном состоянии.Слайд 47За счет осмотического давления мог бы удерживаться столб морской воды
высотой около 238 м!
Если бы удалось создать
суперпрочные полупроницаемые мембраны, это открыло бы возможность вырабатывать большое количество электроэнергии, устанавливая гидроэлектростанции в устье пресных рек, впадающих в моря и океаны. Слайд 48Ученые предполагают, что египтяне откалывали гранитные глыбы, заливая помещенные в
расщелины скал стволы деревьев
соленым раствором.
Для 1М раствора любого вещества
при T = 273 КРосм = 2270 кПа или 22,4 атм.
1 атм = 101.325 кПа
Слайд 49Осмотическое давление
плазмы крови человека - 7.4-7.8 атм
( 740 – 780
кПа)
рыб
до15 атм.
растений
до 100 атм.
прорастающих семян
до 400 атм.
Слайд 50 i показывает, во сколько раз истинная концентрация
кинетически активных частиц в растворе электролита больше, чем в растворе
неэлектролита с той же концентрациейКоэффициент Вант-Гоффа можно определить вышеизложенными методами
Для растворов электролитов в формулу вводится
коэффициент Вант-Гоффа i
Слайд 51Осмометры
а) с животной мембраной
б) с фарфоровой мембраной, пропитанной феррицианидом меди
в) для прямого измерения осмотического давления
Слайд 52Онкотическое давление
– осмотическое давление, создаваемое за счет наличия белков
в биожидкостях организма и составляет 0,5% от общего осмотического давления
плазмы ( 0.025 – 0.04 атм ) Разрушение белков при гнойных процессах сильно увеличивает величину онкотического давления.
При заболеваниях, сопровождающихся уменьшением концентрации белков крови, онкотическое давление падает. Возникают так называемые онкотические отеки подкожной клетчатки.
Онкотическое давление играет важную роль в процессах всасывания жидкости из тканей в кровеносные сосуды.
Слайд 53 Осмолярная концентрация - суммарное молярное количество всех
кинетически активных частиц, содержащихся в 1 литре раствора, независимо от
их формы, размера и природы ( 0.29 – 0.30 моль/л)Их суммарное осмотическое давление при 37°С составляет 7,7 атм.
Осмолярность
(осмолярная концентрация)
Слайд 54Физиологические растворы
0,9%-ный ( 0,15 М ) раствор NаСl и
5% - ный ( 0,3М ) раствор глюкозы создают такое
же давление являющиеся, следовательно, изотоническими по отношению к крови.Истинно физиологическими !!!
считаются растворы, включающие соли, белки и другие вещества в пропорциях, соответствующих их содержанию в крови человека и используемые в аппарате «искусственная почка»
Слайд 55Изоосмия
Изоосмия - постоянство осмотического давления физиологических сред (фундаментальное
физико-химическое требование гомеостаза).
Нарушение изоосмии оказывается губительным для
организма гораздо раньше, чем наступает плазмолиз или лизис клеток. Понижение осмотического давления (избыток воды, потеря солей) вызывает рвоту, судороги, затемнение сознания, вплоть до гибели организма.
Повышение же осмотического давления (потеря воды, избыток солей) вызывает их отеки, в первую очередь подкожной клетчатке.
Слайд 56Изо-, гипер- и гипотонические растворы
Изотонические - с одинаковым
осмотическим давлением (0.9%)
Гипертонические - с большим осмотическим давлением (>0.9%)
Гипотонические -
с меньшим осмотическим давлением (<0.9%)Во всех случаях, когда в кровяное русло, мышечную ткань, спинномозговой канал в терапевтических целях вводят растворы, необходимо избегать «осмотического конфликта».
Слайд 57
Осмотический стресс (конфликт) : пребывание в воде, которая либо неестественно
богата минеральными веществами, либо, наоборот, неестественно бедна ими. Осмотический стресс
имеет более серьезные последствия для рыб тех видов, которые в природе обитают в водоемах, богатых минеральными веществами, а в аквариуме их держат в воде, крайне бедной этими веществами, так что осмотическая разница между рыбой и окружающей средой значительно увеличивается. Такие рыбы имеют менее эффективную систему осмотической регуляции, чем те, которые физиологически адаптированы к жизни в воде, бедной минеральными веществами. Поэтому они не способны справиться с возникающими в результате подобных условий перегрузками осморегулирующей системы.В случае осмотического стресса концентрацию растворенных солей следует изменять постепенно в течение 1-2 недель, чтобы избежать осмотического шока.
Слайд 58Осмотический шок: внезапное изменение концентрации растворенных солей - например, если
рыбу без постепенной акклиматизации пересаживают из воды, бедной минеральными солями,
в воду, богатую минеральными солями (или наоборот). Это приводит к смерти рыбы в течение 2-3 суток и часто является причиной высокой смертности среди недавно приобретенных рыб у невежественных или равнодушных аквариумистов.Лечение. Приведите содержание минеральных солей в воде к уровню, приемлемому для данного вида рыб.
В случае осмотического шока это соответствие должно быть полным, а установить его нужно немедленно. Недавно приобретенных рыб, если они явно поражены, лучше перевести в другой аквариум с подходящим химическим составом воды (например, в карантинный аквариум, где они в любом случае должны какое-то время находиться!), вместо того чтобы изменять химический состав воды в основном аквариуме, так как это может вызвать осмотический шок у рыб, уже живущих там. Потом воду в карантинном аквариуме можно постепенно, в течение 2-3 недель, привести в соответствие с водой в основном аквариуме и тогда перевести новых рыб в их постоянное жилище.
Слайд 59Изменения, происходящие с кровяными тельцами в растворах NaCl различной концентрации
При
введении гипертонических наблюдается:
1) осмотический шок
2) осмотический конфликт
3) флуороз
4) ацидоз
5) Алкалоз
При
введении гипотонических растворов наблюдается:1) осмотический шок
2) осмотический конфликт
3) ацидоз
4) алкалоз
5) флуороз
Слайд 60Рабочие «горячих» цехов должны пить подсоленную воду, так как в
результате повышенного потоотделения
осмотическое давление у них понижается !
Слайд 61Лизис, плазмолиз, гемолиз.
Лизис -
разрыв клетки при введении гипотонического по отношению к крови раствора
Гемолиз - разрыв эритроцитных оболочек при введениигипотонического по отношению к крови раствора
Плазмолиз - обезвоживание эритроцитов при введении
гипертонического по отношению к крови раствора
Начальная стадия гемолиза происходит при снижении
осмотического давления до 3,5–3,9 , а полный гемолиз при 2,5- 3,0 атм.
Слайд 620,9 % NaCl
изотонический раствор
1.2 % NaCl
гипертонический раствор
0,3 % NaCl
гипотонический раствор
Изменения,
происходящие с кровяными тельцами в растворах NaCl различной концентрации
норма
гемолиз
(лизис)
плазмолиз
Слайд 63Немецкие ученые Эрвин Неер и Берт Сакманн
открыли ионные каналы,
по которым происходит диффузия
и ионообмен между клетками организма
(Нобелевская
премия по медицине – 1991 «За открытия, касающиеся функций одиночных ионных каналов в клетках» и разработку метода локальной фиксации потенциала. ) Ученые применили этот принцип для лечения лимфатических отеков и для борьбы с целлюлитом.
Слайд 64 При целлюлите концентрация ионов повышается во внеклеточном
пространстве, и клетка запускает механизм ее снижения.
Вода из клетки
устремляется во внеклеточное пространство, чтобы разбавить внеклеточную жидкость и таким образом понизить концентрацию ионов.В итоге клетка обезвоживается, но зато "снаружи" воды скапливается так много, что возникают отеки.
Целлюлит
Слайд 65 Движущей силой "внедрения"
является эффект осмотического давления.
Для нормализации
соле- и водообмена в клетку нужно доставить недостающие
ионы:- натрия,
- кальция,
- калия,
- магния,
- хлора.
“Внедриться " в клетку ионы могут по ионным каналам, по которым происходят диффузия и ионообмен между клетками организма.
Слайд 66Типичные для целлюлита
выпячивания жировой ткани
После восстановления
ионного равновесия
выпячивания исчезают.
Слайд 67По мнению диетологов, ирония кроется в том, что многие женщины,
изнуряющие себя строгими диетами для достижения стройной фигуры, не следят
за правильным балансом микроэлементов в потребляемой пище и как следствие провоцируют возникновение или усугубление уже существующего целлюлита.NB!!! Последние разработки ученых выявили еще одну причину возникновения целлюлита. В ходе исследований они наблюдали за женщинами, придерживающимися строгих диет. Общей чертой этих диет оказалось несбалансированное, бедное белковой пищей питание. Очень многие женщины из-за этого столкнулись с проблемой целлюлита.
Но не только нехватка белков в рационе играет здесь роковую роль причины целлюлита. Организм воспринимает строгие ограничения в пище, как сильнейший стресс. Он начинает активно вырабатывать глюкокортикоиды. Эти вещества, попадая в кровь, активно разрушают белки.
Слайд 68 Консервирование продуктов питания происходит благодаря уничтожению микроорганизмов
вследствие их плазмолиза.
Плазмолиз также наблюдается при посыпании ягод или
фруктов сахаром, а овощей, мяса илирыбы - солью.
Слайд 69Тургор
– осмотическое набухание клетки с появлением сильного
внутреннего давления
Тургор определяет объем и форму клеток
(эритроцитов).Для нормального функционирования тургорное давление должно быть ниже осмотического - только в этих условиях наблюдается активный транспорт в клетку.
Испарение воды листьями в окружающую среду (транспирация) поддерживается накоплением воды через ствол и ветви за счет осмотического давления.
Слайд 71
Гипогидратация – обезвоживание организма вследствие значительного снижения поступления воды в
организм,
либо чрезмерные её потери.
Слайд 73Значение осмотического давления
1. Слабительное действие глауберовой соли
Na2SO4·10H2O и горькой соли MgSO4·7H2O.
Плохая всасываемость стенками желудка
вызывает интенсивный переход воды внутрь кишечника, способствуя послабляющему действию.Слайд 74Desalination system that uses reverse osmosis.
When ocean water is
subjected to a pressure greater than its osmotic pressure, pure
water passes through a series of membranes (contained in the blue tubes, lower right), leaving a more concentrated salt solution behind.2. Осмотическая очистка морской воды
Слайд 753. Перитонеальный диализ.
При острых отравлениях в брюшную
полость вводят избыток сильного электролита с одновременным обильным введением влаги
в желудок и кишечник. Происходит интенсивный переход воды из желудочно-кишечного тракта в брюшную полость, увлекающий с собой токсическое вещество.Слайд 76 4. При очистке ран от гноя и
носителей инфекции используют гипертонические марлевые повязки, пропитанные 10%-ным раствором NaCI
или этанолом .5. При глаукоме гипертонические растворы вводят внутривенно чтобы снизить внутриглазное давление.
Слайд 77 6. Осмос и диализ - основа ряда физиологических процессов:
усвоение пищи, окислительные процессы связанные с дыхательной цепи,
распределение питательных веществ, жидкостной обмен в тканях, выделение продуктов жизнедеятельности.7. Осмос при купании
В пресной воде болевые ощущения, резь в глазах более заметны (осмос воды направлен внутрь глазного яблока).
В морской воде замечается покраснение глаз с незначительными болевыми ощущениями (осмос воды направлен из глазного яблока в морскую воду)