Слайд 1«Одна из самых удручающих обязанностей редактора медицинского журнала – необходимость
отвергать исследования, основанные на хорошей идее, но безнадежно испорченные плохой
методологией»
Стефан Лок
Редактор Британского медицинского журнала
1 этап. Формулировка цели и задач исследования. Обоснование актуальности (литературный обзор)
2 этап. Определение дизайна исследования
Методология проведения научного исследования
Слайд 2Дэвид Лоуренс Саккет
1934- 2015
Sackett DL, Rosenberg WMC, Gray JAM, Haynes
RB. Evidence based medicine: what it is and what it
isn’t. BMJ. 1996;312:71–72.
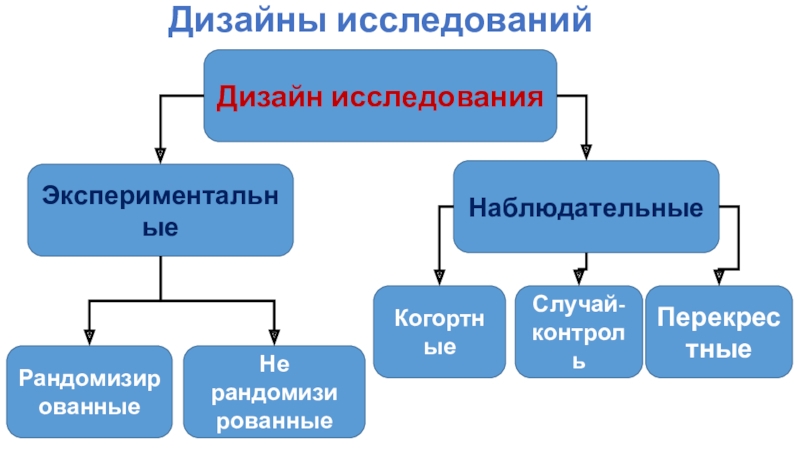
Слайд 3Дизайны исследований
Дизайн исследования
Экспериментальные
Наблюдательные
Рандомизированные
Не
рандомизи рованные
Когортные
Случай-контроль
Перекрестные
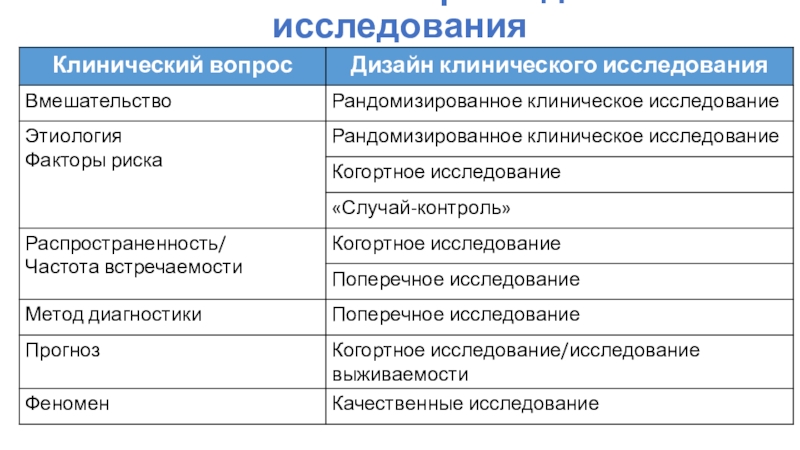
Слайд 4Клинический вопрос и дизайн исследования
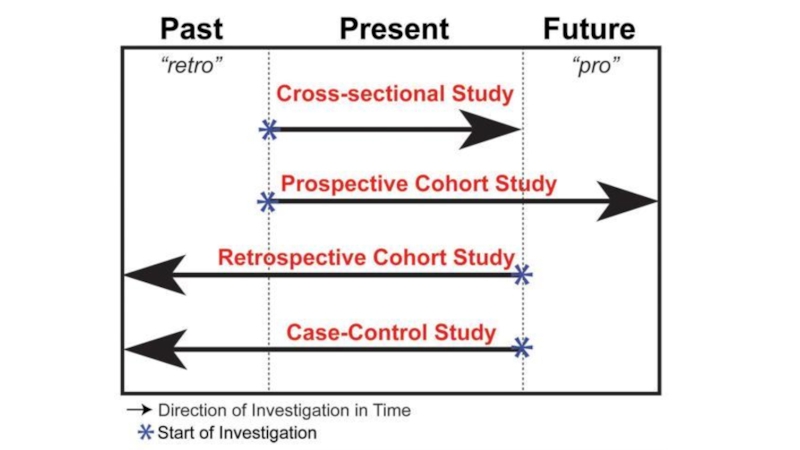
Слайд 5Наблюдательные исследования
Клинические исследование , при котором исследователь обирает данные путём
простого наблюдения событий в их естественном течении, не вмешиваясь в
них активно (нет эксперимента)
Выявляют взаимосвязь между различными факторами и развитием заболевания и состояниями – направлены на поиск причины.
Когортные исследования (cohort study)
«Случай –контроль» (case-control study)
Поперечное исследование ( cross-sectional
study)
Всегда есть контрольная группа
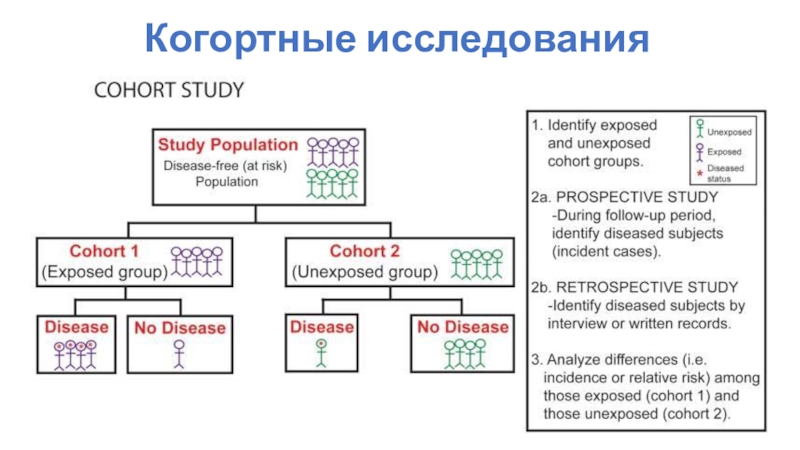
Слайд 7Когортные исследования
Cohort study
Когорта – тактическое подразделение армии Римской Империи,
одна десятая часть легиона
В эпидемиологии – группа людей с определенными
характеристиками, наблюдение за которой позволяет определить распространенность заболевания и состояния, а также выявить его причину.
Слайд 9Когортные исследования
Преимущества
Сбор данных последовательно: можно установить причину заболевания или
состояния;
Одновременное исследование множества исходов для данного воздействия (одно воздействие может
иметь несколько последствий);
Отлично подходит для изучения редких воздействий;
Можно посчитать частоту возникновения заболевания в исследуемой и контрольной группе (заболеваемость, относительный риск)
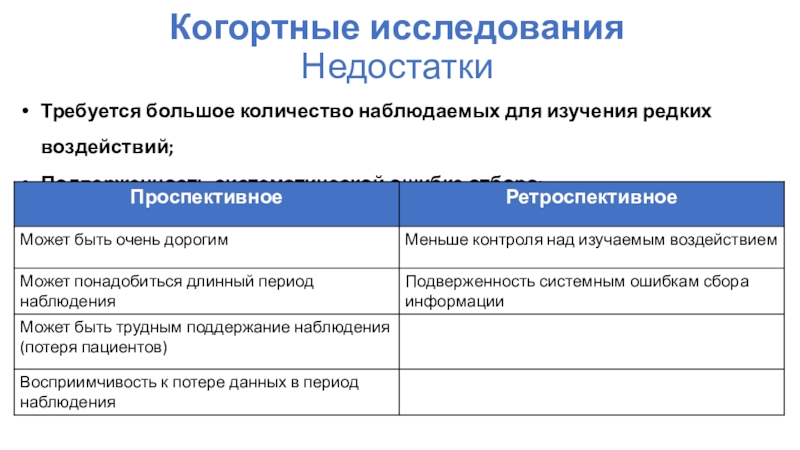
Слайд 10Когортные исследования
Недостатки
Требуется большое количество наблюдаемых для изучения редких воздействий;
Подверженность систематической
ошибке отбора;
Слайд 11Частота встречаемости
Incidence Rate (IR)
Частота встречаемости заболевания в группе,
подверженной воздействию
A/(A+B)
Частота
встречаемости заболевания в группе,
не подверженной воздействию
C/(C+D)
Частота встречаемости заболевания в популяции
A+C/(B+D)
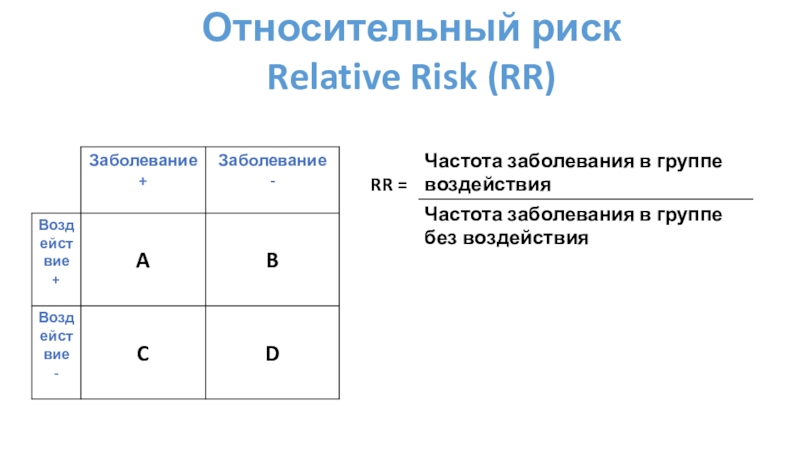
Слайд 12Относительный риск
Relative Risk (RR)
Слайд 13Атрибутивный риск
Attributable Risk (AR)
Атрибутивный риск — дополнительный риск возникновения неблагоприятного
исхода в связи с наличием определенной характеристики (фактора риска) у
объекта исследования.
Атрибутивный риск развития болезни связан с определенным фактором риска, объясняется им и может быть предотвращен, если этот фактор риска устранить.
Частота встречаемости заболевания в группе,
подверженной воздействию
Частота встречаемости заболевания в группе,
не подверженной воздействию
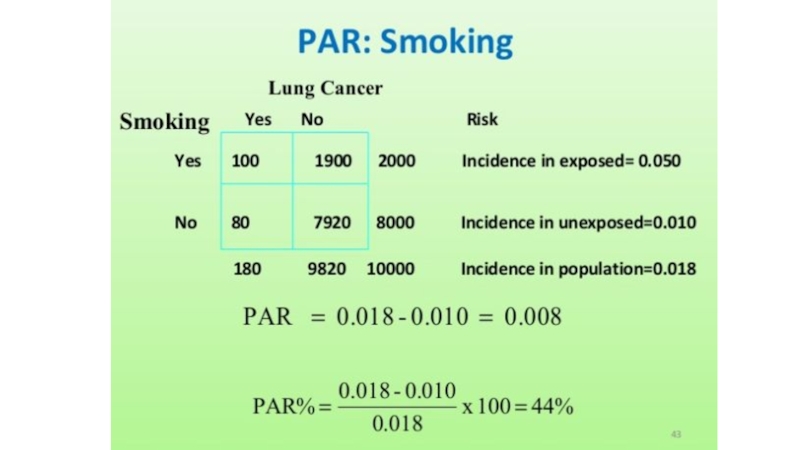
Слайд 14Атрибутивный риск для популяции
Population Attributable Risk (PAR)
Частота встречаемости заболевания в
популяции
Частота встречаемости заболевания в группе,
не подверженной воздействию
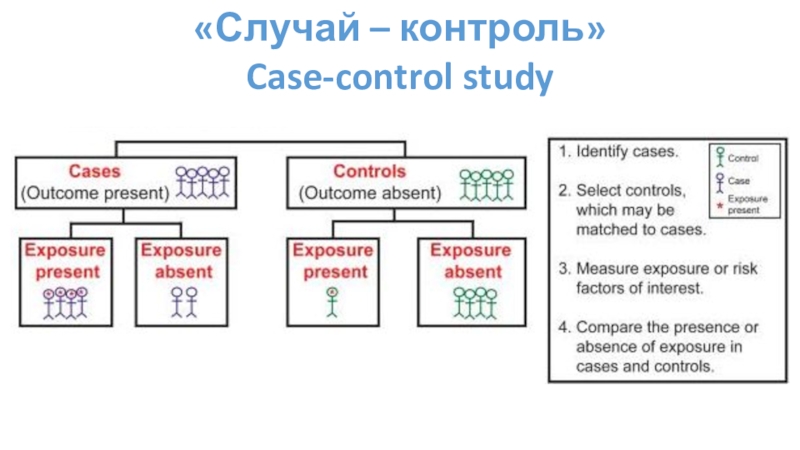
Слайд 16«Случай – контроль»
Case-control study
Отличительные черты:
Заболевание и воздействие уже произошли до
начала исследования;
Ретроспективно оценивает влияние фактора риска на развитие заболевания;
Есть контрольная
группа.
Гиппократ
Слайд 17«Случай – контроль»
Case-control study
Слайд 18«Случай – контроль»
Преимущества
Хорошо подходят для изучения редких заболеваний, или заболеваний
с длительным периодом развития;
Можно провести относительно быстро;
Относительно недорогое;
Требует сравнительно небольшое
количество наблюдаемых;
Можно использовать уже существующие данные;
Одновременно можно изучить несколько факторов риска
Слайд 19«Случай – контроль»
Недостатки
Восприимчивы к информационным системным ошибкам;
Трудно проверить информацию
Сложно правильно
выбрать группу сравнения
Нельзя определить распространенность фактора риска
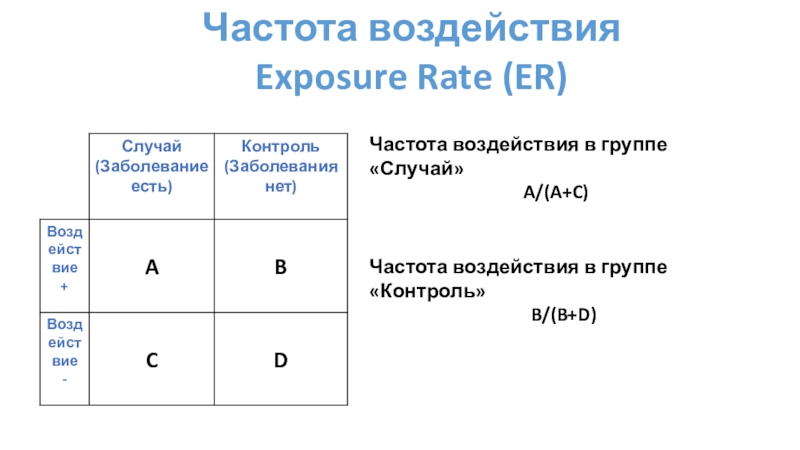
Слайд 20Частота воздействия
Exposure Rate (ER)
Частота воздействия в группе «Случай»
A/(A+C)
Частота воздействия в
группе «Контроль»
B/(B+D)
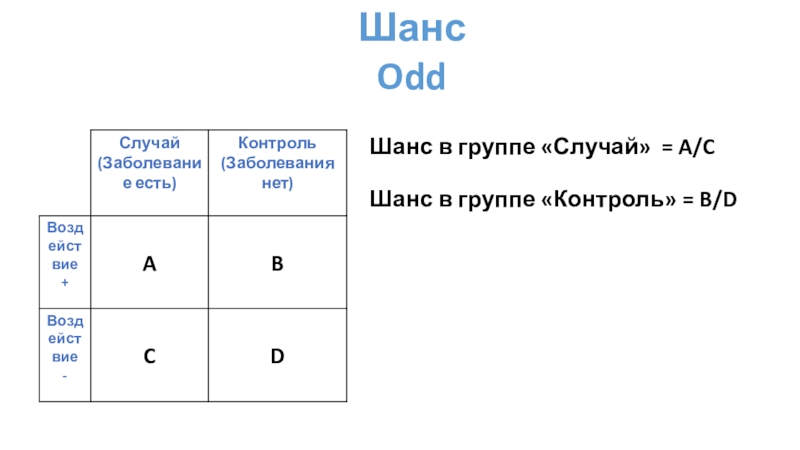
Слайд 21Шанс
Odd
Шанс в группе «Случай» = A/C
Шанс в группе «Контроль» =
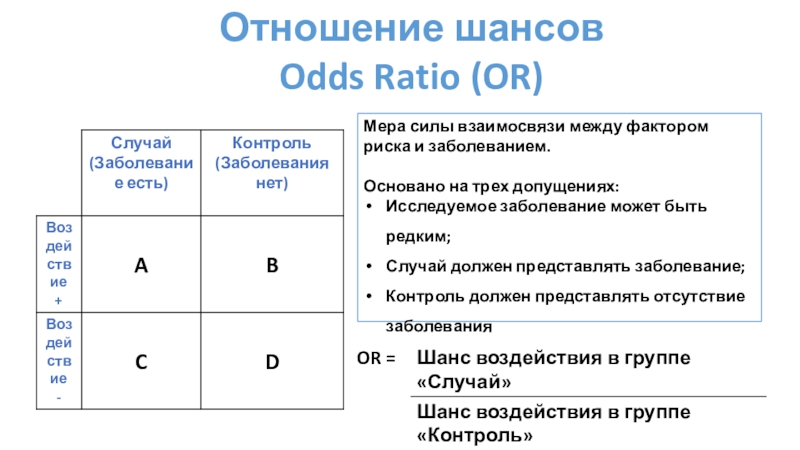
Слайд 22Отношение шансов
Odds Ratio (OR)
Мера силы взаимосвязи между фактором риска и
заболеванием.
Основано на трех допущениях:
Исследуемое заболевание может быть редким;
Случай должен представлять
заболевание;
Контроль должен представлять отсутствие заболевания
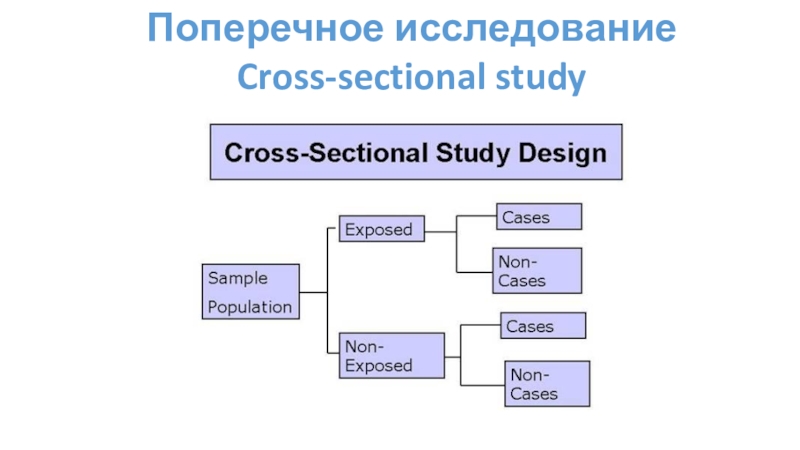
Слайд 23Поперечное исследование
Cross-sectional study
Отличительные черты:
«Моментальный снимок» популяции;
Одновременная оценка воздействия и
результата в определенный момент времени;
Высчитывается распространенность (prevalence) а не заболеваемость
(incidence);
Недорогое и быстрое исследование;
Первый шаг при оценке взаимосвязей.
Слайд 24Поперечное исследование
Cross-sectional study
Слайд 25Поперечное исследование
Преимущества
Быстро;
Недорого;
Можно оценить распространенность в популяции заболеваний и факторов риска;
Возможность
трансформации дизайна исследования («случай – контроль», проспективное когортное исследование)
Слайд 26Поперечное исследование
Недостатки
Подверженность систематическим ошибкам отбора (selection bias)
Не подходит для редких
заболеваний;
Нельзя оценить воздействие с течением времени.
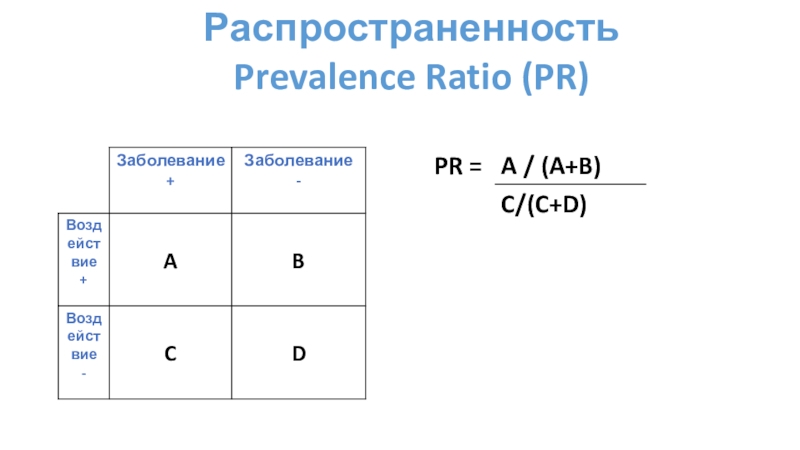
Слайд 27Распространенность
Prevalence Ratio (PR)
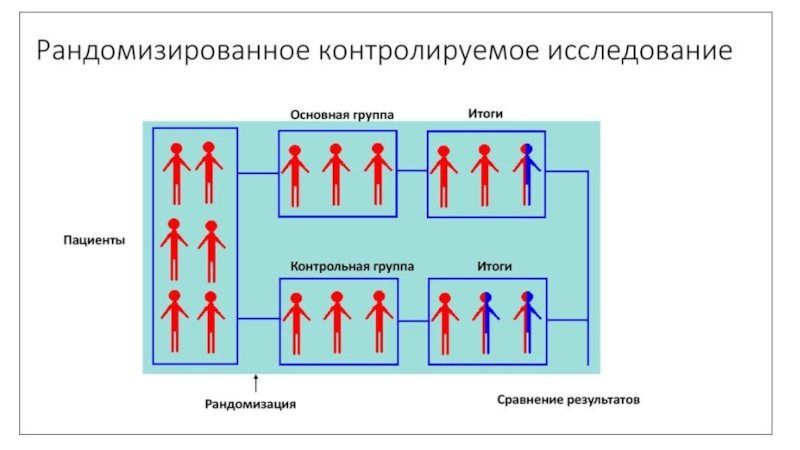
Слайд 28Рандомизированные клинические
исследования
Рандомизированное контролируемое испытание — тип научного (часто медицинского) эксперимента, при
котором его участники случайным образам делятся на группы, в одной
из которых проводится исследуемое вмешательство, а в другой (контрольной) применяются стандартные методики, плацебо или отсутствие вмешательства.
Основное преимущество – низкая вероятность
систематической ошибки
Слайд 29Первое в мире рандомизированное клиническое исследование
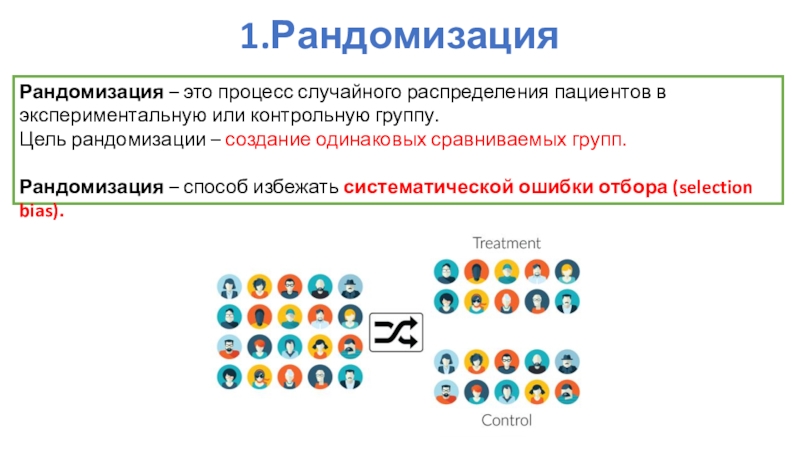
Слайд 311.Рандомизация
Рандомизация – это процесс случайного распределения пациентов в экспериментальную или
контрольную группу.
Цель рандомизации – создание одинаковых сравниваемых групп.
Рандомизация – способ
избежать систематической ошибки отбора (selection bias).
Слайд 32Рандомизация
Для этой цели используют метод «ослепления» (blinding).
Простое «слепое» (single-blind)
— о принадлежности к определенной группе не знает больной, но
знает врач;
Двойное «слепое» (double-blind) — о принадлежности к определенной группе не знают ни больной, ни врач;
Тройное «слепое» (triple-blind) — о принадлежности к определенной группе не знают больной, врач и организаторы исследования
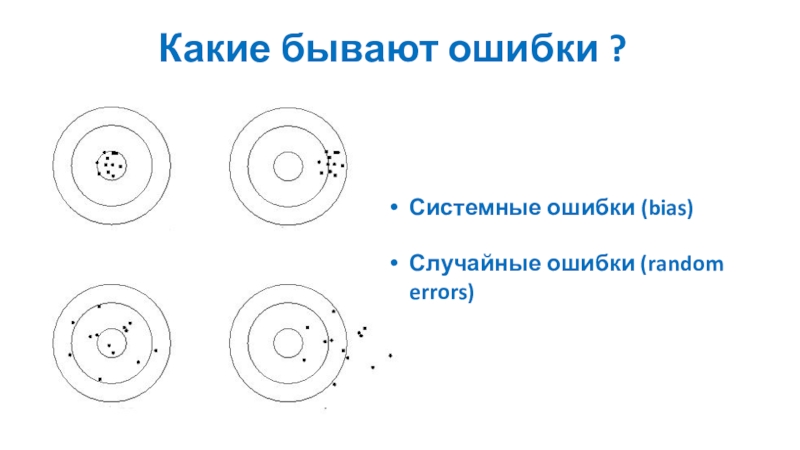
Слайд 34Какие бывают ошибки ?
Системные ошибки (bias)
Случайные ошибки (random errors)
Слайд 36Критическая оценка рандомизированных клинических исследований
Рандомизация (Randomization)
Ослепление (Blinding)
Период наблюдения (Follow-up)
Результаты (Outcomes)
Анализ
результатов (Analysis)
Системные ошибки (Bias)
Слайд 37Гипотеза
Нулевая гипотеза – это та гипотеза, которую мы должны опровергнуть
в исследовании (как правило гипотеза о том, что между сравниваемыми
группами нет никакой разницы).
Альтернативная гипотеза – гипотеза, которую мы предполагаем и должны доказать, путем опровержения нулевой гипотезы.
Слайд 38Размер выборки
Sample size
Ошибка первого рода;
Ошибка второго рода;
Размер эффекта лечения;
Дизайн исследования;
Равноценность
групп по числу участников;
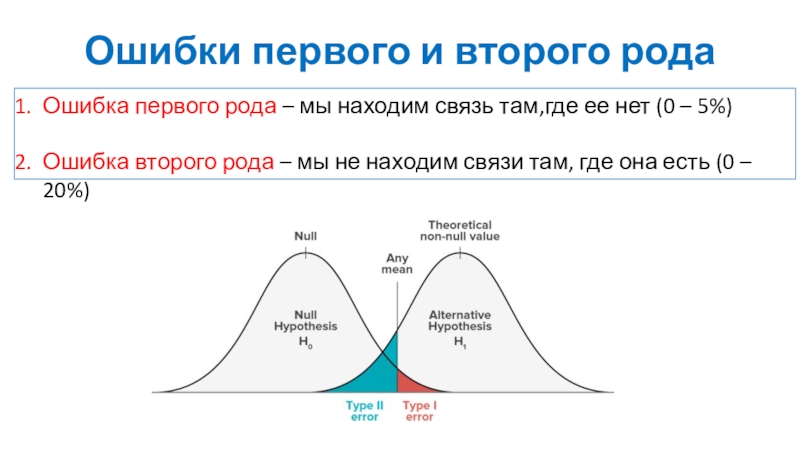
Слайд 39Ошибки первого и второго рода
Ошибка первого рода – мы находим
связь там,где ее нет (0 – 5%)
Ошибка второго рода –
мы не находим связи там, где она есть (0 – 20%)
Слайд 40Результаты: достигли ли мы конечной точки ?
Слайд 41Конечная точка
End-point
Конечная точка – это та характеристика , на которую
должно влиять экспериментальное воздействие, и ради которой планируется клиническое исследование.
Первичная
конечная точка (Primary end-point)
Вторичная конечная точка (Secondary end-point)
Конечная точка должна быть клинически значимой и определена до начала исследования.
Положительное исследование – когда доказана альтернативная гипотеза, и достигнута первичная конечная точка, запланированная до начала исследования.
Слайд 42
Измерение результатов исследований
Относительный риск ( Relative Risk)
Снижение абсолютного риска (Absolute
risk reduction)
Снижение относительного риска ( Relative Risk Reduction)
Количество необходимое для
лечения (Number Needed to Treat)
Количество необходимое для осложнения (Number Needed to Harm)
Учитывается длительность наблюдения в исследовании
Follow-up
Слайд 43
Относительный риск
Relative Risk (RR)
RR говорит нам во сколько раз
больше вероятность того, что событие будет происходить в группе лечения
по сравнению с контрольной группой.
RR = 1 означает, что нет никакой разницы между группы
RR < 1 означает, что лечение снижает риск исхода
RR > 1 означает, что при лечении увеличивается риск исхода
Слайд 44
Снижение абсолютного риска
Absolute Risk Reduction (ARR)
ARR говорит нам, что
абсолютная разница в вероятности результата между двумя группами и дает
представление о базовом риске и эффекта лечения.
ARR = 0 означает, что нет никакой разницы между 2 группами (так, лечение не оказывает никакого лечения)
Риск в группе лечения – Риск в группе сравнения
Слайд 45
Снижение относительного риска
Relative Risk Reduction (RRR)
RRR говорит нам о
снижении вероятности исхода в группе лечения по сравнению с контрольной
группой. RRR является наиболее распространенной мерой воздействия лечения.
1 – Относительный риск (RR)
Снижение абсолютного риска (ARR)/ Риск в контрольной группе
Слайд 46
Количество необходимое для лечения
Number Needed to Treat (NNT)
NNT показывает
среднее число пациентов, которых необходимо лечить, чтобы достичь определенного благоприятного
исхода или предотвратить один неблагоприятный исход, в сравнении с контрольной группой.
Чем выше показатель,тем менее эффективно лечение.
Идеальный показатель равен 1
1/ Снижение абсолютного риска (ARR)
Слайд 47
Количество необходимое для развития осложнения/побочного действия
Number Needed to Harm
(NNH)
NNH показывает среднее число пациентов, которых необходимо лечить, чтобы достичь
определенного неблагоприятного исхода,в сравнении с контрольной группой.
Чем выше показатель,тем менее вероятны осложнения лечения.
1/ Атрибутивный риск (AR)
Слайд 48
Применение результатов
для популяции
P – значение (p value) = 0,05
Доверительный интервал
(confidence interval) = CI 95%
Статистическая значимость
Клиническая значимость
Слайд 49Систематический обзор и мета-анализ
Статистический синтез данных из разных, но подобных,
т.е. сопоставимых исследований, итог которого — количественная оценка обобщенных результатов.
Цель - увеличить статистическую мощность исследования, снизить уровень ошибки второго рода.
Dickerson K., Berlin J. A. Meta-analysis: State of the Science. Epidemiol Rev, 1992; 14:154–76.
Первый мета-анализ в 1940
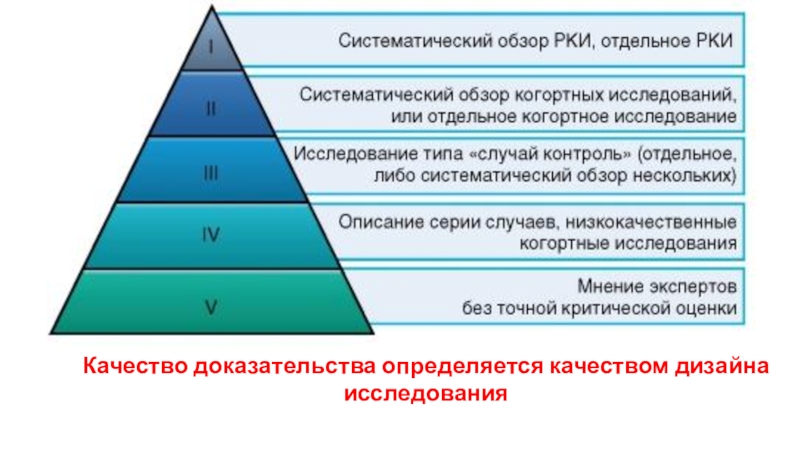
Слайд 51Качество доказательства определяется качеством дизайна исследования