Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 КУРС! Внимание! Материалы для подготовки к лекциям и занятиям находятся на
Содержание
- 1. 1 КУРС! Внимание! Материалы для подготовки к лекциям и занятиям находятся на
- 2. ОБЯЗАТЕЛЬНО!!!Закон, который нельзя нарушать:«Конспекты готовим накануне лекции,
- 3. «Термодинамика химических процессов».Кафедра общей и медицинской химии
- 4. Слайд 4
- 5. Химическая термодинамика изучает переходы энергии из одной
- 6. Слайд 6
- 7. Важнейшие внешние параметры – давление p, объем
- 8. Для количественной характеристики систем применяют термодинамические функции
- 9. Абсолютные значения термодинамических функций Ф системы(кроме энтропии)
- 10. Связь теплоты и внутренней энергии. Введение энтальпии.Для
- 11. При изобарном процессе количество теплоты, поглощенное или
- 12. По величине и знаку теплового эффекта реакции
- 13. Для использования в расчетах значения термодинамических функций
- 14. В химической термодинамике каждому элементу сопоставляют эталонное
- 15. Следствия из закона Гесса:Энтальпия (тепловой эффект) реакции
- 16. 2. Тепловой эффект реакции равен разности суммы
- 17. где Δn – разность сумм коэффициентов, стоящих
- 18. Введение энтропии S.1. Статистический подходТермодинамическая вероятность Ω
- 19. где NA = 6,02·1023 моль-1 – постоянная
- 20. В обратимых изотермических процессах бесконечно малое изменение
- 21. В термодинамике любое вещество В может быть
- 22. Рост температуры и снижение давления увеличивает неупорядоченность
- 23. Основной вклад в энтропию системы вносят газы,
- 24. Введение энергий Гиббса G (изобарно-изотермического потенциала) и
- 25. В самопроизвольном процессе G и A уменьшаются,
- 26. Различные формулировки II начала (закона) термодинамики:В изолированных
- 27. Знак ∆G позволяет судить о термодинамической возможности
- 28. Энергия Гиббса образования вещества ΔGf
- 29. Для реакции окисления глюкозы, уравнение которой В
- 30. Различные формулировки III начала (закона) термодинамики:Энтропия идеального
- 31. 1. Большинство реакций в организме обратимы
- 32. Принцип Пригожинапроизводство энтропии dS/dt открытой системой, находящейся
- 33. Биоэнергетика Человеческий организм – открытая,
- 34. Главные компоненты пищи – белки, жиры и
- 35. «Вкусно» не всегда означает «калорийно». И если
- 36. Слайд 36
- 37. Аналогичный подход относится к витаминам
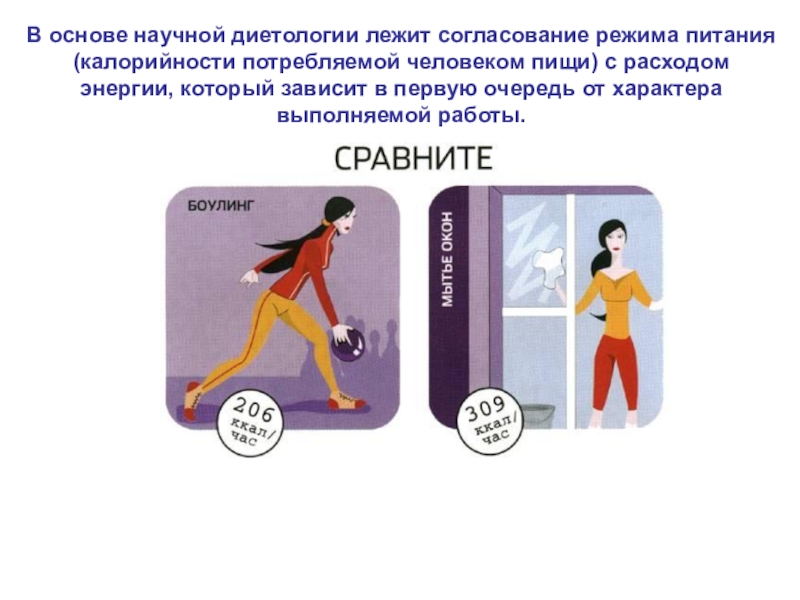
- 38. В основе научной диетологии лежит согласование режима
- 39. Суточная потребность человека в энергии при:
- 40. Спасибо за внимание!
- 41. Скачать презентанцию
Слайды и текст этой презентации
Слайд 11 КУРС!
Внимание!
Материалы для подготовки
к лекциям и занятиям находятся
на
сайте кафедры :
сайт gpmu.org→кафедры→
Слайд 2ОБЯЗАТЕЛЬНО!!!
Закон, который нельзя нарушать:
«Конспекты готовим накануне лекции, дома!!!
На лекциях идет
обсуждение материала и делаются пометки в готовые конспекты!!!»
Слайд 5Химическая термодинамика
изучает переходы энергии из одной формы в другую
и от одной части системы к другой; энергетические эффекты химических
и физико-химических процессов и возможность самопроизвольного протекания этих процессов. Она применима только к макроскопическим системам.Химическая система – область пространства, содержащая одно или несколько веществ, и реально или мысленно отграниченная от внешней (окружающей) среды.
Фаза – часть системы, обладающая однородными физико-химическими свойствами во всех своих точках, отличающимися от свойств остальных частей системы, и ограниченная поверхностью раздела, переход которой сопровождается скачкообразным изменением свойств.
Слайд 7Важнейшие внешние параметры – давление p, объем V и температура
T. p и V связаны с работой, которая совершается системой
или над системой; T характеризует интенсивность хаотического движения частиц, которое осуществляет теплообмен между системой и окружающей средой.Работа W и теплота Q характеризуют процесс, а не состояния системы, его совершающей. Поэтому их значения зависят от того, каким путем система перешла от начального состояния к конечному, т. е. являются функциями процесса.
Слайд 8Для количественной характеристики систем применяют термодинамические функции состояния Ф. К
важнейшим из этих функций относятся внутренняя энергия U, энтальпия H,
энтропия S, энергии Гиббса G и Гельмгольца A. Их значения зависят только от состояния системы, но не зависят от того, каким путем система пришла в это состояние.Внутренняя энергия системы U, Дж – сумма кинетической энергии хаотического движения всех частиц системы и потенциальной энергии их взаимодействия между собой.
Энтальпия системы H, Дж – характеризует содержание энергии
в ней при изобарно(p = const)-изотермических(T = const) условиях.
Энтропия системы S, Дж/K – мера степени ее неупорядоченности.
Энергии Гиббса (Гельмгольца) системы G/A (ранее обозначалась F), Дж – та часть энергии системы, которую при изобарно (изохорно[V = const])-изотермических условиях можно превратить в работу.
Слайд 9Абсолютные значения термодинамических функций Ф системы
(кроме энтропии) найти невозможно, для
характеристики
процессов, в частности реакций, используют изменения функций
Φ (функции процессов).
Φ
= Фкон Фнач. Для характеристики веществ применяют Φ и S. Конкретные
значения функций и их изменений зависят от количеств веществ
в системе (процессе), поэтому Ф и Φ относят к 1 моль вещества
или пробегов процесса (реакции).
Различные формулировки I начала (закона) термодинамики:
1. Теплота Q, сообщаемая закрытой системе, идет на приращение внутренней энергии ∆U и на работу W, совершаемую системой
Q = ∆U + W.
2. В изолированной системе изменение внутренней энергии не происходит
∆U = 0.
3. Энергия не исчезает и не возникает из ничего, а только превра-
щается из одной формы в другую.
4. Вечный двигатель 1-го рода (устройство, вырабатывающее
больше работы, чем сообщённая ему энергия) создать нельзя.
Слайд 10Связь теплоты и внутренней энергии. Введение энтальпии.
Для химических реакций под
работой против внешних сил обычно подразумевается работа сжатия или расширения
газа при постоянном давлении. При переходе закрытой системы из состояния 1 в состояние 2 величина этой работы определяется следующим выражением:Слайд 11При изобарном процессе количество теплоты, поглощенное или выделенное системой (тепловой
эффект процесса) Qp, равно изменению энтальпии системы ∆Н, т. е.
при p = const Qp = ∆Н.
В этом случае тепловой эффект реакции является изменением энтальпии системы в ходе реакции (энтальпией реакции) и обозначается Нх.р. (Нr, rН, Нр-ции).
r – первая буква reaction (англ.) – реакция.
При изохорном процессе, когда ∆V = 0, тепловой эффект процесса QV является изменением внутренней энергии системы ∆U, т. е.
при V = const QV = ∆U.
В этом случае тепловой эффект реакции является изменением внутренней энергии системы в ходе реакции (внутренней энергией реакции) и обозначается Uх.р. (Ur, rU, Uр-ции).
Слайд 12По величине и знаку теплового эффекта реакции делятся на три
типа:
экзотермические, протекающие с выделением теплоты,
у которых
эндотермические, протекающие с
поглощением теплоты, у которых
атермические, протекающие с нулевым тепловым эффектом,
у которых
Слайд 13Для использования в расчетах значения термодинамических функций приводят к стандартным
условиям, что отмечается правым верхним индексом «0»:
температура реакционной системы
постоянна, ее значение, указывается правым нижним индексом цифрами или буквой T (чаще всего используют 298 К – стандартную температуру);парциальное давление каждого газообразного участника реакции равно 1 атм, или внешнее давление равно 1 атм (если в реакции не участвуют газы);
концентрации (точнее, активности) всех растворенных участников реакции равны 1 моль/л.
Слайд 14В химической термодинамике каждому элементу сопоставляют эталонное простое вещество:
Значения
стандартных энтальпий образования при 298 K приводятся в справочниках. Стандартные энтальпии
образования эталонных простых веществ равны 0.Энтальпия (теплота) сгорания вещества ΔHc (ΔHсг.) – энтальпия реакции окисления 1 моль вещества газообразным O2.
c – первая буква combustion (англ.) – сгорание.
Значения стандартных энтальпий сгорания при 298 K приводятся в справочниках. Стандартные энтальпии сгорания газообразных CO2, HГ (Г – галоген), N2, SO2 и жидкой H2O равны 0.
Энтальпия (теплота) образования вещества ΔHf (ΔHобр.) – энтальпия реакции (реальной или условной), в ходе которой 1 моль вещества образуется из эталонных простых веществ.
f – первая буква formation (англ.) – образование.
Слайд 15Следствия из закона Гесса:
Энтальпия (тепловой эффект) реакции равна разности суммы
энтальпий образования продуктов ΔHf(продуктов), умноженных на коэффициенты nj, стоящие перед
их формулами в уравнении реакции, и суммы энтальпий образования реагентов ΔHf (реагентов), умноженных на коэффициенты ni, стоящие перед их формулами в уравнении реакции.Тепловые эффекты изобарных и изохорных процессов можно выразить через термодинамические функции состояния, т. е. они
не зависят от пути процесса, а зависят только от начального и конечного состояний системы. Это положение является следствием I начала термодинамики и называется
законом Гесса.
Слайд 162. Тепловой эффект реакции равен разности суммы энтальпий сгорания реагентов
ΔHc(реагентов), умноженных на коэффициенты nj, стоящие перед их формулами в
уравнении реакции, и суммы энтальпий сгорания продуктов ΔHc(продуктов), умноженных на коэффициенты ni, стоящие перед их формулами в уравнении реакции.Слайд 17где Δn – разность сумм коэффициентов, стоящих в уравнении
реакции перед
формулами газообразных продуктов и реагентов;
R = 8,31 Дж/(моль·К) –
универсальная газовая постоянная; T – температура, К.
Слайд 18Введение энтропии S.
1. Статистический подход
Термодинамическая вероятность Ω – число возможных
микросостояний, с помощью которых можно составить данное макросостояние.
Пусть в прямоугольной
коробке с 8 углублениями есть 4 шарика, которые при встряхивании могут переходить из одних углублений в другие. Всего имеется 70 различных расположений шариков, т. е. Ω = 70. Чем больше число микрочастиц в макросистеме, тем больше Ω.
Слайд 19где NA = 6,02·1023 моль-1 – постоянная Авогадро;
Ω – термодинамическая
вероятность системы;
k = 1,38·10−23 Дж/К – постоянная Больцмана.
Уравнение Больцмана
Слайд 20В обратимых изотермических процессах бесконечно малое изменение энтропии dS равняется
бесконечно малому изменению количества теплоты δQ, деленному на абсолютную температуру
T:2. Термодинамический подход
Упрощенно можно считать, что в обратимом изотермическом процессе изменение энтропии S примерно равно тепловому эффекту Q, деленному на T:
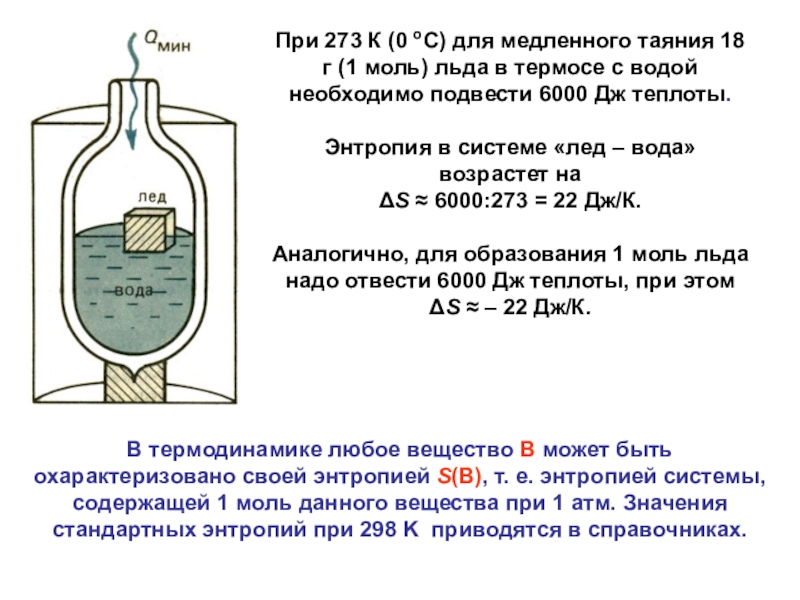
Слайд 21В термодинамике любое вещество В может быть охарактеризовано своей энтропией
S(В), т. е. энтропией системы, содержащей 1 моль данного вещества при
1 атм. Значения стандартных энтропий при 298 K приводятся в справочниках.При 273 К (0 оС) для медленного таяния 18 г (1 моль) льда в термосе с водой необходимо подвести 6000 Дж теплоты.
Энтропия в системе «лед – вода» возрастет на
ΔS ≈ 6000:273 = 22 Дж/К.
Аналогично, для образования 1 моль льда надо отвести 6000 Дж теплоты, при этом
ΔS ≈ – 22 Дж/К.
Слайд 22Рост температуры и снижение давления увеличивает неупорядоченность движения частиц, что
приводит к росту энтропии.
Энтропия газообразного вещества больше, чем жидкого,
а
жидкого – больше, чем твердого, например:Энтропии веществ используются для вычисления энтропии
реакции (Sr, rS, Sр-ции), равной разности суммы энтропий продуктов S(продуктов), умноженных на коэффициенты nj, стоящие перед их формулами в уравнении реакции, и суммы энтропий реагентов S(реагентов), умноженных на коэффициенты ni, стоящие перед их формулами в уравнении
реакции. При стандартных условиях и 298 К
Слайд 23Основной вклад в энтропию системы вносят газы, поскольку газообразное состояние
вещества является наиболее неупорядоченным. Поэтому, если среди участников реакции имеются
газы, то по ее уравнению (точнее, по значению Δn) можно примерно оценить величину и знак энтропии реакции ΔSx.р.. Если Δn > 0, то ΔSx.р. заметно положительна [имеет порядок сотен Дж/(К·моль)]; если Δn < 0, то энтропия реакции заметно отрицательна; наконец, если Δn = 0, то ΔSx.р. примерно равна нулю [имеет порядок десятков Дж/(К·моль)].Слайд 24Введение энергий Гиббса G (изобарно-изотермического потенциала) и Гельмгольца A (изохорно-изотермического
потенциала, ранее обозначалась F):
G = H – T·S
A = U – T· S ∆G = ∆H – T· ∆S ∆A = ∆U – T·∆S
При превращении твердых реагентов в жидкие продукты энтропия реакции положительна, например, в реакции, уравнение которой HgBr2(тв) = Br2(ж) + Hg(ж),
Чем больше |n|, тем больше |ΔSx.р.|.
∆H – энтальпийный фактор; T·∆S – энтропийный фактор, характеризующий ту часть энергии, которую нельзя превратить в работу (связанная энергия).
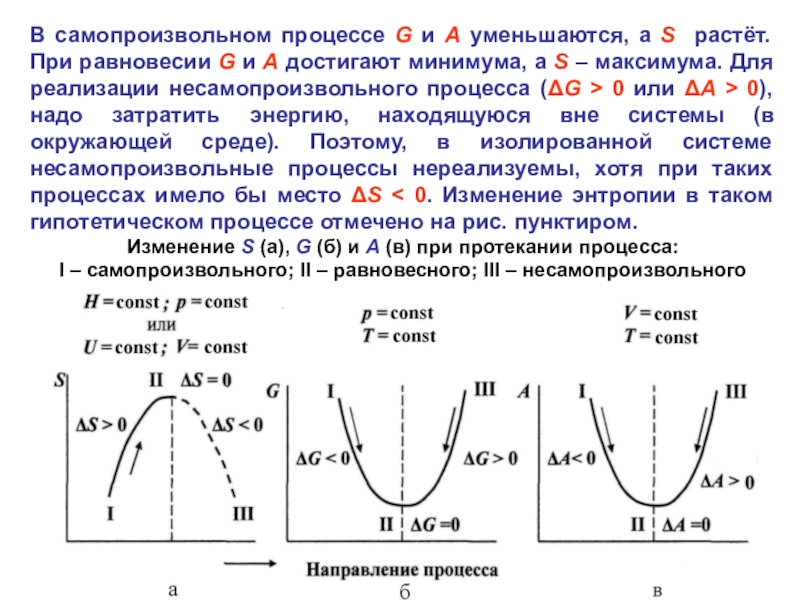
Слайд 25В самопроизвольном процессе G и A уменьшаются, а S растёт.
При равновесии G и A достигают минимума, а S –
максимума. Для реализации несамопроизвольного процесса (ΔG > 0 или ΔA > 0), надо затратить энергию, находящуюся вне системы (в окружающей среде). Поэтому, в изолированной системе несамопроизвольные процессы нереализуемы, хотя при таких процессах имело бы место ΔS < 0. Изменение энтропии в таком гипотетическом процессе отмечено на рис. пунктиром.Изменение S (а), G (б) и A (в) при протекании процесса:
I – самопроизвольного; II – равновесного; III – несамопроизвольного
Слайд 26Различные формулировки II начала (закона) термодинамики:
В изолированных системах самопроизвольно могут
протекать только те процессы, для которых ΔS ≥ 0.
2. Теплота
не может самопроизвольно перейти от более холодного тела к более теплому. 3. В изолированной системе внутренняя энергия остается постоянной ΔU = 0, а энтропия только повышается ΔS > 0.
4. КПД при переходе тепла в работу всегда < 1 (часть тепла расходуется на увеличение внутренней энергии).
5. Вечный двигатель 2-го рода (устройство, превращающее в работу всё тепло, извлекаемое из окружающей среды) невозможен.
6. При постоянных температуре и давлении (объеме) в
закрытой системе самопроизвольно могут протекать только
те процессы, для которых ΔG (или ΔA) < 0;
7. Критерием равновесия при постоянных температуре и
давлении/объеме в закрытой системе является условие
ΔG (или ΔA) = 0.
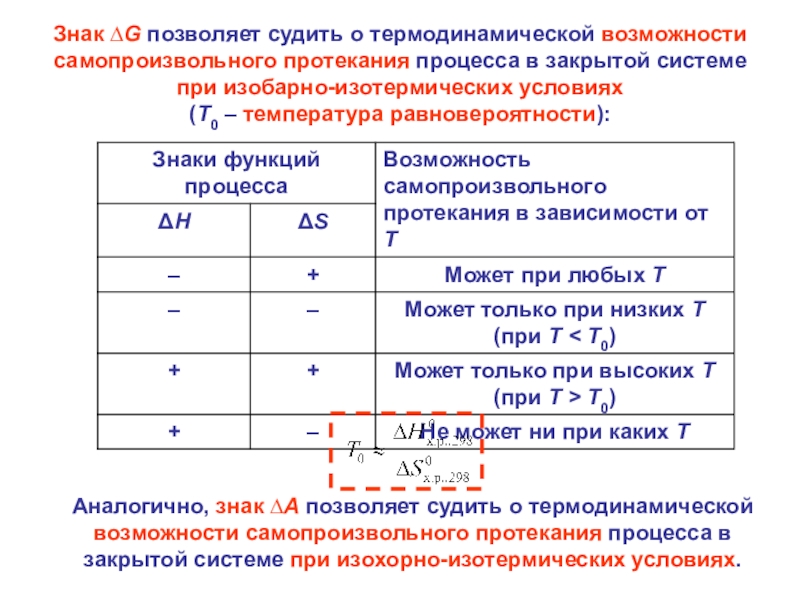
Слайд 27Знак ∆G позволяет судить о термодинамической возможности самопроизвольного протекания процесса
в закрытой системе при изобарно-изотермических условиях
(T0 – температура равновероятности):
Аналогично,
знак ∆A позволяет судить о термодинамической возможности самопроизвольного протекания процесса в закрытой системе при изохорно-изотермических условиях.Слайд 28 Энергия Гиббса образования вещества ΔGf (ΔGобр.) – энергия
Гиббса реакции (реальной или условной), в ходе которой 1 моль данного
вещества образуется из эталонных простых веществ. Значения стандартных энергий Гиббса образования при 298 K приводятся в справочниках. Стандартные энергии Гиббса образования эталонных простых веществ равны 0.Энергию Гиббса реакции при температуре T
можно найти, либо используя вычисленные значения ΔH и ΔS,
либо, аналогично первому следствию из закона Гесса, используя энергии Гиббса образования участников реакции,
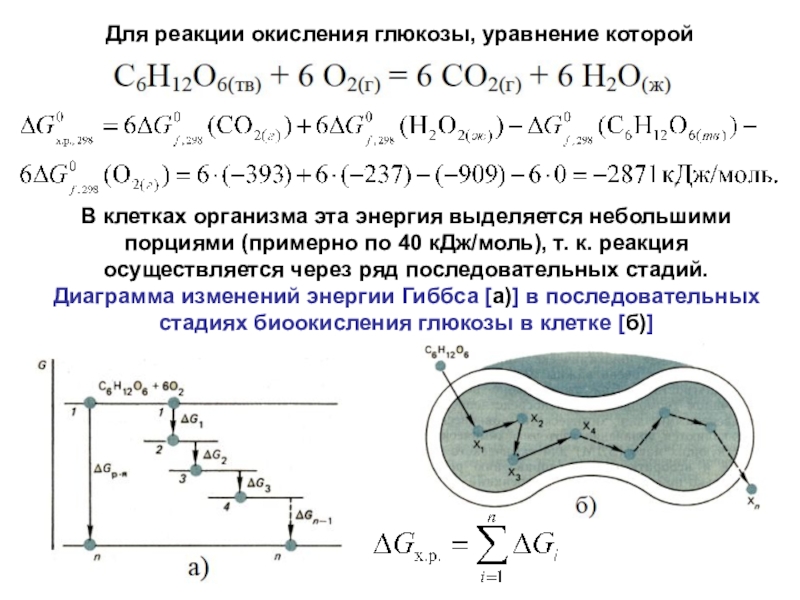
Слайд 29Для реакции окисления глюкозы, уравнение которой
В клетках организма эта
энергия выделяется небольшими порциями (примерно по 40 кДж/моль), т. к.
реакция осуществляется через ряд последовательных стадий.Диаграмма изменений энергии Гиббса [а)] в последовательных стадиях биоокисления глюкозы в клетке [б)]
Слайд 30Различные формулировки III начала (закона) термодинамики:
Энтропия идеального кристалла при 0
К равна нулю.
2. При стремлении температуры к нулю, энтропия для
равновесных состояний также стремится к нулю.
3. Абсолютный нуль недостижим.
4. При абсолютном нуле изменение энергии Гиббса равно изменению энтальпии
∆G = ∆H – T·∆S = ∆H – 0·∆S = ∆H.
При стремлении температуры к нулю движение частиц почти прекращается, поэтому термодинамическая вероятность
Ω стремится к 1, а S = k ln Ω стремится к 0.
В биохимии реакции, энергии Гиббса которых отрицательны, называются экзэргоническими, а реакции c положительными энергиями Гиббса – эндэргоническими.
Связь стандартных энергий Гиббса/Гельмгольца и констант равновесия Kp и Kc, выраженных соответственно через парциальные давления и концентрации
Слайд 31 1. Большинство реакций в организме обратимы и протекают многостадийно.
2. Биологическое развитие организма возможно только в системе, находящейся в
стационарном (постоянство термодинамических величин, скоростей поступления и удаления веществ и энергии), но далеком от равновесия состоянии.3. Живые организмы поддерживают присущую им высокую упорядоченность за счет увеличения энтропии внешней среды (в организм поступают вещества с низкими значениями энтропии [белки, углеводы], а выводятся из организма вещества с высокими значениями энтропии [вода, углекислый газ, аммиак]).
4. Реализация принципа энергетического сопряжения:
эндэргонические реакции сопряжены с экзэргоническими.
Особенности термодинамики биохимических процессов.
глюкоза + фруктоза → сахароза + Н2О
глюкоза + фруктоза + АТФ → сахароза + АДФ + фосфаты
Слайд 32Принцип Пригожина
производство энтропии dS/dt открытой системой, находящейся в стационарном состоянии,
стремится к минимуму.
Термодинамические особенности открытых систем для живого организма объясняют
его устойчивость, позволяющую ему в течение многих лет сохранять работоспособность, о также относительное постоянство внутренней среды – гомеостаз.
В основе гомеостаза организма находятся следующие химические и физико-химические балансы:
Кислотно-оснóвный
Окислительно-восстановительный
Металло-лигандный
Гидрофильно-липофильный
Водно-электролитный
Слайд 33Биоэнергетика
Человеческий организм – открытая, стационарная термодинамическая система.
Основной источник энергии для него – это химическая энергия, заключенная
в пищевых продуктах, которая расходуется на:совершение работы внутри организма, связанной с дыханием, кровообращением, перемещением метаболитов, секрецией соков ;
нагревание вдыхаемого воздуха, потребляемой воды и пищи;
покрытие потерь теплоты в окружающую среду при непосредственном излучении, испарении влаги с поверхности тела, с выдыхаемым воздухом и с продуктами жизнедеятельности;
совершение внешней работы, связанной со всеми перемещениями человека и его трудовой деятельностью.
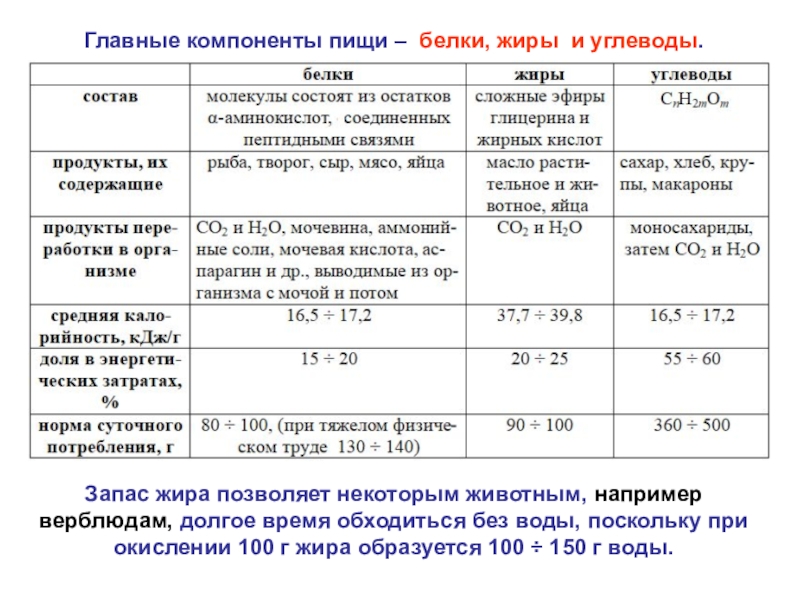
Слайд 34Главные компоненты пищи – белки, жиры и углеводы.
Запас жира
позволяет некоторым животным, например верблюдам, долгое время обходиться без воды,
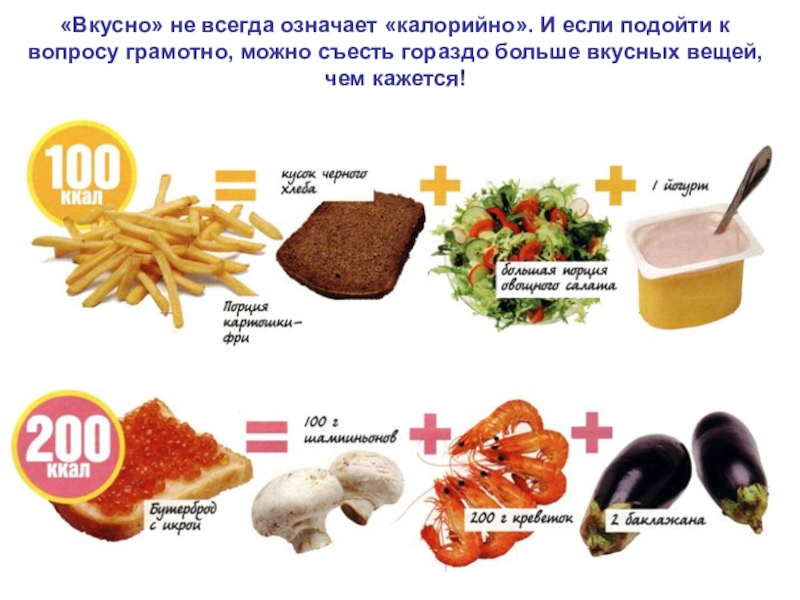
поскольку при окислении 100 г жира образуется 100 ÷ 150 г воды.Слайд 35«Вкусно» не всегда означает «калорийно». И если подойти к вопросу
грамотно, можно съесть гораздо больше вкусных вещей, чем кажется!
Слайд 37Аналогичный подход относится к витаминам
Без витамина Е
мы страдали бы от простуд, нам бы угрожали рак и
преждевременная старость. Мы даже не смогли бы прочесть эту информацию – помешала бы катаракта. Да и само наше появление на свет было бы под большим вопросом – витамин Е называют фактором размножения.Как получить суточную дозу витамина Е? – Выбирайте!
Именно витамин Е отвечает за прозрачность хрусталика
Слайд 38В основе научной диетологии лежит согласование режима питания (калорийности потребляемой
человеком пищи) с расходом энергии, который зависит в первую очередь
от характера выполняемой работы.Слайд 39Суточная потребность человека в энергии при:
1) легкой
работе в сидячем положении (офисные сотрудники, портные, мастера точной механики)
– 2000 ÷ 2800 ккал;2) умеренной и напряженной мышечной работе (лаборанты, врачи, почтальоны, столяры, токари, трактористы, учащиеся, студенты) – 3000 ÷ 3600 ккал;
3) тяжелом физическом труде (литейщики, каменщики, кузнецы, плотники, пахари) – 4000 ÷ 5000 ккал;
4) особо тяжелом труде (косари, спортсмены) – до 7200 ккал.
1 ккал = 4,19 кДж.