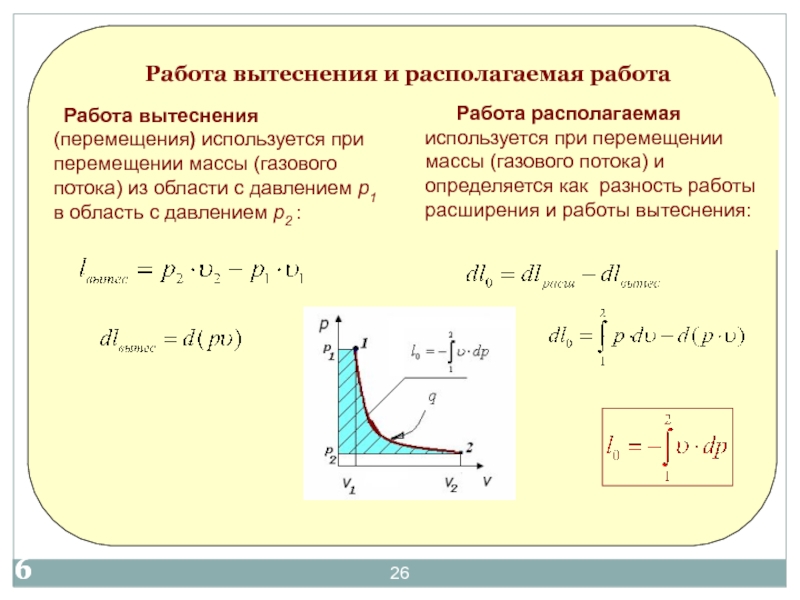
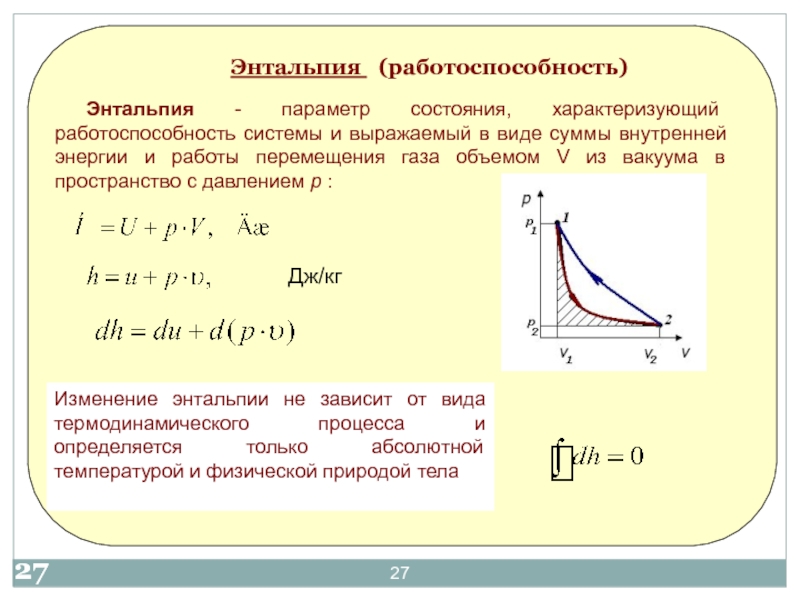
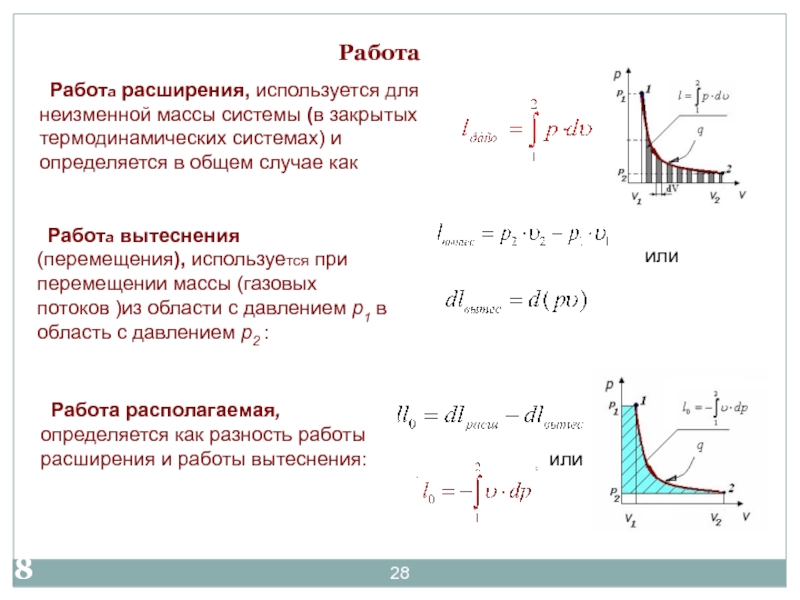
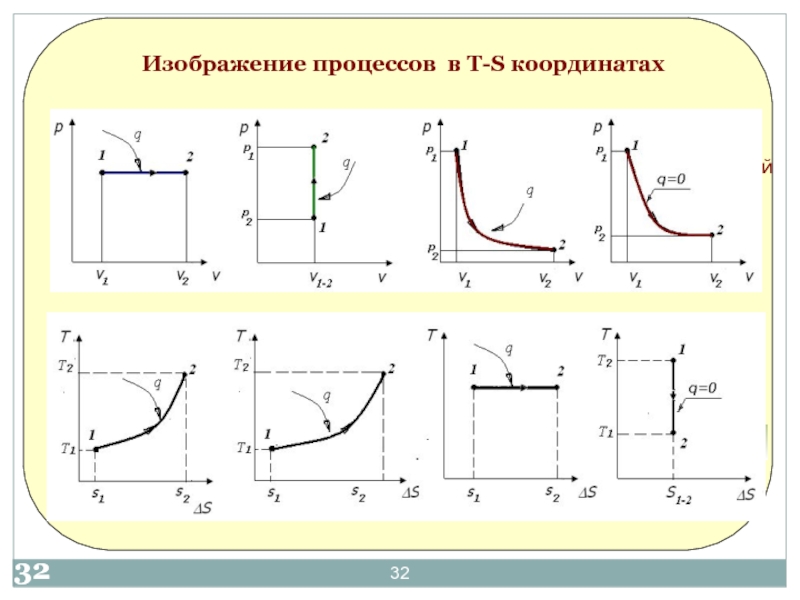
- 2017
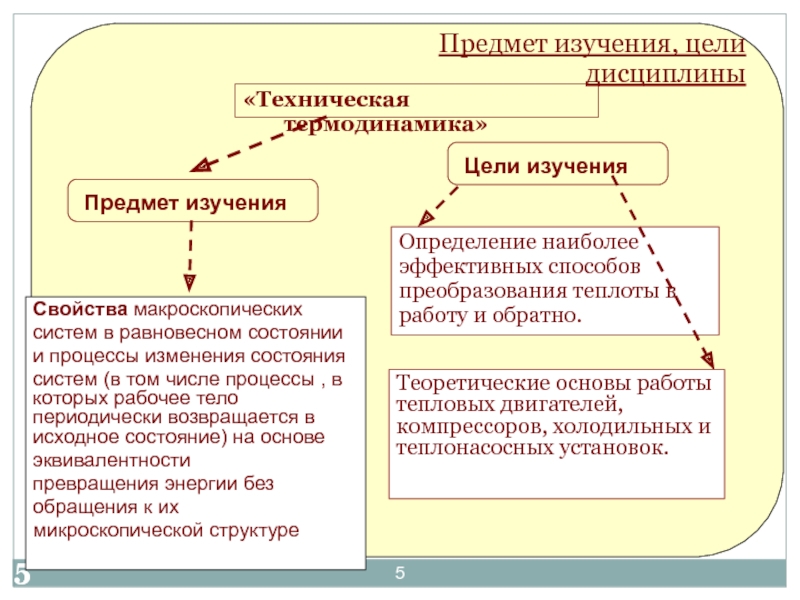
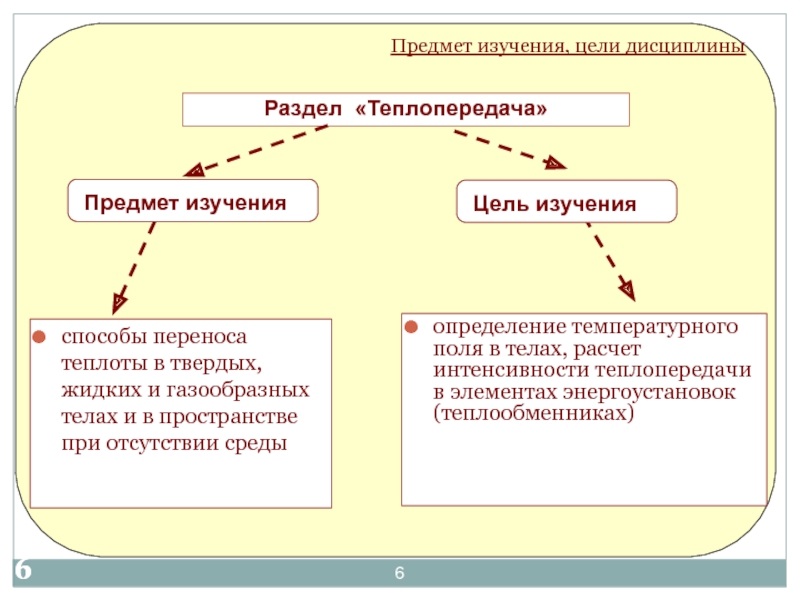
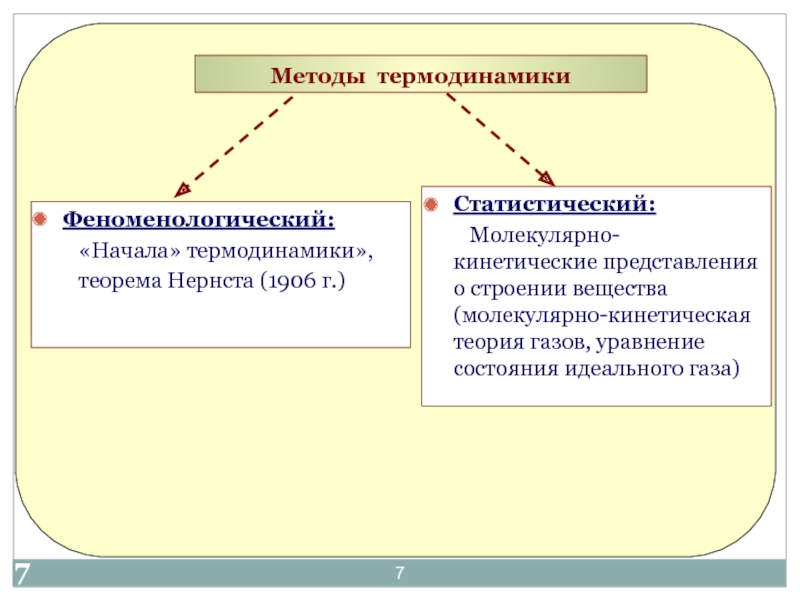
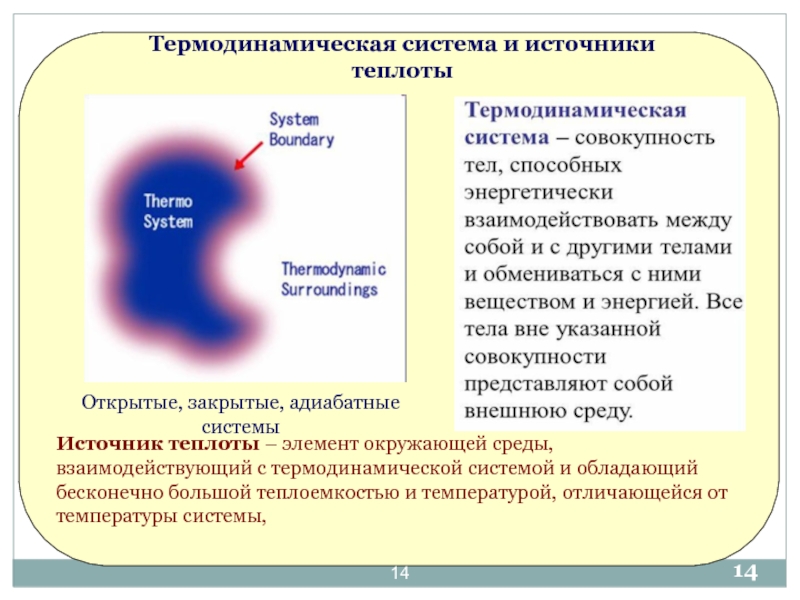
«Термодинамика и теплотехника»»
составлен
кандидатом технических наук, доцентом
Ивневым
Александром Андреевичем
Курс лекций
для
студентов 3 курса
заочной формы обучения Часть 1
Основы технической термодинамики