Слайд 11
Гомельский государственный медицинский университет
Кафедра биохимии
Слайд 208/12/2019
Коваль А. Н. (C), 2006
Содержание
Строение, размер и форма белковой молекулы,
функции белков.
Денатурация, причины и признаки, использование в медицине.
Ферменты. История энзимологии.
Доказательства
белковой природы ферментов.
Особенности ферментативного катализа.
Структурно-функциональная организация ферментов.
Аллостерические ферменты.
Слайд 308/12/2019
Коваль А. Н. (C), 2006
Пептиды и белки: общие сведения
Белки
При соединении
аминокислот в цепочку образуется линейная макромолекула белка.
В любом живом организме
содержатся тысячи белков, выполняющих разнообразные функции.
Слайд 408/12/2019
Коваль А. Н. (C), 2006
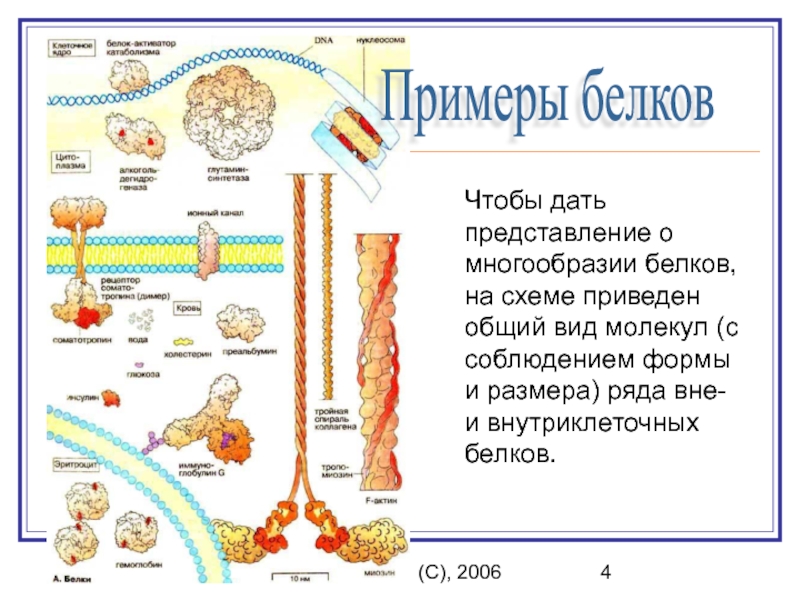
Примеры белков
Чтобы дать представление о многообразии
белков, на схеме приведен общий вид молекул (с соблюдением формы
и размера) ряда вне- и внутриклеточных белков.
Слайд 508/12/2019
Коваль А. Н. (C), 2006
Ферменты
Ферменты (от лат. fermentum - закваска),
или энзимы (от греч. en - внутри, zym - закваска)
– биокатализаторы белковой природы.
Используются живыми организмами для катализа многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение веществ и др.
Слайд 608/12/2019
Коваль А. Н. (C), 2006
Ферменты являются биокатализаторами
Ускоряют химические реакции
Составляют функциональный
аппарат клетки, являясь функциональными единицами клеточного метаболизма.
Слайд 708/12/2019
Коваль А. Н. (C), 2006
История энзимологии
На заре истории развития человечества,
уже использовались ряд технологических ферментативных процессов: хлебопечение, виноделие, обработка шкур
животных и т. д.
Описал пищеварения у животных Рене Антуан Реомюр (1683—1757).
Лаззаро Спалланцани (1729-1799), профессор истории естествознания в Университете города Падуя, не рассматривал пищеварение как процесс ферментации по той простой причине, что при этом не образовывались пузырьки газа.
Слайд 808/12/2019
Коваль А. Н. (C), 2006
История энзимологии (прод.)
Позже процесс ферментации был
более подробно изучен одним из основоположников современной химии Антуаном Лораном
Лавуазье (1743-1794).
Изучая спиртовое брожение, происходящее при изготовлении вина, он обнаружил, что глюкоза превращается в спирт и углекислый газ,
К началу XIX в. преобладала общая точка зрения, что ферментация - это химические изменения, вызываемые некоторыми специальными формами органического материала, а именно «ферментами».
Слайд 908/12/2019
Коваль А. Н. (C), 2006
История энзимологии (прод.)
В 1814 г. русский
ученый (немец по происхождению) академик Петербургской Академии наук Константин Готлиб
Сигизмунд Кирхгоф (1764-1833) показал, что образование сахара из крахмала в проросших зернах злаков обусловлено химическим процессом, а не появлением ростков.
В 1810 г Ю. Гей-Люссак выделил основные конечные продукты жизнедеятельности дрожжей – спирт и углекислый газ.
Я. Берцелиус, один из основоположников теории химического катализа и автор самого термина «катализ» в 1835 году подтверждает эти данные, отметив, что диастаза (экстракт из солода) катализирует гидролиз крахмала более эффективно, чем минеральная серная кислота.
Слайд 1008/12/2019
Коваль А. Н. (C), 2006
История энзимологии (прод.)
Либих и Вёлер открыли
эмульсин, расщепляющий амигдалин горького миндаля.
Опыты Л. Пастера с кипячеными экстрактами
дрожжей.
Слайд 1108/12/2019
Коваль А. Н. (C), 2006
История энзимологии.
Спор Либиха и Пастера
Важную
роль в развитии энзимологии сыграл спор Ю Либиха с известным
микробиологом Л. Пастером, который считал, что процессы ферментации могут происходить только в целой живой клетке.
Ю. Либих, напротив, считал, что биологические процессы вызываются действием химических веществ, которые в последствии были названы ферментами.
Термин энзим предложил 1878 г Фридрих Вильгельм Кюне, подчеркнув, что процесс идет в дрожжах.
Слайд 1208/12/2019
Коваль А. Н. (C), 2006
История энзимологии (прод.)
В 1878 г. Манассеина
получила бесклеточный препарат дрожжей, перетирая их в ступке со стеклянным
порошком. Этот экстракт был способен получать этанол, что утвердило мнение Либиха.
В 1897 году Э. Бюхнер повторил этот эксперимент, получив свободный от клеток экстракт из дрожжей, разрушая их вакуумированием.
Слайд 1308/12/2019
Коваль А. Н. (C), 2006
История энзимологии (прод.)
В 1894 году Э.
Фишер предложил модель взаимодействия фермента и субстрата, названной «ключ-замок».
В 1926
году Дж. Самнер после почти 9-летених исследований доказал белковую природу фермента уреазы.
Вскоре Дж Нортроп и М Кунитц указали на прямую корреляцию между активностью кристаллических пепсина, трипсина и количеством белка в исследуемых образцах, приведя тем самым весомые доказательства белковой природы ферментов.
1955 г. – С. Мур и У. Стейн расшифровали структуру рибонуклеазы (124 АК остатка).
Слайд 1408/12/2019
Коваль А. Н. (C), 2006
История энзимологии (прод.)
В 1963 году исследована
аминокислотная последовательность РНКазы из поджелудочной железы.
В 1965 г показана
пространственная структура лизоцима.
1969 г. – синтез рибонуклеазы в лаборатории Б. Меррифилда в Нью-Йорке.
За последующие годы очищены тысячи ферментов и получены новые данные о механизмах действия ферментов, их пространственной структуре, регуляции ферментативных реакций.
Обнаружена каталитическая активность у РНК (рибозимы).
Получены антитела с ферментативной активностью –абзимы.
Слайд 1508/12/2019
Коваль А. Н. (C), 2006
Доказательства белковой природы ферментов
Все ферменты действуют
в мягких условиях: const t°, const рН, const ионная сила,
оптимальное соотношение субстратов, продуктов, модуляторов.
Все ферменты являются высокомолекулярными соединениями (ВМС), с молекулярной массой от неск. тысяч до неск. миллионов дальтон (1 дальтон = массе одного атома водорода), в связи с чем, образуют коллоидные растворы, которые обладают буферными свойствами, вязкостью, дают опалесценцию, образуют конус Тиндаля.
Способны к денатурации под действием тех же факторов, которые вызывают денатурацию белка. При необратимой денатурации ферменты полностью инактивируются.
При гидролизе распадаются на аминокислоты.
Обладают «эффектом защиты» (связывают воду, ионы тяжелых металлов).
Слайд 1608/12/2019
Коваль А. Н. (C), 2006
Доказательства белковой природы ферментов (прод.)
Ферменты как
и белки обладают антигенной активностью и при парэнтеральном введении стимулируют
образование антител.
Обладают электрофоретической подвижностью и амфотерными свойствами.
Не способны к диализу через полупроницаемые мембраны.
Легко осаждаются из водных растворов методом высаливания.
Обладает высокой специфичностью действия.
Лабораторный синтез фермента рибонуклеазы, доказывает его белковую природу (в лаборатории Мерифилда в 1969 году).
Слайд 1708/12/2019
Коваль А. Н. (C), 2006
Особенности ферментативного катализа
Исключительно высокая эффективность.
Эффективность
биологического катализа превышает эффективность неорганического в 109 – 1012 раз.
Специфичность:
Абсолютная
специфичность, когда фермент работает только со своим субстратом (фумараза с транс-изомерами фумаровой кислоты и не будет с цис-изомерами);
Групповая - специфичен для узкой группы родственнных субстратов (ферменты ЖКТ).
Ферменты «работают» в мягких условиях (t=37°C, рН 7,0, определенные осмолярность и солевой состав).
Многоуровневая регуляция: регуляция активности на уровне условий среды, на уровне метаболона, на генетическом уровне, тканевом, клеточном, с помощью гормонов и медиаторов, а также с помощью субстратов и продуктов той реакции, которую они катализируют.
Слайд 1808/12/2019
Коваль А. Н. (C), 2006
Особенности ферментативного катализа (прод.)
Кооперативность: ферменты способны
организовывать ассоциации - продукт 1-го фермента, является субстратом для 2-го;
продукт 2-го - субстратом для 3-го и т.д.
Ферменты обладают адаптивностью, т. е. могут изменять свою активность и образовывать новые ассоциации.
Способны катализировать как прямую так и обратную реакцию. Направление реакции для многих ферментов определяется соотношением действующих масс.
Катализ жестко расписан, т. е. происходит поэтапно.
Если какое-либо соединение существует в форме цис- и трансизомеров, то для каждой из этих форм, существует свой фермент.
Например, фумараза катализирует превращение только фумаровой кислоты (транс-), но не действует на цис-изомер - малеиновую кислоту.
Слайд 1908/12/2019
Коваль А. Н. (C), 2006
Строение ферментов
Ферменты как и белки делятся
на две группы: простые и сложные.
Простые полностью и целиком состоят
из а/к и при гидролизе образуют исключительно а/к.
Сложные ферменты кроме белковой части (апофермента) содержат и небелковый компонент (кофактор).
Кофакторы различаются по прочности связывания с апоферментом.
Слайд 2008/12/2019
Коваль А. Н. (C), 2006
Кофакторы
Если константа диссоциации сложного фермента настолько
мала, что в растворе все ПП цепи оказываются связанными со
своими небелковыми компонентами и не разделяются при выделении и очистке, то небелковый компонент называется простетической группой и рассматривается как интегральная часть молекулы фермента.
Под коферментом понимают дополнительную группу, легко отделяемую от апофермента, при диссоциации.
Слайд 2108/12/2019
Коваль А. Н. (C), 2006
Примеры коферментов
Между апоферментом и коферментом существуют
нековалентные связи (водородные или электростатического взаимодействия).
Типичными представителями коферментов являются:
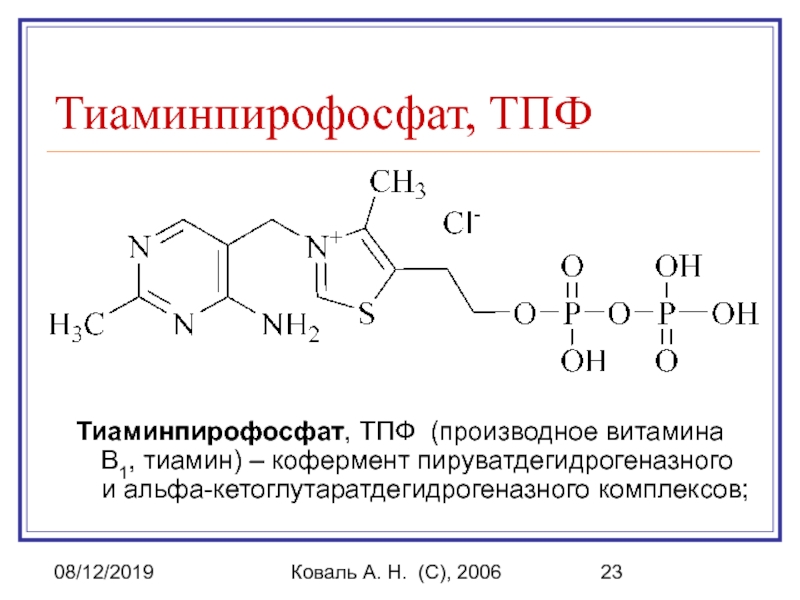
Тиаминпирофосфат, ТПФ (производное витамина В1, тиамин) – кофермент пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов;
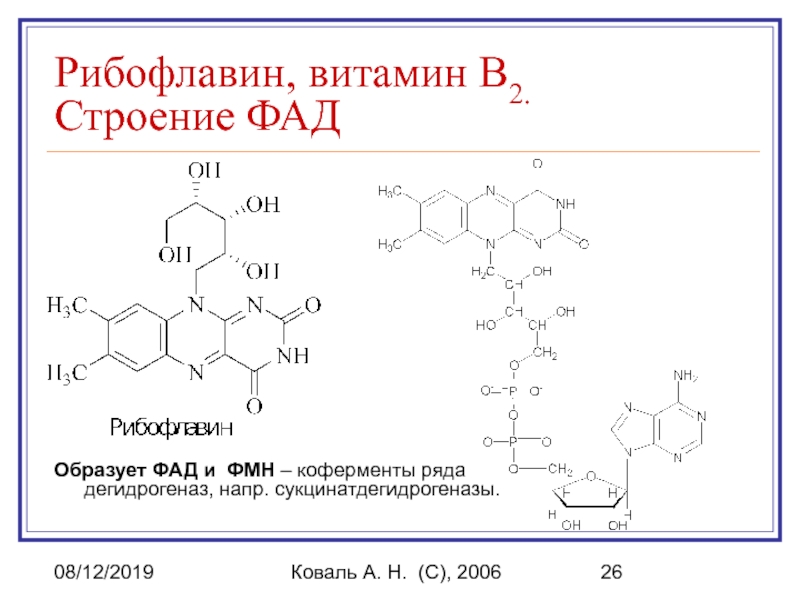
ФАД, ФМН (производные витамина В2, рибофлавин) – коферменты ряда дегидрогеназ, напр. сукцинатдегидрогеназы;
НАД, НАДФ (производные витамина РР, ниацин) коферменты ряда дегидрогеназ, напр. лактатдегидрогеназы;
Пиридоксальфосфат (производное витамина В6, пиридоксин) – кофермент трансаминаз, напр. аспартатаминотрансфераза (АсАТ), аланинаминотрансфераза (АлАТ);
коэнзим А (производное пантотеновой кислоты) – кофермент ацилирования.
Слайд 2208/12/2019
Коваль А. Н. (C), 2006
Простетическая группа
Примером простетической группы является витамин
Н (биотин)
биотин связан с апоферментом ковалентно через остаток лизина.
Является кофактором ферментов осуществляющих карбоксилирование, напр. пируваткарбоксилаза.
Слайд 2308/12/2019
Коваль А. Н. (C), 2006
Тиаминпирофосфат, ТПФ
Тиаминпирофосфат, ТПФ (производное витамина В1,
тиамин) – кофермент пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов;
Слайд 2408/12/2019
Коваль А. Н. (C), 2006
Витамин PP
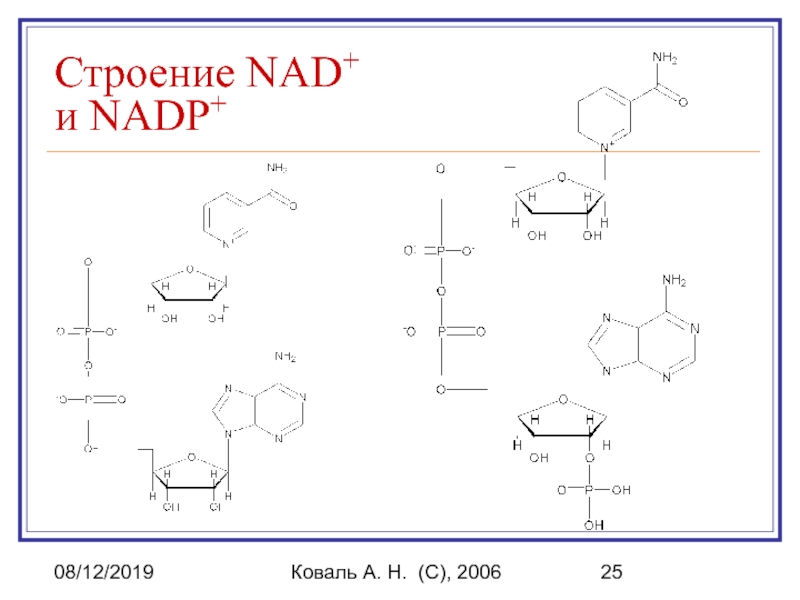
Витамин PP (никотиновая кислота, ниацин)
в форме никотинамида входит в состав NAD+ и NADP+, которые
являются коферментами NAD(P)-зависимых (пиридиновых) дегидрогеназ.
Слайд 2508/12/2019
Коваль А. Н. (C), 2006
Строение NAD+ и NADP+
Слайд 2608/12/2019
Коваль А. Н. (C), 2006
Рибофлавин, витамин B2.
Строение ФАД
Образует ФАД
и ФМН – коферменты ряда дегидрогеназ, напр. сукцинатдегидрогеназы.
Слайд 2708/12/2019
Коваль А. Н. (C), 2006
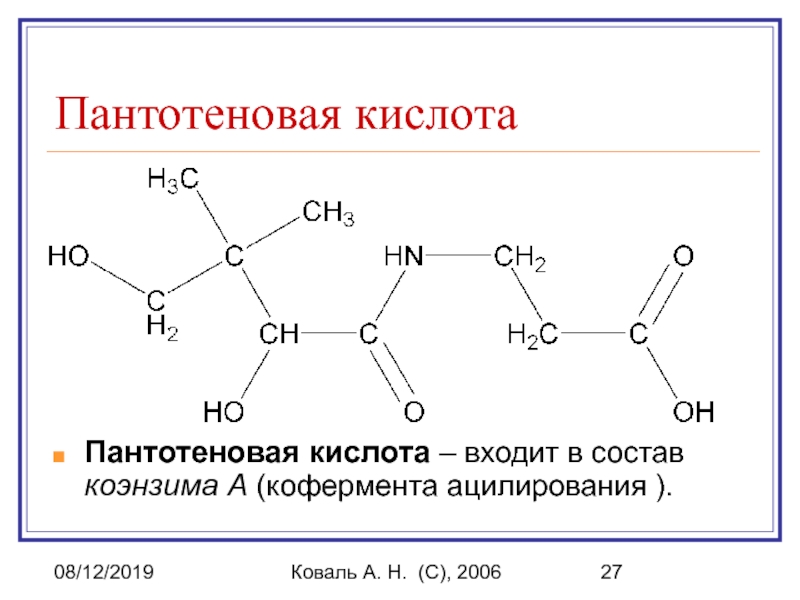
Пантотеновая кислота
Пантотеновая кислота – входит в
состав коэнзима А (кофермента ацилирования ).
Слайд 2808/12/2019
Коваль А. Н. (C), 2006
Металлы как кофакторы
Многие двухвалентные металлы (Сu2+,
Zn2+, Fe2+, Fe3+, Mn2+, Мg2+, Ca2+) тоже выполняют роль кофакторов,
хотя и не относятся ни к простетическим группам, ни к коферментам.
Металлы входят в состав активного центра или стабилизируют оптимальный вариант структуры активного центра фермента.
Слайд 2908/12/2019
Коваль А. Н. (C), 2006
Металлы как кофакторы (прод.)
Слайд 3008/12/2019
Коваль А. Н. (C), 2006
Структурно-функциональная организация ферментов.
Активный центр
Активный (субстратный)
центр - это совокупность функциональных групп, расположенных в разных участках
ПП цепи, но близко структурно и функционально ориентированных (в третичной структуре) и имеющих прямое отношение к катализу.
Этот центр состоит из функциональных групп и радикалов: SH-(цистеина); -ОН(серина); COOH-(АСП); имидазольного кольца гистидина.
Слайд 3108/12/2019
Коваль А. Н. (C), 2006
Структурно-функциональная организация ферментов. Строение активного центра
фермента
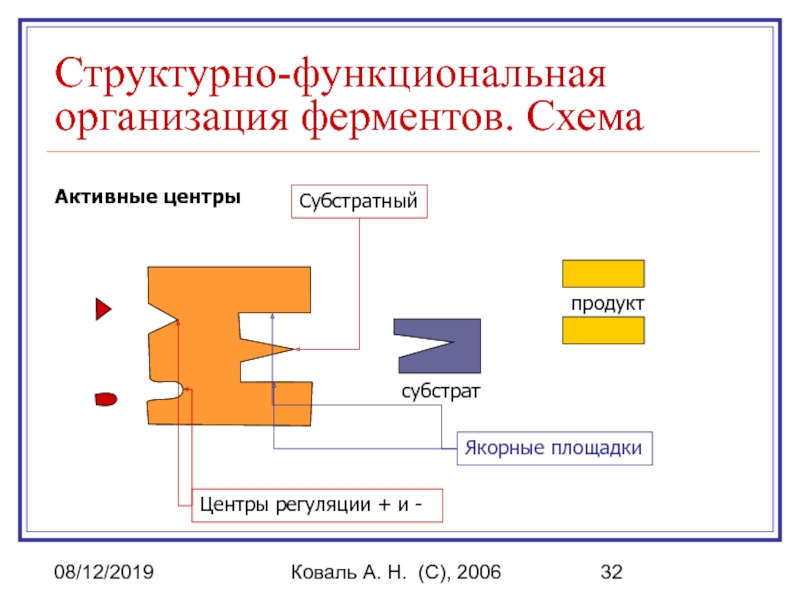
Активный центр включает в себя:
Каталитический участок или центр, непосредственно взаимодействующий
с субстратом, осуществляющий катализ.
Контактная, или якорная площадка - она обеспечивает специфическое сродство фермента к субстрату и является местом фиксации субстрата на поверхности фермента.
Вспомогательные участки - карманы, щели и др.
Слайд 3208/12/2019
Коваль А. Н. (C), 2006
Структурно-функциональная организация ферментов. Схема
Активные центры
Якорные площадки
Субстратный
субстрат
продукт
Центры
регуляции + и -
Слайд 3308/12/2019
Коваль А. Н. (C), 2006
Формирование активного центра фермента
Предполагается, что формирование
активного центра фермента начинается уже на ранних этапах синтеза белка-фермента
на рибосоме, когда линейная одномерная структура ПП цепи превращается в трехмерное тело строго определенной конфигурации, точнее активный центр формируется из функциональных групп различных аминокислот (т.е. активный центр определяется первичной структурой).
Слайд 3408/12/2019
Коваль А. Н. (C), 2006
Центры аллостерической регуляции
У олигомерных ферментов (имеющих
четвертичную структуру) имеются центры аллостерической регуляции.
это участки связывания фермента
с низкомолекулярным веществом (эффектором или модификатором), имеющим другую, чем субстрат или продукт, структуру: АТФ, АДФ, НАД+, промежуточные метаболиты.
Слайд 3508/12/2019
Коваль А. Н. (C), 2006
Аллостерические ферменты
Присоединение эффектора к аллостерическому центру
приводит к изменению третичной структуры и, соответственно, конфигурации активного центра,
вызывая снижение или повышение эниматической активности.
В связи с этим существует и два пространственно удаленных аллостерических центра: активации и ингибирования.
Ферменты, активность которых контролируется состоянием как активного, так и аллостерического центров, называются аллостерическими ферментами.
Слайд 3608/12/2019
Коваль А. Н. (C), 2006
Спасибо за внимание!
Следующая лекция – Биохимия
ферментов-2.
Механизм действия ферментов. Этапы ферментативного катализа.
Факторы, определяющие активность ферментов [E],
[S], [P], Km. Влияние pH, [P], tº, ионной силы на активность ферментов.
Регуляция активности ферментов.
Слайд 3708/12/2019
Коваль А. Н. (C), 2006
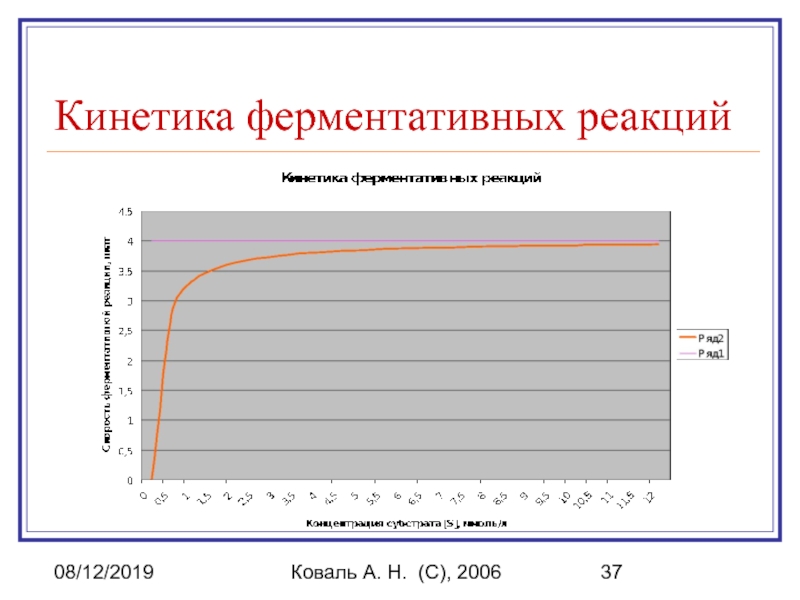
Кинетика ферментативных реакций