Слайд 1Химическая кинетика
Скорость химической реакции равна изменению количества реагирующего вещества в
единицу времени в единице реакционного пространства.
Гомогенная реакция – это реакция,
протекающая в одной среде (в одной фазе). Реакционное пространство – объём системы.
Гетерогенная реакция – протекает на границе раздела фаз (твердой и жидкой, твердой и газообразной и т.д.).
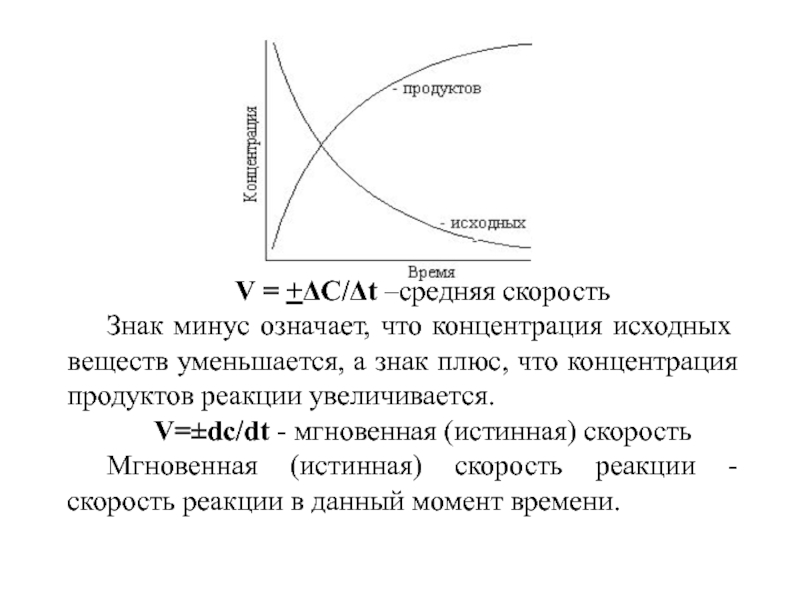
Слайд 2V = +ΔC/Δt –средняя скорость
Знак минус означает, что концентрация исходных
веществ уменьшается, а знак плюс, что концентрация продуктов реакции увеличивается.
V=±dc/dt - мгновенная (истинная) скорость
Мгновенная (истинная) скорость реакции - скорость реакции в данный момент времени.
Слайд 3Молекулярность реакции - число молекул (атомов или ионов) реагента одновременно
участвующих в одном элементарном акте реакции.
Для молекулярной реакции скорость
реакции прямо пропорциональна молярной концентрации вещества.
Для реакции разложения N2О5 скорость равна: V=k*СN2О5.
Слайд 4Для необратимой реакции bB + dD = lL + mM
V
= k*CBnb*CDnd
k–константа скорости,
nb и nd– коэффициенты, называемые порядком реакции по
веществам B и D.
Это уравнение - кинетическое уравнение химической реакции.
Сумма порядков реакции по реагентам называется общим порядком реакции n=nb+nd.
Физический смысл константы скорости реакции: она числено равна скорости реакции при единичных концентрациях реагирующих веществ.
Константа скорости не зависит от концентрации реагентов, но зависит от их природы и температуры.
Слайд 5Если реакция bB + dD = lL + mM протекает
в одну стадию, то nb =b и nd = d.
Тогда кинетическое уравнение имеет вид
V = k*СBb*CDd.
Это уравнение является математическим выражением закона действующих масс.
Закон действующих масс:
Скорость реакции прямо пропорциональна произведению концентраций реагентов, возведенных в степени, равные коэффициентам в уравнении лимитирующей стадии, сумма которых равна порядку реакции.
Слайд 6Реакции первого порядка
Кинетическое уравнение имеет вид: V = k*С.
Приравняв
V=-dс/dt к V = k*С, получаем dс/с=-k*dt.
Отсюда k=ln(с0/с)/t, т.к.
ln(с0/с) безразмерен, то единицы измерения k [с-1].
Период полупревращения t ½ не зависит от концентрации и является эквивалентом константы скорости.
t ½=ln2/k = 0693/k.
Слайд 7Реакции второго порядка
Кинетическое уравнение V=k*СВ*СD.
Если СВ=СD или реагируют одинаковые частицы,
то V=kc2.
dc/с2=-k*dt
Единицы измерения константы скорости [моль*л –1*с –1].
Период полупревращения
зависит от концентрации. t ½=1/kc0.
Слайд 8Зависимость скорости реакции от времени
Слайд 9Гетерогенные реакции
Скорость реакции зависит от площади реакционной поверхности (S): V
= k*C*S.
Концентрация твердого вещества не входит в кинетическое уравнение. Её
принимают постоянной и равной 1.
СаО+СО2 →СаСО3 V=kCСО2S.
Удельная скорость реакции – скорость, отнесенная к единице реакционной поверхности: VS = V/S = kC (моль/сек*м2).
Слайд 10Скорость гетерогенной химической реакции зависит от скорости подвода реагентов в
зону химической реакции.
Скорость диффузии в этом слое VД в
наиболее простом виде описывается уравнением:
VД = D(CV – CS)S/δ
D – коэффициент диффузии, м2/сек,
D – зависит от вязкости реакционной среды, т.е. от природы растворителя и реагентов, а также от температуры.
- толщина диффузионного слоя.
δ уменьшается при перемешивании, соответственно, перемешивание увеличивает скорость подвода реагентов.
Слайд 11VД>>V - реагенты без проблем подаются в реакционное пространство -
кинетический контроль реакции.
VД=V - смешанный контроль.
VД
реакции. Наблюдается нулевой порядок реакции. В координатах V-C скорость не зависит от концентрации, а зависит от скорости диффузии, величины поверхности и температуры.
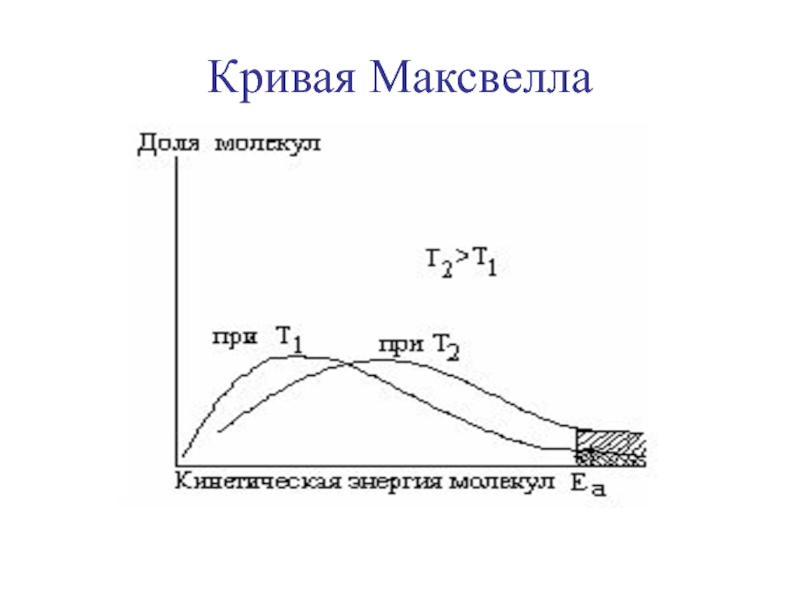
Слайд 12Зависимость константы скорости реакции от температуры
Правило Вант-Гоффа:
V2=V1γΔT/10
скорость реакции ускоряется в 2-4 раза при
повышении температуры на 100С (γ = 2-4).
γэндотерм.> γэкзотерм.
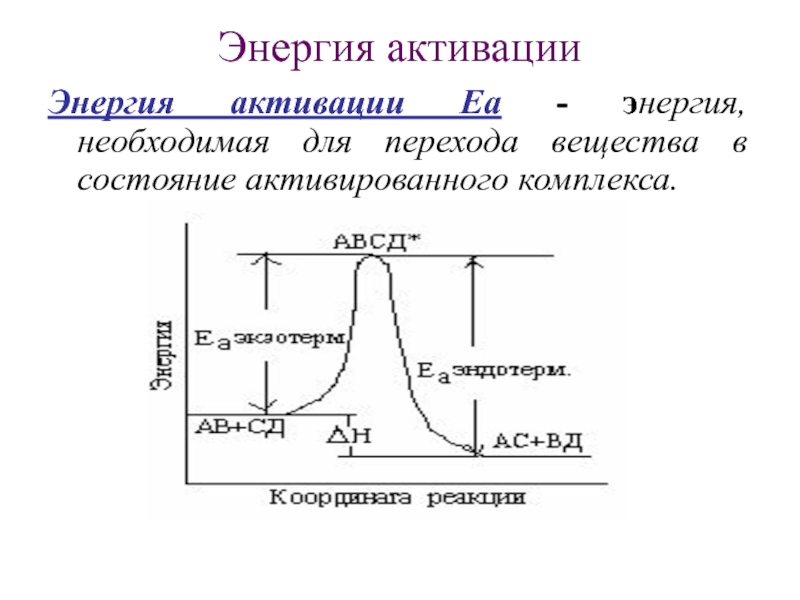
А⎯В А…….В А В
+ → : : → ⏐ + ⏐
Д⎯С Д……С Д С
Исходные Активированный Продукты
соединения комплекс реакции
Активированным комплексом подразумевается промежуточное соединение молекул, атомов, ионов реагентов, находящихся в возбужденном состоянии и, поэтому являющийся неустойчивым.
Слайд 13Энергия активации
Энергия активации Еа - энергия, необходимая для перехода вещества
в состояние активированного комплекса.
Слайд 15Уравнение Аррениуса :
экспоненциальная и
логарифмическая
k =
A*e‑Ea/RT lnk = - Ea/RT + lnA
При двух температурах:
lnk1 = - Ea/RT1+lnA ln k2 = - Ea/RT2+lnA
ln (k2/k1) = Ea/R(1/T2-1/Т1)
γ = k2/k1 при ΔТ = 10 К
Для γ = 2-4 при >300 К Еа = 57-114 кДж/моль.
Это соответствует значениям для большинства реакций.
При температурах 500 К таким значениям γ соответствуют Еа=236-472 кДж/моль, при таких энергиях активации реакции не протекают.
Уравнение Вант-Гоффа – приблизительное, справедливо при температурах близких к комнатным,
Уравнение Аррениуса справедливо во всем диапазоне температур.
Слайд 16Физический смысл предэкспоненциального множителя: Величина А соответствует такой (максимальной) скорости
реакции, когда Еа равна нулю, то есть в каждом столкновении
энергия сталкивающихся молекул достаточна, чтобы прошла реакция.
А=P*Z
Z–число столкновений частиц,
Р – стерический фактор реакции, связанный с энтропией активации.
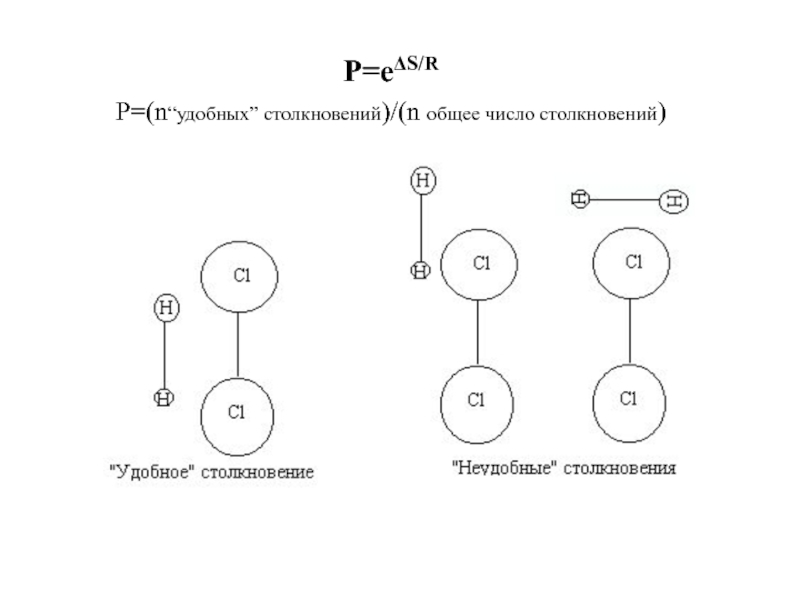
Слайд 17P=eΔS/R
Р=(n“удобных” столкновений)/(n общее число столкновений)
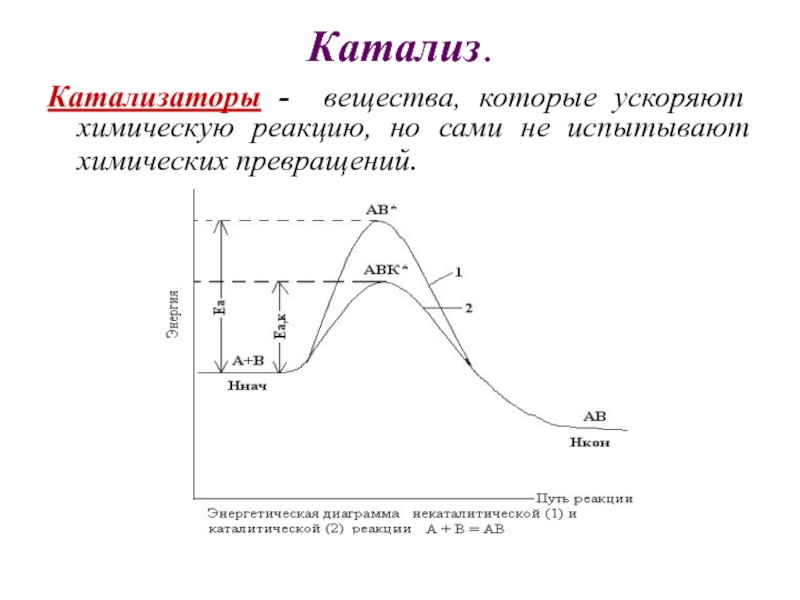
Слайд 18Катализ.
Катализаторы - вещества, которые ускоряют химическую реакцию, но сами
не испытывают химических превращений.
Слайд 19Виды катализа
Гомогенный – катализатор находится в системе в том же
фазовом состоянии, что и реагенты.
Механизм катализа: катализатор образует с
реагентами промежуточное соединение, разложение которого является лимитирующей стадией.
Разложение перекиси водорода, катализируемая солями йода:
H2O2(ж) +I- → H2O(ж) +IO-
IO- + H2O2(ж) → H2O(ж) + O2 +I-
Слайд 20Гетерогенный – катализатор и реагенты находятся в разных фазах и
имеют границу раздела.
Механизм:
Kat Kat
Адсорбция С2Н4 = С2Н4адс. и Н2 = 2Надс.
Десорбция С2Н4адс. + 2Надс. = С2Н6.
Высокая эффективность, селективность, технологичен: можно легко менять, регенерировать катализаторы .
Слайд 21Ферментативный катализ.
Наиболее эффективный вид катализа. Ферменты подходят к перерабатываемым
молекулам, как ключ к замку – точно по форме вырезов.
Ферментативный катализ протекает без нагревания при температурах 36-370С, быстро и селективно.
Энергии активации ферментативных реакций близки к нулю.
Слайд 22Катализ резко ускоряет реакции.
Реакция разложения 2HI→H2+I2 имеет следующие скорости:
Некатализируемая:
Еа = 168 кДж/моль Vотносит. =
1
Катализатор – золото Еа = 105 кДж/моль Vотносит. = 3*105
Катализатор - платина Еа = 59 кДж/моль Vотносит. = 1*1011
Промоторы катализа - вещества, которые сами не являются катализаторами, но добавление к их в реакционную катализируемую систему резко повышает скорость реакций.
Скорость окисления 2SO2 + O2 → 2SO3 на оксиде ванадия V2O5 возрастает в сотни раз при добавлении к катализатору Na2SO4, K2SO4, которые сами катализаторами не являются.
Существуют каталитические яды. Так, соединения мышьяка, сурьмы, серы отравляют катализаторы гидрирования (Pt, Pd).
Слайд 23Классификация химических реакций
Простые - протекают в одну стадию и
называются одностадийными.
Порядок реакции совпадает с молекулярностью, а кинетическое уравнение
с законом действующих масс.
Сложные – идут либо последовательно (многостадийные), либо параллельно, либо последовательно параллельно.
Состоят из ряда простых элементарных стадий, которые протекают по одно-, двух-, или трех молекулярному механизму. Поэтому реакции могут иметь разную молекулярность.
Слайд 24Цепные реакции
Их скорость зависит от формы, материала и объёма
сосуда, при определенных условиях реакция ускоряется лавинообразно
Механизм реакции
Зарождение цепи (инициирование)
- образование свободных радикалов. Инициирование бывает фотохимическим, термическим или химическим, с помощью химических веществ – инициаторов.
Cl2 + hν → Cl* + Cl*
Развитие цепи H2 + Cl* → HCl + H*; H* + Cl2 → HCl + Cl*
Обрыв цепи (рекомбинацией радикалов) - взаимодействие радикалов со стенками сосудов или инертными молекулами с образованием нейтральных молекул.
Cl* + Cl* → Cl2; H* + Cl* → HCl
Слайд 25Фотохимические реакции
Протекают под действием квантов света.
Первый закон фотохимии:
фотохимически
активным является лишь поглощенный свет.
Второй закон фотохимии: каждый поглощенный
фотон вызывает первичное фотохимическое изменение лишь одной молекулы.
Число молекул, прореагировавших при поглощении одного кванта света, называется квантовым выходом.
Слайд 26Использование фотохимических реакций
1) фотосинтез:
6СО2+6Н2О+hν→C6H12O6+6O2 ΔH0298= 2815
кДж
2) фотографирование: 2AgBr +2hν→ 2Ag + Br2
3) фотохимических реакций
в верхних слоях атмосферы - реакции синтеза и расходования озона:
O2 + hν →2O λ = 241нм мягкое УФ-излучение
О+О2→О3* О3*+О2→О3+О2* или О3*+N2→О3+N2* Образование озонового слоя
O3+hν →O2+О λ= 80-240 нм жесткое УФ-излучение
Слайд 27Разрушение озонового слоя
Происходит при попадания в атмосферу фреонов – хлорфторметанов,
используемых как теплоносители в бытовых и промышленных холодильниках.
CCl2F2 +hν → CClF2* + Cl*
Cl* + O3 → ClO* + O2
ClO* + O → Cl* + O2
Элементарный хлор, получаемый при фотодиссоциации фреонов выступает как катализатор разрушения озона.