Слайд 1Компьютерное моделирование процессов нанотехнологий.
Российский химико-технологический университет им. Д.И. Менделеева
Кафедра
квантовой химии
Москва 2007 г.
Лекция 8. Химическая связь и межмолекулярное взаимодействие.
Деформационная
электронная плотность
Цирельсон В.Г. «Химическая связь и межмолекулярное взаимодействие».
Слайд 2 Химическая связь и межмолекулярное взаимодействие
Деформационная электронная плотность
При сближении
атомов проявляются след. взаимодействия:
- Каждый атом ориентируется таким
образом, что действующая на него электростатическая сила, оказывается направленной в сторону соседних атомов, создающих электрическое поле.
Причины:
электростатическое взаимодействие сферических атомов,
поляризационное и
дисперсионное взаимодействия.
Последние два эффекта вызывают также
гибридизацию орбиталей и
промотирование атома в некоторое валентное состояние.
При сближении атомов на расстояние менее 7Å, начинают проявляться квантово-механические эффекты:
интерференция волновых функций,
делокализация электронов по всей молекуле и
обмен.
Слайд 3 Деформационная электронная плотность δρ(r) позволяет представить, как изменилось
электронное распределение при образовании молекулы из атомов.
δρ(r)=ρмол(r) - ∑FρA
(r),
ρмол - ЭП молекулы, ∑AρA = ρпром - сумма ЭП свободных атомов ( промолекула): ядра в промолекуле расположены там же, где и ядра в реальной молекуле).
Единственного определения промолекулы нет. Простейший способ ее выбора - ρпром есть совокупность атомов со сферически усредненными ЭП. В этом случае δρ называется стандартной деформационной ЭП.
Независимо от определения, промолекула является лишь удобным вспомогательным модельным понятием: ее нельзя описать детерминантом из атомных волновых функций, для нее также несправедливы теоремы вириала и Гельмана-Фейнмана, а также принцип Паули и т. д.
Какая химическая информация содержится в деформационной электронной плотности?
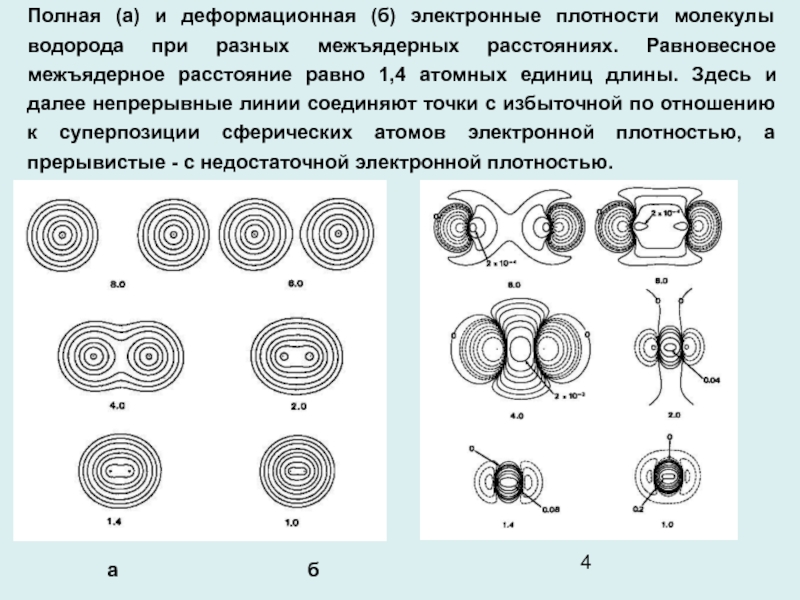
Слайд 4Полная (а) и деформационная (б) электронные плотности молекулы водорода при
разных межъядерных расстояниях. Равновесное межъядерное расстояние равно 1,4 атомных единиц
длины. Здесь и далее непрерывные линии соединяют точки с избыточной по отношению к суперпозиции сферических атомов электронной плотностью, а прерывистые - с недостаточной электронной плотностью.
а б
Слайд 5 Атомы входят в промолекулу как свободные и, в
принципе, каждый из них должен находиться в низшем энергетическом (основном)
состоянии.
Электронная волновая функция такого атома может быть: 1) 1) пространственно невырожденной - можно указать, какие АО заселены электронами (атомы H, Li, N, …)
2) n-кратно пространственно вырожденной, если пренебречь спин-орбитальным взаимодействием. Вырождение имеет место в атомах, имеющих частично заполненную электронами р-подоболочку (атомы B, С, O, F; n=3). ЭП этих атомов в основном состоянии несферично, однако экспериментально определить, какие именно р-орбитали заняты электронами, невозможно. Поэтому состояние таких атомов есть линейная комбинация «чистых» основных состояний с одинаковой энергией, но с различным размещением электронов на вырожденных АО. ЭП таких атомов в промолекуле следует рассматривать как статистическое среднее ЭП «чистых» состояний.
Слайд 6Пример. Свободный атом С имеет три электронные конфигурации с одинаковой
энергией: (ls)2(2s)2(2рx)1(2рy)1(2рz)0, (ls)2(2s)2(2рx)0(2рy)1(2рz)1 и (ls)2(2s)2(2рx)1(2рy)0(2рz)1.
Усредненная электронная конфигурация атома углерода следующая: (ls)2(2s)2(2рx)2/3(2рy)2/3(2рz)2/3.
Заселенности АО в «усредненном» атоме могут быть нецелочисленными!
Для стандартной деформационной плотности снимается вопрос выбора ориентации АО для атомов в том или ином валентном состоянии.
Важно: классическая электростатическая энергия взаимодействия сферических атомов (кроме атомов Н) отрицательна; таким образом, силы, действующие на ядра в промолекуле, связывающие и промолекула всегда стабильна относительно атомов, удаленных на бесконечность.
Стандартная деформационная ЭП характеризует полное (внутри- и межатомное) перераспределение электронов.
Слайд 7 Величины положительных максимумов и отрицательных минимумов в областях
σ- и π-связей на стандартных картах деформационной ЭП зависят от
соотношения величин эффектов перекрывания атомных (сферических) электронных облаков и квантово-механических эффектов интерференции волновых функций, электронной делокализации и обмена.
Важное влияние на характер распределения ЭП оказывают также узлы волновых функций. По мере увеличения главного квантового числа (и, следовательно - числа узлов) у σ-орбиталей требование ортогональности перекрывающихся волновых функций в совокупности с принципом Паули снижает величину σ-плотности электронов в межъядерном пространстве.
В то же время, возрастает роль ЭП, связанной с π-, δ- и т. д. орбиталями, которые создают стабилизирующее электрическое поле на ядрах. Из-за этого ковалентная связь с участием атомов С, N, О, F более прочна, чем с участием атомов Si, P, S, Cl.
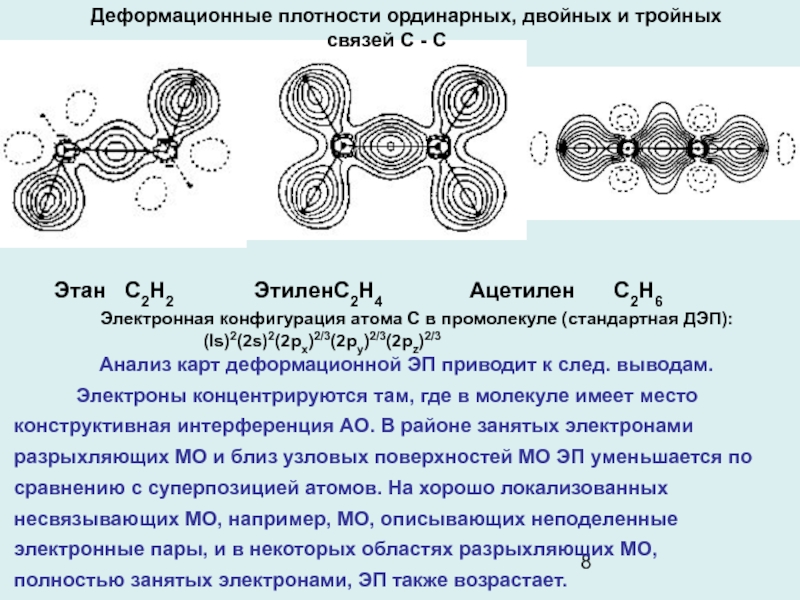
Слайд 8Деформационные плотности ординарных, двойных и тройных связей C - C
Этан
С2Н2 Этилен С2Н4 Ацетилен С2Н6
Электронная
конфигурация атома С в промолекуле (стандартная ДЭП): (ls)2(2s)2(2рx)2/3(2рy)2/3(2рz)2/3
Анализ карт деформационной ЭП приводит к след. выводам.
Электроны концентрируются там, где в молекуле имеет место конструктивная интерференция АО. В районе занятых электронами разрыхляющих МО и близ узловых поверхностей МО ЭП уменьшается по сравнению с суперпозицией атомов. На хорошо локализованных несвязывающих МО, например, МО, описывающих неподеленные электронные пары, и в некоторых областях разрыхляющих МО, полностью занятых электронами, ЭП также возрастает.
Слайд 9При взаимодействии атомов разного сорта ЭП смещается к более электроотрицательному
атому (полярная ковалентная связь).
Стандартная деформационная электронная плотность в тройных связях:
пики электронной плотности удлинены направлении, перпендикулярном линии связи. Позади положений ядер видны пики, отвечающие неподеленным электронным парам.
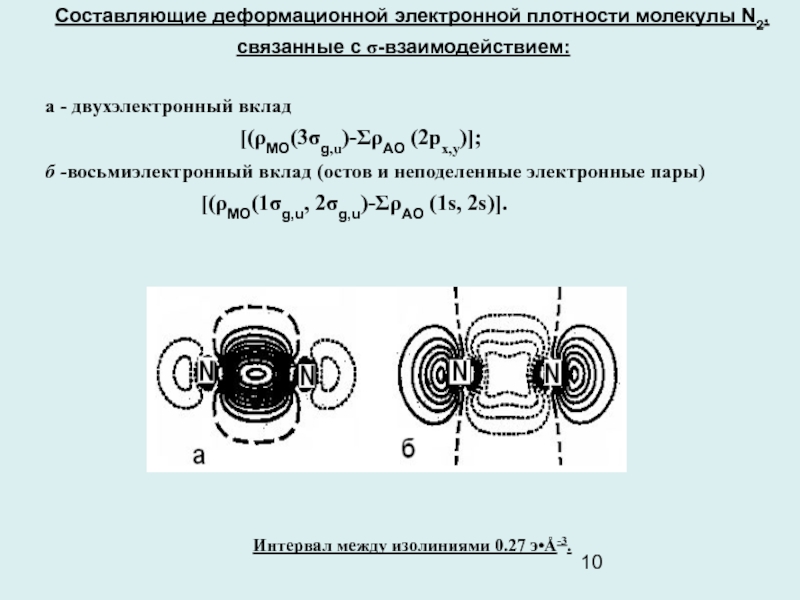
Слайд 10Составляющие деформационной электронной плотности молекулы N2, связанные с σ-взаимодействием:
а -
двухэлектронный вклад
[(ρМО(3σg,u)-ΣρАО (2px,y)];
б -восьмиэлектронный вклад (остов и неподеленные электронные пары)
[(ρМО(1σg,u, 2σg,u)-ΣρАО (1s, 2s)].
Интервал между изолиниями 0.27 э•Å-3.
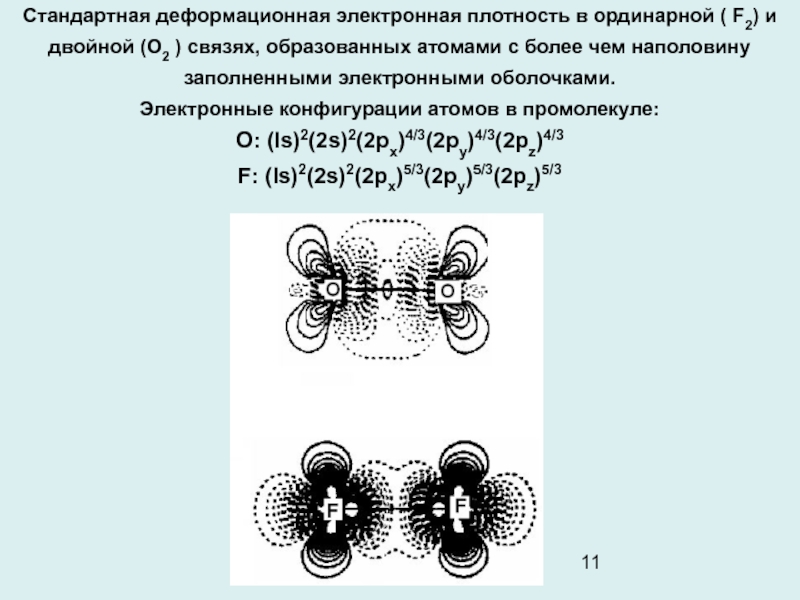
Слайд 11Стандартная деформационная электронная плотность в ординарной ( F2) и двойной
(O2 ) связях, образованных атомами с более чем наполовину заполненными
электронными оболочками.
Электронные конфигурации атомов в промолекуле:
О: (ls)2(2s)2(2рx)4/3(2рy)4/3(2рz)4/3
F: (ls)2(2s)2(2рx)5/3(2рy)5/3(2рz)5/3
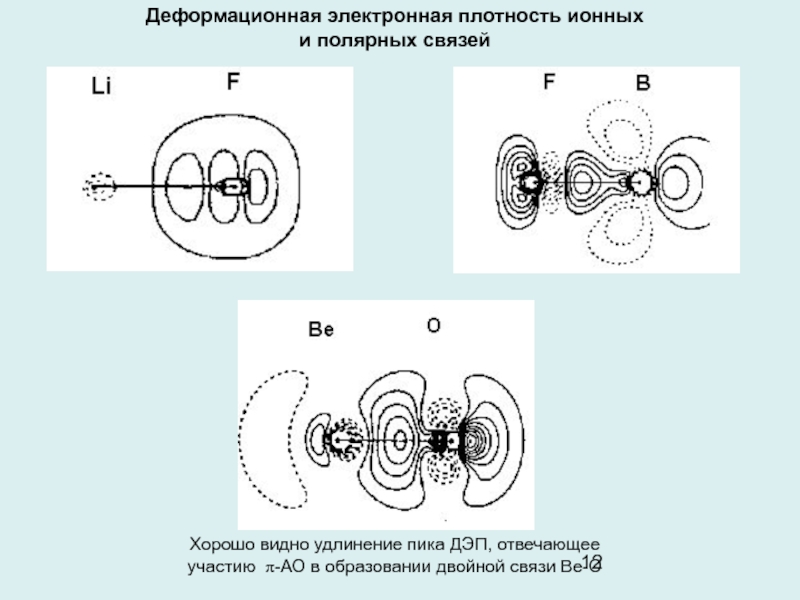
Слайд 12Деформационная электронная плотность ионных
и полярных связей
Хорошо видно удлинение пика ДЭП,
отвечающее
участию π-АО в образовании двойной связи Ве-О
Слайд 13Силовой и энергетический аспекты описания
химической связи
Гамильтониан молекулы
Н состоит из членов, описывающих кинетические Т и потенциальные энергии
V электронов и ядер. Два подхода к описанию взаимодействий в молекулах –силовой или электростатический (binding) и энергетический (bonding).
Электростатический подход - объяснение химической связи через кулоновские силы, действующие в молекулах (межэлектронные взаимодействия удовлетворяют принципу Паули!).
Энергетический подход - объяснение природы химической связи через анализ изменений кинетической и потенциальной энергий. Оба подхода являются взаимодополняющими и опираются на две важные теоремы.
1) Теорема Гельмана-Фейнмана: для точной и хартри-фоковской волновой функции справедливо соотношение
Е- энергия, λ - параметр, от которого зависит Е.
Слайд 14 Если λ=Rа - ядерные координаты [V=V(Rа)], то для
ядра а молекулы имеем:
∂Е/∂Ra = - ∂V/∂Ra - сила, действующая
на ядро a в молекуле.
Вывод: силу, действующую на ядро а, можно рассматривать классически как сумму электростатического взаимодействия ядра а с электронной плотностью ρ и с другими ядрами. Поэтому теорему Гельмана-Фейнмана называют также электростатической теоремой. В равновесных системах (R=Re) Fa = FГФ = 0 и анализируя ЭП, обеспечивающую нулевые силы, можно выявить некоторые черты химической связи.
Пример: двухатомные гомоядерные молекулы. Функция
f (r) = cosθ1 + cosθ2
описывает проекцию на межъядерную ось кулоновской силы, действующей на ядра с зарядами Zi со стороны единичного отрицательного заряда в точке r.
Слайд 15 Силу F(R) можно записать через ЭП:
В
равновесии F(Re)=0. Примем, что ρ(г)>0 (знак электронного заряда игнорируем): знак
подынтегрального выражения в F(R) в каждой точке r определяется знаком f(r) в т. r.
f(r)>0 уменьшает значение F («связывает» ядра) - связывающие области;
f(r)<0 увеличивает значение F- антисвязывающие области.
Вывод: пространство молекулы можно разделить на связывающую область, в которой ЭП создает электростатические силы, действующие на ядра по направлению друг к другу, и на антисвязывающую область, в которой силы, действующие на ядра, стремятся их раздвинуть. Граничная поверхность, разделяющая эти области, определяется условием: Fxa=Fxb.
Слайд 16 Для стабильности молекулы необходимо, чтобы ЭП в связывающей
области при R=Re создавала силы, компенсирующие отталкивание ядер и действие
на ядра ЭП в антисвязывающих областях. Таким образом, стабильность молекул обеспечивается тонким балансом сил, действующих на ядра. Соответствующее распределение ЭП характеризуется картами ДЭП.
Силы, действующие на ядра, зависят от числа валентных электронов, т.е. от характеристик волновых функций, описывающих эти электроны: квантовых чисел n, l m. Поэтому можно рассчитывать силы и для отдельных МО: это позволяет охарактеризовать их вклад в связывание.
Силовой подход непригоден:
- для рассмотрения метастабильных состояний, энергия которых выше энергии отдельных атомов: значение силы, действующей на ядро, и в этом случае может быть равным нулю.
- На вершине энергетического барьера химической реакции, разделяющего исходные и конечные продукты, сила также равна нулю.
Теорема Гельмана-Фейнмана не может объяснить возникновение химической связи, т.к. она не рассматривает изменения кинетической энергии при образовании связи. Перераспределение ЭП, однако, происходит таким образом, что минимизируется полная энергия. Чтобы описать этот процесс, необходимо привлечение иного, энергетического, подхода к анализу природы химической связи.

Слайд 172)Теорема вириала устанавливает соотношение между энергией молекулы и ее кинетической
и потенциальной компонентами. Плотности кинетической g(r) и потенциальной v(r) энергий
и электронная плотность ρ(r) в системе с произвольной ядерной конфигурацией связаны соотношением:
,
v(r)=vNN(R)+ vNe(R, r) +vee(r), Ra –координата ядра а, R=(x, y, z),
Fa – сила, действующая на ядро а . Величина - сумма произведений векторов сил на векторы направлений их действия - называется вириалом сил, действующих на ядра системы.
Вириал –скалярная величина, измеряемая в единицах энергии.
Интегрируя по всему пространству с учетом теоремы Остроградского-Гаусса, получаем для средних значений компонент полной энергии:
V + 2G =0 или -V = 2G
Полная энергия системы равна сумме потенциальной и кинетической энергии Е=G+V, отсюда следует другое соотношение:
Е = - G.
Слайд 18Эти выражения отражают содержание теоремы вириала и характеризуют систему в
равновесии. Они справедливы как для молекулы, так и для атомов,
из которых она образуется. Именно поэтому они полезны при анализе природы химической связи.
Рассмотрим образование молекулы. Для бесконечно удаленных атомов (состояние 1) и для стабильной молекулы (состояние 2) выполняются соотношения: G1 = -(1/2)V1 , G2 = -(1/2)V2 .
При образовании молекулы (0K):
ΔG = G1 - G2 = -(1/2) ΔV.
Соответствующее изменение полной энергии
ΔЕ= ΔG +ΔV.
Используя теорему вириала, можно связать с изменением кинетической и потенциальной энергий:
ΔЕ=ΔG+ΔV = -(1/2)ΔV+ΔV = (1/2)ΔV,
ΔЕ=ΔG+ΔV = ΔG - 2ΔG = -ΔG.
Вывод: изменение полной энергии имеет тот же знак, что и изменение потенциальной энергии. При образовании молекулы полная энергия понижается, это сопровождается понижением полной потенциальной энергии. Одновременно кинетическая энергия повышается, но ее соответствующее изменение вдвое меньше по величине (G > 0!). Таков общий баланс изменений средних компонент энергии, сопровождающих образование молекулы. На этом фундаменте должен строиться дальнейший детальный анализ.

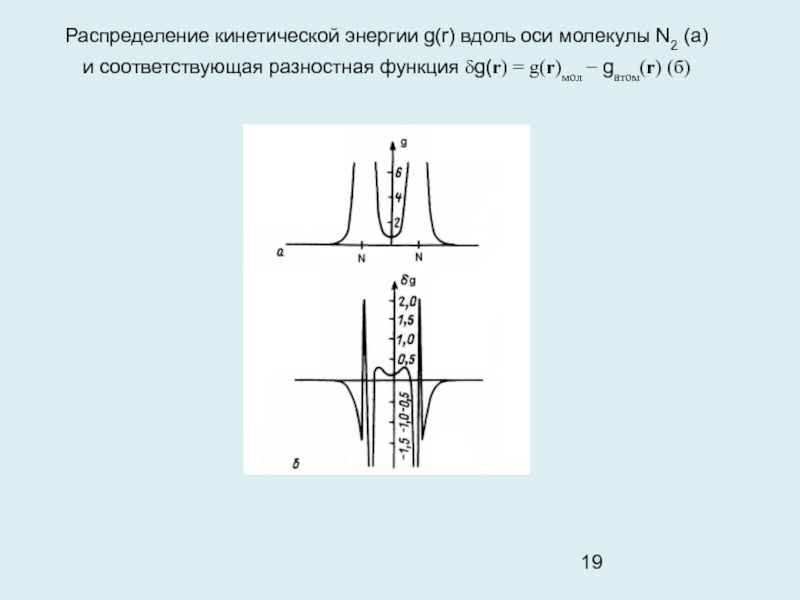
Слайд 19Распределение кинетической энергии g(r) вдоль оси молекулы N2 (а)
и
соответствующая разностная функция δg(r) = g(r)мол − gатом(r) (б)
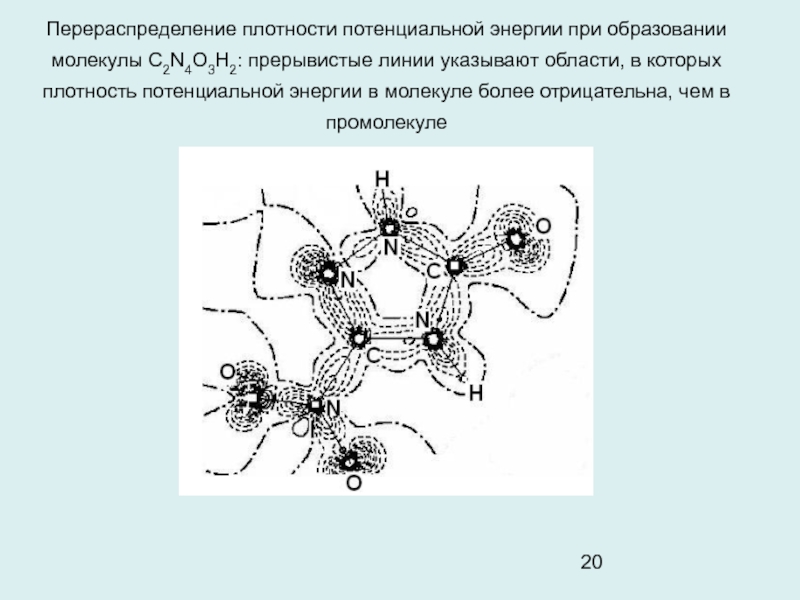
Слайд 20Перераспределение плотности потенциальной энергии при образовании молекулы С2N4O3H2: прерывистые линии
указывают области, в которых плотность потенциальной энергии в молекуле более
отрицательна, чем в промолекуле
Слайд 21Распределение плотностей кинетической и потенциальной энергий электронов в общем случае
имеет сложный характер.
Резюме: электростатические эффекты - первопричина образования химической
связи из-за связывающих сил, действующих на ядра в промолекуле. Конкретный тип образующейся химической связи, определяемый сортом и числом взаимодействующих атомов, формируется под контролем принципа Паули в результате квантово-механической интерференции электронных атомных облаков, которая может носить как конструктивный, так и деструктивный характер. Результирующее распределение ЭП отражает совокупность этих факторов и определяет энергетические особенности образовавшейся химической связи. Поэтому характеристики ЭП используются для идентификации химических связей.








![Химическая связь и межмолекулярное взаимодействие Если λ=Rа - ядерные координаты [V=V(Rа)], то для ядра а Если λ=Rа - ядерные координаты [V=V(Rа)], то для ядра а молекулы имеем: ∂Е/∂Ra = - ∂V/∂Ra](/img/thumbs/e2c2653e4216c92e0f0a5506fcf7e5c9-800x.jpg)