Слайд 1СТРОЕНИЕ, СВОЙСТВА И
ФУНКЦИИ БЕЛКОВ
Слайд 2Биохимия - это наука, занимающаяся изучением различных молекул, химических реакций
и процессов, протекающих в живых клетках и организмах.
Структурной единицей живых
систем является клетка, поэтому можно дать и другое определение:
Биохимия, как наука изучает химические компоненты живых клеток, а также реакции и процессы, в которых они участвуют.
Слайд 3Главная задача биохимии состоит в том, чтобы достичь полного понимания
на молекулярном уровне природы всех химических процессов, связанных с жизнедеятельностью
клеток.
Для решения этой задачи необходимо выделить из клеток многочисленные соединения, которые там находятся, определить их структуру и установить их функции.
В качестве примера можно указать на многочисленные исследования, направленные на выяснение молекулярных основ мышечного сокращения и ряда сходных процессов. В результате были выделены в очищенном виде многие соединения и проведены детальные структурно-функциональные исследования.
Слайд 4
Основательное знание биохимии совершенно необходимо для успешного развития двух главных
направлений биомедицинских наук:
решение проблем сохранения здоровья человека;
выяснение причин различных
болезней и поиск путей их эффективного лечения.
Слайд 5В живых клетках происходит синтез множества органических молекул, среди которых
главную роль играют полимерные макромолекулы – белки, нуклеиновые кислоты и
полисахариды. Особая роль в жизнедеятельности живых организмов принадлежит белкам.
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Они содержат: углерод (50-55%), водород (6,5-7,3%), азот (15-18%), кислород (21-24%), серу (2,4%).
!!! Особенно характерный показатель – процентное содержание азота, которое в большинстве случаев составляет 16%.
Слайд 6
Белки являются важнейшим субстратом жизни, т.к. обладают рядом особенностей:
молекулы
белков отличаются неисчерпаемым разнообразием структуры при строгой ее специфичности у
данного белка
2. белкам присуща способность к внутримолекулярным взаимодействиям, что обеспечивает динамичность структуры их молекул, изменчивость и пластичность их формы, обратимость переходов из глобулярного состояния в фибриллярное
3. обладая разнообразными химическими радикалами аминокислотных остатков в составе полипептидных цепей, белковые молекулы способны вступать в разнообразные химические и физические взаимодействия как с друг другом, так и с нуклеиновыми кислотами, полисахаридами, образуя надмолекулярные комплексы.
Слайд 74. молекулы белков закономерно изменяют свою структуру под влиянием внешнего
воздействия и восстанавливают исходное состояние. При его снятии многие белки
способны каталитически ускорять химические реакции, протекающие в живом организме.
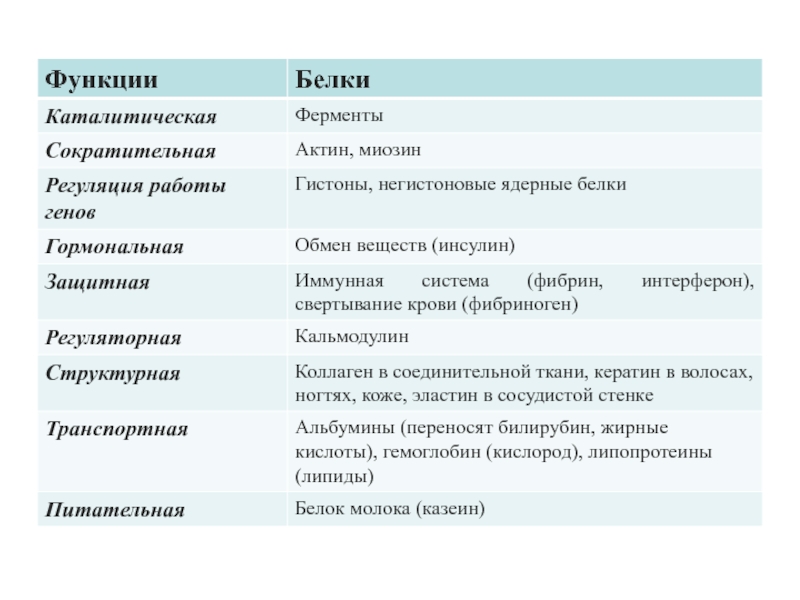
5. белкам присущи регуляторные, защитные, токсические, транспортные, сократительные, структурные, рецепторные и многие другие функции.
Слайд 8
Синтез белков очень сложен и трудоемок, поэтому реально лучше выделить
белки из природных источников. Белки обладают особой чувствительностью к химическим
реагентам (кислоты, щелочи) и легко разрушаются.
Белки очень легко теряют свои природные, нативные свойства и переходят в денатурированное состояние. Чтобы избежать денатурации белка в процессе его выделения, все операции проводят в мягких условиях (температуре не выше +5оС), избегая действия химических реагентов.
Впервые белок (клейковина) был выделен из пшеничной муки, потом белок молока – казеин.
Для успешного выделения белка из биологического объекта необходимо тонкое измельчение тканей клеточных стенок.
Слайд 9Последовательность операций по выделению белков обычно состоит в следующем:
измельчение
биологического материала (гомогенизация)
2. извлечение белков, перевод белков в растворенное состояние
(экстракция)
3. выделение исследуемого белка из смеси
других белков, т.е. очистка и получение индивидуального белка.
Слайд 10
МЕТОДЫ ВЫДЕЛЕНИЯ БЕЛКОВ
Высаливание (процесс осаждения белка из раствора под
действием соли)
Электрофорез (основан на способности различных белков перемещаться под
действием электрического поля с неодинаковой скоростью в растворе, на влажной фильтровальной бумаге)
Хроматография (афинная, ионообменная) разделение белковых смесей через колонку, заполненную адсорбентом (производные целлюлозы и сефадекса, несущие ионоонменные группировки, силикагель)
Диализ (в течение нескольких суток пропускают воду через сосуд, в который погружен диализационный мешочек, с раствором белка)
Гидролиз (белок нагревают с растворами кислот (20%-ный HCl) или щелочей при температуре 100-105оС в течение суток)
Слайд 11
Белки выделяют солевыми растворами
(8-10%). Различные соли обладают разным растворяющим действием по отношению к
белку. максимальным растворяющим действием обладает пирофосфат лития, минимальным – хлорид натрия.
Каждый индивидуальный белок разделяемой смеси осаждается из нее при определенной концентрации той или иной соли, в то время как другие белки при данной концентрации соли остаются в растворе. Процесс осаждения белка из раствора под действием соли называется высаливанием.
При дальнейшем насыщении солью выпадает следующий индивидуальный белок и, таким образом, последовательно наращивая концентрацию соли в реакционный среде, можно один за другим выделить относительно чистые индивидуальные белки.
Слайд 12Метод электрофореза основан на способности различных белков перемещаться под действием
электрического поля с неодинаковой скоростью в растворе, на влажной фильтровальной
бумаге.
Скорость передвижения белковых молекул определенного вида к аноду или катоду является функцией электрического заряда, молекулярной массы и формы молекул, ионной силы, рН и состава буферного раствора. Сочетание перечисленных факторов всегда специфично для каждого индивидуального белка, и естественно, что разные белки обладают различной электрофоретической способностью.
Наибольшее распространение получил электрофорез в твердых поддерживающих средах: целлюлозе, ацетилцеллюлозе, геле, агар-агаре, полиакриламидном геле.
Слайд 13
Адсорбционная хроматография
Разделение компонентов смеси (образца) основано на их различной сорбируемости
на твердом адсорбенте. В качестве адсорбентов используют активированный уголь, гель
фосфата кальция, оксиды алюминия или кремния.
Адсорбент в виде суспензии с растворителем вносят в стеклянную вертикальную трубку (колонку) и равномерно в ней упаковывают.
Образец в небольшом объеме растворителя наносят на колонку – компоненты разделяемой смеси адсорбируются на адсорбенте. Затем приступают к стадии освобождения – десорбции компонентов из колонки.
Слайд 14
Распределительная хроматография
В отличие от адсорбционной твердая фаза служит только опорой
(основой) для стационарной жидкой фазы. В качестве стационарной фазы применяют
влажный крахмал или силикагель. Образец растворяют в подходящем растворителе, затем наносят на колонку, разделяемые вещества, подвергающиеся распределению между неподвижной стационарной фазой (водный слой) и движущейся фазой органического растворителя, с разной скоростью перемещаются ко дну колонки.
Разновидностью распределительной хроматографии является хроматография на бумаге, широко используется в биохимических и клинических лабораториях для разделения пептидов, аминокислот и других веществ. Образец помещают на одном конце бумажной полосы, этим же концом бумагу погружают в подходящую смесь органических растворителей. При движении растворителя по бумаге благодаря силе капиллярности происходит разделение компонентов смеси.
Слайд 15
Ионообменная хроматография сводится к вытеснению противоионов, связанных с анионными и
катионными центрами ионообменника ионогенными группировками белковых молекул и связыванием последних
с ионообменником за счет электростатического взаимодействия.
В зависимости от вида белка и особенно от соотношения в его составе радикалов главным образом дикарбоновых аминокислот суммарный эффект этих связей варьирует, вследствие чего разные белки с неодинаковой скоростью вытесняются с ионообменника ионами проявителя и выходят из колонки раздельно. Затем ионообменник регенерируют.
Новейший метод ионообменной хроматографии ВЭЖХ.
Слайд 16
Аффинная хроматография
Основана на принципе избирательного взаимодействия белков с закрепленными
(иммобилизованными) на носителе специфическими веществами – лигандами (субстраты, гормоны, рецепторы).
Благодаря высокой специфичности белков к иммобилизованному лиганду, связанному с носителем (которым заполняют хроматографическую колонку), присоединяется только один белок из смеси.
Слайд 17
Все выделенные белки всегда содержат некоторое количество примесей, особенно ионов
солей. Для полного освобождения от этих примесей белки подвергают очистке
путем диализа.
Метод диализа состоит в длительном, в течение нескольких суток, пропускании воды через сосуд, в который погружен диализационный мешочек.
Его готовят из материалов, хорошо проницаемых для низкомолекулярных соединений и ионов, но не пропускающих крупные молекулы белка. Внутрь диализационного мешочка (камеры) помещают раствор белка. Камеру снабжают капиллярной трубкой. В нее в первые часы диализа устремляется часть белкового раствора, объем которого возрастает вследствие поступления воды внутрь камеры.
Слайд 18
Одним из наиболее распространенных методов исследования химического состава белковых тел
является гидролиз.
Белок нагревают с растворами кислот или щелочей при
температуре 100-105оС в течение суток. Чаще всего используют 20%-ный раствор соляной кислоты, обеспечивающий глубокий гидролиз с минимальным разрушением аминокислот. В последнее время для ускорения реакции гидролиза используют иммобилизованные (закрепленные на носителях) протеолитические ферменты и ионообменные смолы, что обеспечивает полное соответствие содержания аминокислот в гидролизате соотношению их в белке.
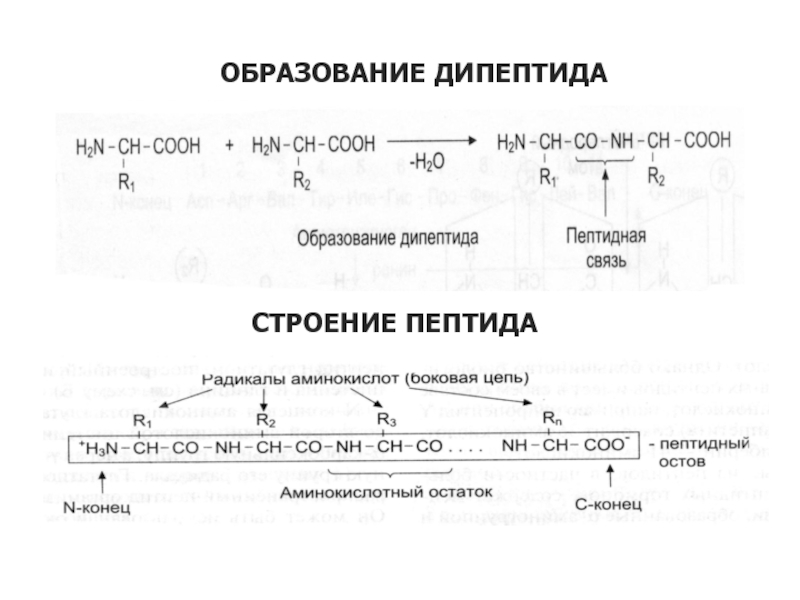
Слайд 19ОБРАЗОВАНИЕ ДИПЕПТИДА
СТРОЕНИЕ ПЕПТИДА
Слайд 20КЛАССИФИКАЦИЯ БЕЛКОВ
Классификация белков, основанная на их растворимости, была введена в
1907—1908 гг. и используется до сих пор, особенно в клинической
биохимии. Классификация белков, основанная на их растворимости.
Слайд 21ФОРМА МОЛЕКУЛ
Если исходить из отношения осей
(продольной и поперечной), можно выделить два больших класса белков.
У
глобулярных белков отношение составляет менее 10 и в большинстве случаев не превышает 3-4. Они характеризуются компактной укладкой полипептидных цепей.
инсулин, альбумины и глобулины плазмы, многие ферменты.
Фибриллярные белки, у которых отношение осей превышает 10, состоят из пучков полипептидных цепей, спирально навитых друг на друга и связанных между собой поперечными ковалентными или водородными связями. кератин, миозин, коллаген, фибрин и транспортные белки.
Слайд 23
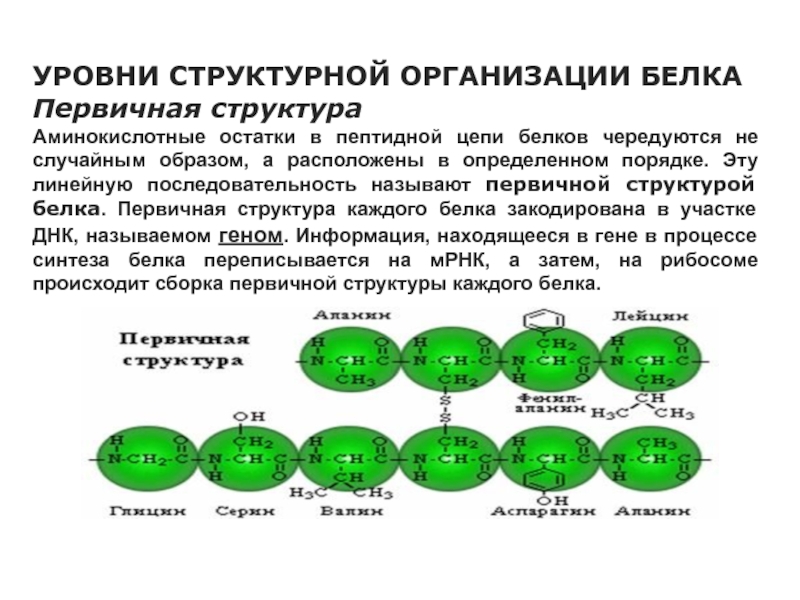
УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА
Первичная структура
Аминокислотные остатки в пептидной цепи белков
чередуются не случайным образом, а расположены в определенном порядке. Эту
линейную последовательность называют первичной структурой белка. Первичная структура каждого белка закодирована в участке ДНК, называемом геном. Информация, находящееся в гене в процессе синтеза белка переписывается на мРНК, а затем, на рибосоме происходит сборка первичной структуры каждого белка.
Слайд 24Вторичная структура
Пространственная структура, образующаяся в результате взаимодействий между функциональными группами,
входящими в состав белка.
Вторичная структура может быть регулярной (α-спираль,
β-спираль, складчатый р-слой)
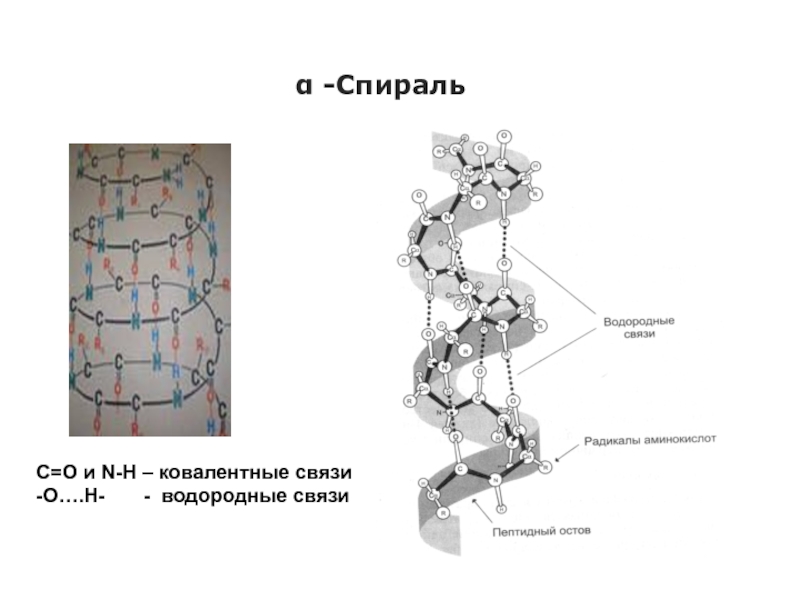
α-Спираль
В данном типе структуры пептидная цепь закручивается в виде спирали за счет образования водородных связей между пептидными группами.
Слайд 25Основные характеристики α-спирали
1. α-Спираль стабилизируется водородными связями между атомом
водорода, присоединенным к атому азота пептидной группы, и карбонильным кислородом
остатка, отстоящего от данного вдоль цепи на четыре позиции.
2. В образовании водородной связи участвуют все пептидные группы. Это обеспечивает максимальную стабильность α-спирали.
3. В образование водородных связей вовлечены все атомы азота и кислорода пептидных групп, что в значительной мере снижает гидрофильность α-спиральных областей и увеличивает их гидрофобность.
Слайд 26Основные характеристики α-спирали
4. α-Спираль образуется самопроизвольно и является наиболее
устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии.
5. В цепи
из L-аминокислот правая спираль, обычно обнаруживаемая в белках, намного стабильнее левой.
!!! На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм, что близко к периодичности 0,5-0,55 нм.
Слайд 27α -Спираль
С=О и N-Н – ковалентные связи
-О….Н-
- водородные связи
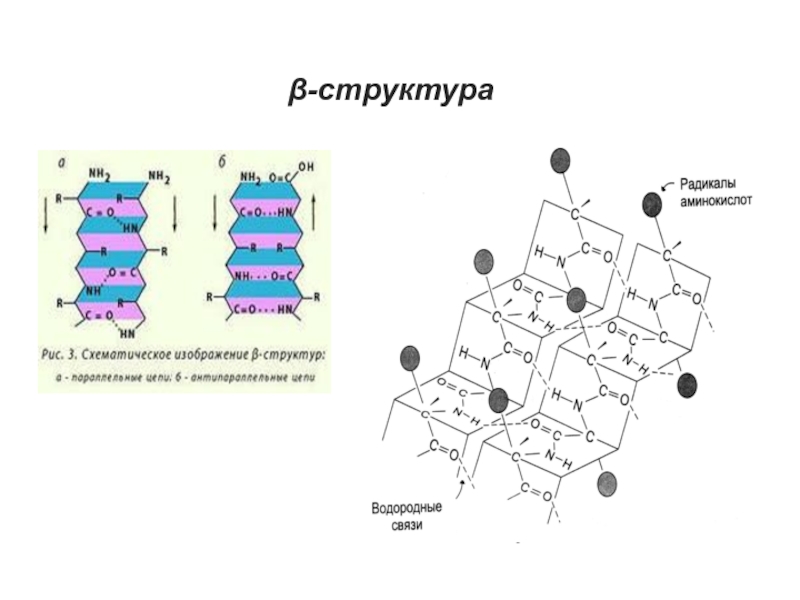
Слайд 28β-структура
Это слоистые структуры, образуемые при сочетании участков полипептидной цепи, находящихся
в β-конформации, т.е. в виде линейно построенных пептидных фрагментов.
Линейная
конформация этих фрагментов удерживается благодаря возникновению водородных связей между параллельно идущими участками полипептидной цепи.
Подобные структуры представлены в волокнистых белках (фиброин шелка). Однако и в глобулярных белках β-структуры присутствуют систематически и часто превалируют над α-структурами.
Слайд 30Третичная структура
Это трехмерная пространственная структура, образующаяся за счет взаимодействий между
радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от
друга в полипептидной цепи.
В формировании третичной структуры белка участвуют гидрофобные взаимодействия между гидрофобными радикалами аминокислот.
Слайд 31Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и
поэтому располагаются на поверхности белков. Они также взаимодействуют друг с
другом с помощью ионных и водородных связей.
Ионные связи могут возникать между отрицательно заряженными карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными группами радикалов лизина, аргинина и гистидина. Водородные связи возникают между гидрофильными группами.
Особое значение в поддержании третичной структуры белка придают дисульфидным мостикам, именно они в ряде белков прочно фиксируют расположение участков полипептидной цепи по отношению друг к другу.
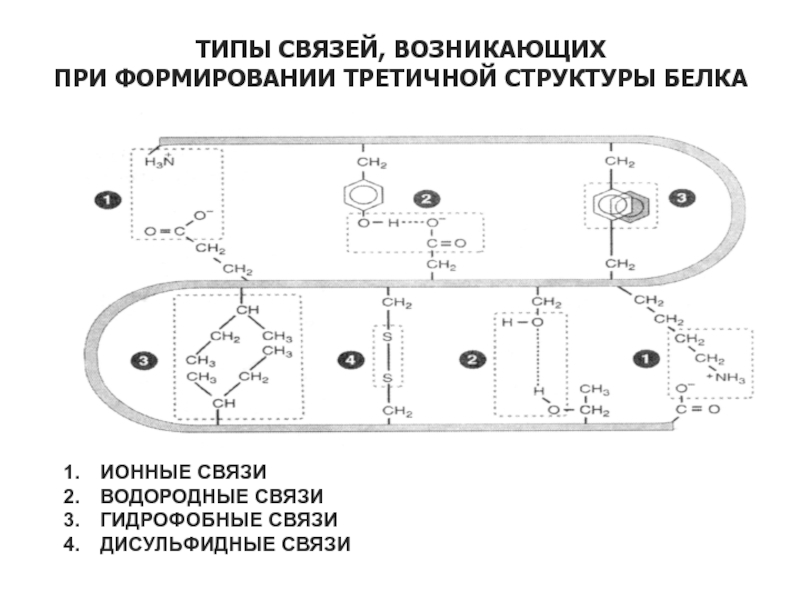
Слайд 32ТИПЫ СВЯЗЕЙ, ВОЗНИКАЮЩИХ
ПРИ ФОРМИРОВАНИИ ТРЕТИЧНОЙ СТРУКТУРЫ БЕЛКА
ИОННЫЕ СВЯЗИ
ВОДОРОДНЫЕ СВЯЗИ
ГИДРОФОБНЫЕ СВЯЗИ
ДИСУЛЬФИДНЫЕ
СВЯЗИ
Слайд 33Четвертичная структура
Если белки состоят из двух и более полипептидных цепей,
связанных между собой нековалентными (не пептидными и не дисульфидными) связями,
то говорят, что они обладают четвертичной структурой.
Такие агрегаты стабилизируются водородными связями и
электростатическими взаимодействиями между остатками, находящимися на поверхности полипептидных цепей. Подобные белки называют олигомерами, а составляющие их индивидуальные полипептидные цепи – протомерами, мономерами или субъединицами.
Слайд 34Многие олигомерные белки содержат два или четыре протомера и называются
димерами или тетрамерами соответственно.
Олигомерные белки играют особую роль во
внутриклеточной регуляции: их протомеры
могут слегка менять взаимную ориентацию, что приводит к изменению свойств олигомера.
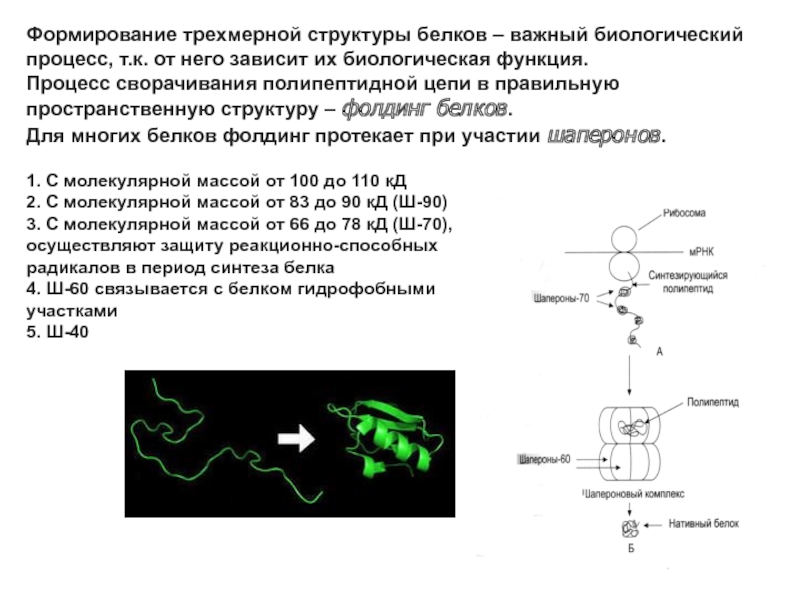
Слайд 35Формирование трехмерной структуры белков – важный биологический
процесс, т.к. от него
зависит их биологическая функция.
Процесс сворачивания полипептидной цепи в правильную
пространственную структуру – фолдинг белков.
Для многих белков фолдинг протекает при участии шаперонов.
1. С молекулярной массой от 100 до 110 кД
2. С молекулярной массой от 83 до 90 кД (Ш-90)
3. С молекулярной массой от 66 до 78 кД (Ш-70),
осуществляют защиту реакционно-способных
радикалов в период синтеза белка
4. Ш-60 связывается с белком гидрофобными
участками
5. Ш-40
Слайд 36
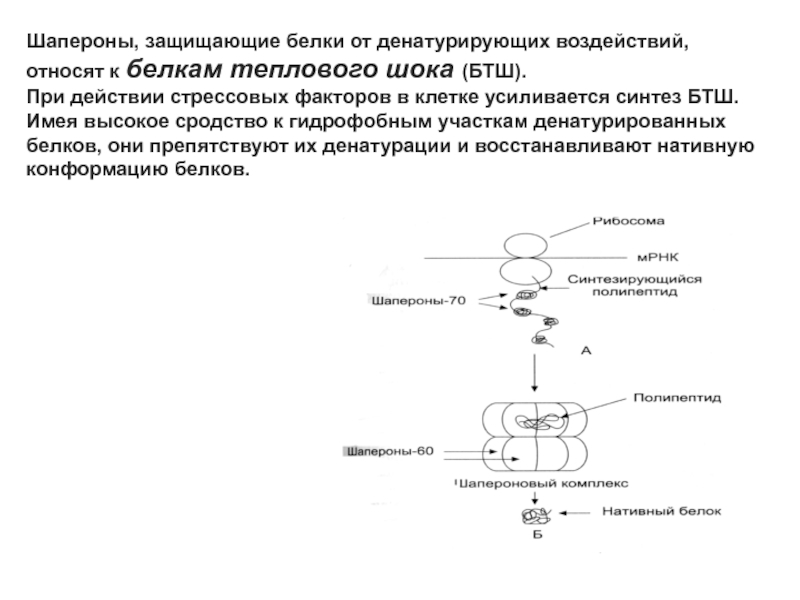
Шапероны, защищающие белки от денатурирующих воздействий, относят к белкам теплового
шока (БТШ).
При действии стрессовых факторов в клетке усиливается синтез
БТШ. Имея высокое сродство к гидрофобным участкам денатурированных белков, они препятствуют их денатурации и восстанавливают нативную конформацию белков.
Слайд 37Наиболее изученный пример белка, имеющего четвертичную структуру - гемоглобин.
Молекула
гемоглобина построена из 4-субъединиц с молекулярной массой 17 кДа каждая.
Первичная, вторичная, третичная структуры субъединиц молекулы гемоглобина полностью расшифрованы. Они оказались попарно идентичными и были названы субъединицами типа α и β.
4 субъединицы (две типа α и две типа β) соединяются в единую молекулу гемоглобина.
Слайд 38Большой интерес представляет интерес взаимосвязи структуры гемоглобина с его функцией
– способностью связывать, переносить и отдавать кислород.
Непосредственно молекула кислорода
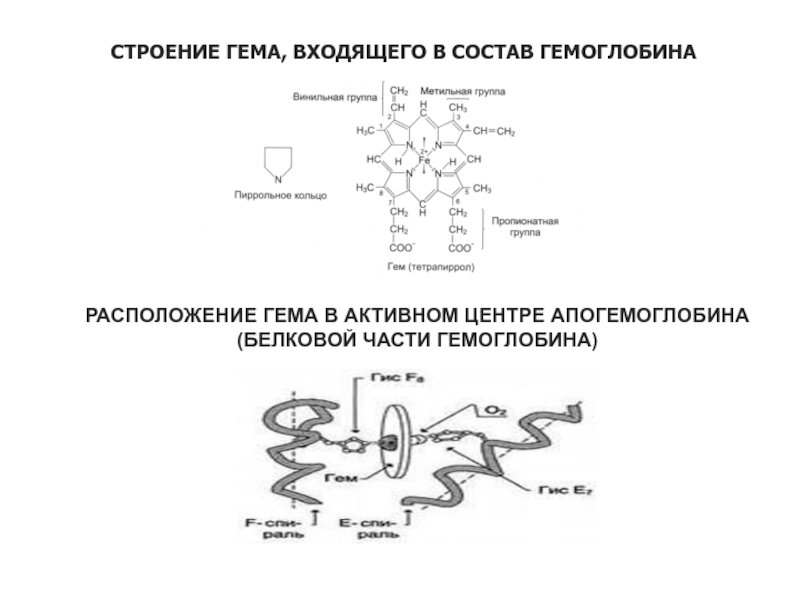
присоединяется к железу (2+), закрепленному в центре молекуле гема, который, в свою очередь удерживается в гидрофобном кармане каждой из субъединиц, будучи присоединен координационными связями к имидазольным радикалам гистидина.
Присоединение кислорода к железу идет без изменения валентности последнего на одну из его свободных координационных связей, при этом радиус атома железа (2+) уменьшается и он вместе с кислородом перемещается в плоскость порфирированного кольца. Здесь он удерживается до тех пор, пока молекула гемоглобина не будет перенесена в ткань с более низким содержанием кислорода, где и происходит обратный процесс отдачи кислорода.
Слайд 39Большой интерес представляет интерес взаимосвязи структуры гемоглобина с его функцией
– способностью связывать, переносить и отдавать кислород.
Непосредственно молекула кислорода
присоединяется к Fe2+, закрепленному в центре молекуле гема, который, в свою очередь удерживается в гидрофобном кармане каждой из субъединиц, будучи присоединен координационными связями к имидазольным радикалам гистидина.
Присоединение кислорода к железу идет без изменения валентности последнего на одну из его свободных координационных связей, при этом радиус атома железа (2+) уменьшается и он вместе с кислородом перемещается в плоскость порфирированного кольца. Здесь он удерживается до тех пор, пока молекула гемоглобина не будет перенесена в ткань с более низким содержанием кислорода, где и происходит обратный процесс отдачи кислорода.
Слайд 40СТРОЕНИЕ ГЕМА, ВХОДЯЩЕГО В СОСТАВ ГЕМОГЛОБИНА
РАСПОЛОЖЕНИЕ ГЕМА В АКТИВНОМ ЦЕНТРЕ
АПОГЕМОГЛОБИНА
(БЕЛКОВОЙ ЧАСТИ ГЕМОГЛОБИНА)
Слайд 41ДЕНАТУРАЦИЯ
Сравнительно слабые связи, ответственные за стабилизацию вторичной, третичной и четвертичной
структуры белка, легко разрушаются, что приводит к потере его биологической
активности.
Такое разрушение нативной структуры называют денатурацией. При денатурации олигомерного белка происходит диссоциация на протомеры, которая может сопровождаться или не сопровождаться изменением их конформации.
Слайд 42Большинство белков теряют биологическую активность в присутствии кислот или оснований,
мочевины, тяжелых металлов (Ag, Pb, Hg), органических растворителей, при нагревании,
при интенсивном встряхивании раствора. Денатурированные белки обычно менее растворимы в воде и часто из водного раствора выпадают в осадок.
Это свойство широко используется в клинической лаборатории. Пробы крови или сыворотки, взятые для анализа на содержание в них малых молекул (глюкозы, мочевой кислоты, лекарственных препаратов), сначала обрабатывают трихлоруксусной кислотой для осаждения белка. Осадок удаляют центрифугированием, а свободную от белка надосадочную жидкость анализируют.
Слайд 43ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки различаются по своим физико-химическим свойствам.
форма молекул
(глобулярные и фибриллярные)
2. молекулярная масса (молекулярная масса зависит от количества
аминокислотных остатков в полипептидной цепи)
3. суммарный заряд молекулы (белки имеют в своем составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот).
Слайд 44Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов
глутаминовой и аспарагиной кислот и катионных радикалов лизина, аргинина и
гистидина. Степень ионизации функциональных групп этих радикалов зависит от рН среды.
При рН 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации Н+ приводит к уменьшению отрицательного заряда белков (-СОО- + Н+→ -СООН), в щелочной среде связывание избытка ОН- с Н+, образующимися при диссоциации NH3+ приводит к уменьшению положительного заряда (-NH3+ +OH- →-NH2 + H2O).
Значение рН, при котором белок приобретает суммарный нулевой заряд, называют изоэлектрической точкой. Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке и могут двигаться в электрическом поле. Положительно заряженные белки движутся к катоду (-), а отрицательно заряженные – к аноду (+).
Слайд 45Изменение суммарного заряда аминокислот в зависимости от рН среды
Слайд 46Если полипептидная цепь белка содержит более 200 аминокислот, то ее
пространственная структура сформирована в виде двух или более доменов.
Домен
– это часть полипептидной цепи, образующая подобие глобулы, которая может быть связана с другими доменами этой же цепи. Домены можно выделить, действуя на белок протеолитическими ферментами, легко разрывающими пептидные связи на участке полипептидной цепи, расположенной между доменами.
В организме человека белки выполняют важные и разнообразные функции, которые осуществляются при их взаимодействии с другими веществами.
Слайд 47Соединение, с которым взаимодействует белок, называется лигандом (субстраты ферментов, кофакторы
(ионы металлов), ингибиторы (ацетилхолин – нейромедиатор, нарушающий проведение нервного импульса
через синапсы) и активаторы ферментов (адреналин – нейромедиатор симпатической нервной системы), протомеры в олигомерном белке).
Лиганд присоединяется к специальному участку на поверхности белковой молекулы – центру связывания (активному центру). Это – участок белковой молекулы, состоящий из аминокислотных остатков, сближенных при формировании третичной структуры и отвечающий за специфическое взаимодействие с лигандом. Взаимодействие лиганда с центром связывания осуществляется по принципу комплементарности (ключ к замку). Комплементарность – это пространственное и химическое соответствиелиганда и центра связывания белка.
При их взаимодействии чаще всего образуются ионные, водородные и гидрофобные связи.
Слайд 48КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
1. Общие, или универсальные, к ним относятся
биуретовая (на
обнаружение пептидной связи) и нингидриновая (на α-аминокислоты).
При
их помощи можно открыть любой белок.
2. Специфические - это реакции на отдельные аминокислоты, на
функциональные группы радикалов аминокислот, входящих в состав
белков. При их помощи можно открыть только тот белок, в состав
которого они входят.
Ксантопротеиновая реакция (Мульдера) происходит только
при наличии в белке ароматических аминокислот
(тирозин, фенилаланин, триптофан). Желтое окрашивание
Реакция Сакагучи идет с белками, которые содержат аргинин.
Розово-красное окрашивание
3. Реакция Миллона идет с белками, содержащими тирозин.
Кроваво-красное окрашивание
4. Реакции Фоля происходит при наличие в белке, сульфгидрильной
группы (–SH) в цистеине. Черное окрашивание
Цветные реакции дают возможность обнаружить присутствие белка в
биологических жидкостях, растворах и установить аминокислотный
состав различных природных белков.