Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Первое начало термодинамики
Содержание
- 1. Первое начало термодинамики
- 2. Внутренняя энергия является функцией состояния термодинамической системы:В
- 3. ВНУТРЕННЯЯ ЭНЕРГИЯ Изменение внутренней энергии идеального газа:[3]-
- 4. СПОСОБЫ ИЗМЕНЕНИЯ ВНУТРЕННЕЙ ЭНЕРГИИ ТеплообменКоличество теплоты
- 5. Для элементарного процесса: А и Q зависят
- 6. [6]РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА Рассмотрим газ
- 7. РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА По графику
- 8. Изотермический процесс: Т = const2. Изобарный процесс:
- 9. Теплоемкостью тела называется отношение бесконечно малого количества
- 10. Связь удельной и молярной теплоемкости:(10)Найдем молярную теплоемкость
- 11. ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА . 2) Р
- 12. Опыт → число степеней свободы молекулы зависит
- 13. Процесс, протекающий без теплообмена термо-динамической системы с
- 14. АДИАБАТИЧЕСКИЙ ПРОЦЕСС. (15)γ - показатель адиабаты (коэффициент Пуассона)Решая
- 15. для одноатомных газов γ = 1,67
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Внутренняя энергия и способы ее изменения.
Первое начало термодинамики.
Работа
газа при его расширении.
Слайд 2
Внутренняя энергия является функцией состояния термодинамической системы:
В т/д процессах внутримолекулярная
и внутриядерная энергии не меняются, из можно не учитывать в
расчете U.Внутренняя энергия U термодинамической системы включает в себя кинетическую энергию движения ее молекул, потенциальную энергию их взаимодействия, а также внутримоле-кулярную и внутриядерную энергии.
ВНУТРЕННЯЯ ЭНЕРГИЯ
[1]
Слайд 3
ВНУТРЕННЯЯ ЭНЕРГИЯ
Изменение внутренней энергии идеального газа:
[3]
- внутренняя энергия идеального
газа
[2]
Найдем внутреннюю энергию идеального газа.
Средняя кинетическая энергия одной молекулы:
Внутренняя энергия
идеального газа зависит только от Т.Слайд 4СПОСОБЫ ИЗМЕНЕНИЯ ВНУТРЕННЕЙ ЭНЕРГИИ
Теплообмен
Количество теплоты Q - количество энергии,
переданное от одного тела другому посредством теплообмена. Виды теплообмена:
теплопроводность
излучениеконвекция
2. Совершение работы А
А>0 - система совершает работу над внешними телами;
А<0, - внешние тела совершают работу над системой.
Слайд 5
Для элементарного процесса:
А и Q зависят от
вида процесса!
ΔU не зависит от вида протекающего процесса.
[3]
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Количество теплоты
переданное термодинами-ческой системе идет на изменение её внутренней энергии и совершение работы:А и Q не являются функциями состояния.
[4]
Слайд 6
[6]
РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА
Рассмотрим газ в сосуде под поршнем
площадью S. При соударении с поршнем газ действует на него
с силой F.При подъеме на бесконечно малую высоту dx газ совершает работу:
[5]
При конечном изменении объема от V1 до V2:
Слайд 7
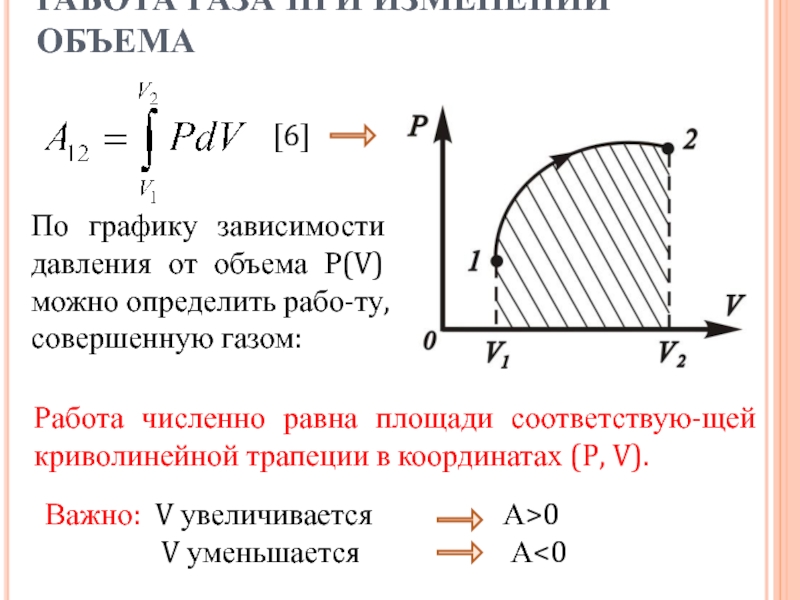
РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА
По графику зависимости давления от объема
Р(V) можно определить рабо-ту, совершенную газом:
Работа численно равна площади соответствую-щей
криволинейной трапеции в координатах (P, V). [6]
Важно: V увеличивается А>0
V уменьшается А<0
Слайд 8Изотермический процесс: Т = const
2. Изобарный процесс: Р = const
3.
Изохорный процесс: V = const
А12 = 0
РАБОТА ИДЕАЛЬНОГО ГАЗА В
ИЗОПРОЦЕССАХ
Слайд 9
Теплоемкостью тела называется отношение бесконечно малого количества теплоты, полу-ченного телом,
к соответствующему изменению его температуры:
(7)
Молярная теплоемкость – теплоемкость 1 моля
вещества:(8)
Удельная теплоемкость – теплоемкость единицы массы вещества:
(9)
ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА
Слайд 10
Связь удельной и молярной теплоемкости:
(10)
Найдем молярную теплоемкость идеального газа в
изопроцессах. Для нахождения δQ воспользуем-ся первым началом термодинамики:
1) V =
const → А = 0(11)
ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА
Слайд 11
ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА
.
2) Р = const →
(12)
Формула Майера:
(13)
3) Т = const → dT =
0 → (11) и(12)
Слайд 12
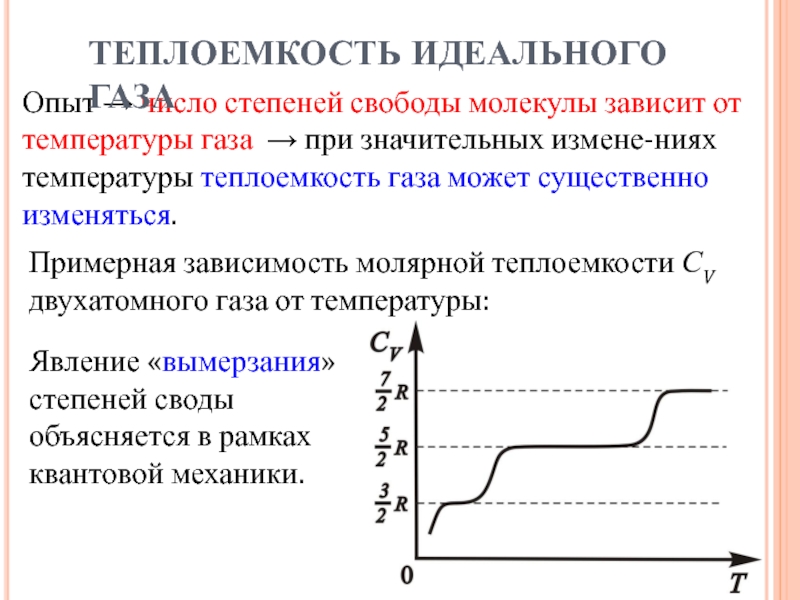
Опыт → число степеней свободы молекулы зависит от температуры газа
→ при значительных измене-ниях температуры теплоемкость газа может существенно изменяться.
ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА
Примерная зависимость молярной теплоемкости СV двухатомного газа от температуры:
Явление «вымерзания» степеней своды объясняется в рамках квантовой механики.
Слайд 13
Процесс, протекающий без теплообмена термо-динамической системы с окружающей средой, называется
адиабатическим.
δQ = 0 → первое начало термодинамики (4) имеет вид:
Для
идеального газа:
(14)
АДИАБАТИЧЕСКИЙ ПРОЦЕСС
или
В адиабатическом процессе система совершает работу над окружающими телами за счет своей внутренней энергии.
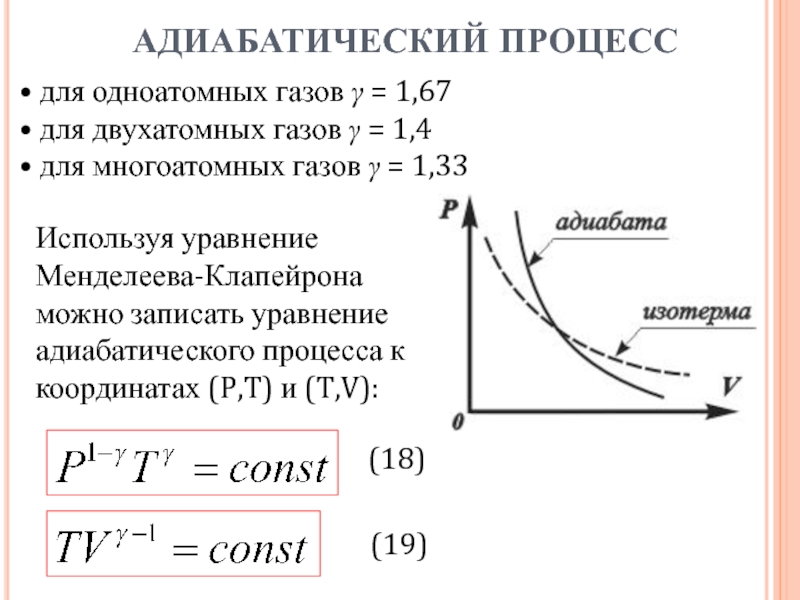
Слайд 14АДИАБАТИЧЕСКИЙ ПРОЦЕСС
.
(15)
γ - показатель адиабаты (коэффициент Пуассона)
Решая данную систему уравнений
можно получить уравнение адиабатического
процесса (уравнение Пуассона):
(11), (12)
(16)(17)
(16)
Слайд 15
для одноатомных газов γ = 1,67
для двухатомных газов
γ = 1,4
для многоатомных газов γ = 1,33
Используя уравнение
Менделеева-Клапейрона можно записать уравнение адиабатического процесса к координатах (P,T) и (T,V):АДИАБАТИЧЕСКИЙ ПРОЦЕСС
(18)
(19)


![Первое начало термодинамики ВНУТРЕННЯЯ ЭНЕРГИЯ Изменение внутренней энергии идеального газа:[3]- внутренняя энергия идеального газа[2]Найдем ВНУТРЕННЯЯ ЭНЕРГИЯ Изменение внутренней энергии идеального газа:[3]- внутренняя энергия идеального газа[2]Найдем внутреннюю энергию идеального газа.Средняя кинетическая энергия](/img/thumbs/e7569dc6fdb9053806d8ecdaa54137b0-800x.jpg)

![Первое начало термодинамики Для элементарного процесса: А и Q зависят от вида процесса! ΔU Для элементарного процесса: А и Q зависят от вида процесса! ΔU не зависит от вида протекающего процесса.[3]ПЕРВОЕ](/img/tmb/2/150181/49ddae079e830a1403b038058d4f7323-800x.jpg)
![Первое начало термодинамики [6]РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА Рассмотрим газ в сосуде под поршнем [6]РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА Рассмотрим газ в сосуде под поршнем площадью S. При соударении с поршнем](/img/thumbs/50d6e3bad48475c5b8b176d5f6affd00-800x.jpg)