Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
Содержание
- 1. БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
- 2. Мышечная ткань –поперечно-полосатая (скелетная и сердечная) и
- 3. Сердечная мышца – содержит 3 типа клеток:
- 4. Слайд 4
- 5. Гладкая мышечная ткань – образована одноядерными клетками
- 6. Саркомер – регулярно повторяющаяся структура (1,8 мкм),
- 7. Мышечные белкиМиофибриллярные (миозин, актин, тропомиозин, тропонин). Растворяются
- 8. Фибриллярные белки: Миозин образует темные диски (А)
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Этапы мышечного сокращения и расслабления1.Гидролиз АТФ миозиновой
- 14. Особенности сокращения сердечной мышцыИсточником Ca2+является внеклеточнаяжидкость. Поэтому,
- 15. Особенность сокращения гладкой мышцыДвигательный импульс изменяет проницаемость
- 16. Роль Са2+в метаболизме мышечной ткани. Связывание Са2+с
- 17. АТФ – зависимые процессы при мышечном сокращении1.
- 18. Метаболические процессы, поддерживающие необходимую концентрацию АТФ при
- 19. Слайд 19
- 20. При интенсивной мышечной работе запас АТФ истощается
- 21. В мышцах функционируют разные моторные единицы в
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Особенности углеводного обмена Поступление глюкозы усиливается при
- 26. Углеводный обменАктивность ключевых ферментов гликолиза в 20
- 27. Углеводный обменПосле приема углеводной пищи, в покое
- 28. Липидный обменПреобладают реакции катаболизма.Жировые депо могут формироваться
- 29. L-КАРНИТИН(N-гуанидин-N-метилглицин)Содержание карнитина в мышцах много >>, чем
- 30. Аминокислотный и белковый обменТестостерон активирует синтез белков,
- 31. аминокислотыСкелетные мышцы – основной компартмент деградации аминокислот,
- 32. Гормонально-метаболическая ситуация в организме при физической нагрузкеСкелетные
- 33. Литература:Трудные вопросы биохимии. Избранные лекции: учебное пособие/
- 34. Вопросы для семинара:1.Биохимические механизмы мышечного утомления.2. Биохимические
- 35. Скачать презентанцию
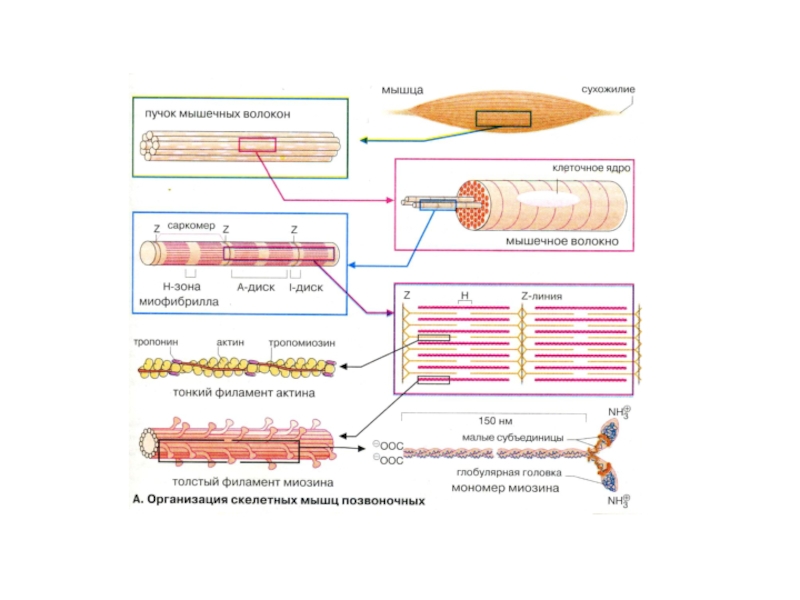
Мышечная ткань –поперечно-полосатая (скелетная и сердечная) и гладкая. Обладает возбудимостью и сократимостью. Поперечно-полосатая состоит из огромных клеток, слившихся в симпласт (многоядерных, с миофибриллами толстыми и тонкими) и миосателлитов (одноядерных клеток-спутниц).
Слайды и текст этой презентации
Слайд 2Мышечная ткань –поперечно-полосатая (скелетная и сердечная) и гладкая. Обладает возбудимостью
Слайд 3Сердечная мышца – содержит 3 типа клеток: 1.типичные (рабочие) миокардиоциты (одноядерные,
с миофибриллами, как в скелетных симпластах 2. атипичные (пейсмейкеры, образующие проводящую
систему) 3. секреторные (выделяют натрийуретический фактор). Механизм сокращения сходен со скелетными мышцами, но регуляция работы – другая. Стволовых клеток в миокарде нет, погибающие клетки замещаются соединительнотканными элементами.Слайд 5Гладкая мышечная ткань – образована одноядерными клетками (много митохондрий, ЭПС
развит слабо), миозиновые филламенты вне сокращения деполимеризованы, актиновые нити образуют
сеть. Ионы Ca2+освобождаются из пузырьков плазмалеммы, запускают полимеризацию филламентов и сокращение мышцы. Стволовые клетки-предшественники уже детерминированы и мигрируют к местам закладки соответствующих органов. Миоциты растут, увеличивают количество филламентов (возможна как рабочая гипертрофия, так и пролиферация клеток)Слайд 6Саркомер – регулярно повторяющаяся структура (1,8 мкм), до 1000-1200 по
длине миофибриллы. Состоит из упорядоченно расположенных миозиновых и актиновых нитей. Укорочение
длины саркомера происходит по модели скользящих нитей (Хаксли, Нидергерк, Хэнсон, 1950). Рентгеноструктурный анализ.Слайд 7Мышечные белки
Миофибриллярные (миозин, актин, тропомиозин, тропонин). Растворяются в растворах с
высокой ионной силой. Больше всего в симпластах скелетных мышц, менее
всего – в гладких миоцитах.Саркоплазматические (миоглобин,ферменты, кальсеквестрин). Осаждаются в растворах с низкой ионной силой.
Белки стромы (коллаген, эластин). Больше всего в гладких мышцах и миокарде.
Другие белки саркомеров(a-актинин, тайтин).
Формируют правильную сборку саркомеров.
Гистидинсодержащие дипептиды (карнозин и ансерин) –увеличивают АТФ-азную активность миозина, важны для поддержания буферной емкости в миоцитах.
Слайд 8Фибриллярные белки: Миозин образует темные диски (А) саркомеров, М.м 470 000
Да. 2 полипептидные (тяжелые) цепи по 2000 аминокислот и «головки»
по 150-200 аминокислот, ассоциированные с «легкими» цепями. Головки обладают АТФ-азной активностью (Энгельгардт, Любимова). Актин образует светлые диски (I) саркомеров, М.м 42000 Да, глобулярный белок(G) п присутствии АТФ и Mg2+ образует полимер(F) из двух нитей. Тропомиозин – 2 цепи по 284 аминокислоты. Располагается в бороздке полимеризованного актина, стабилизируя тонкие нити саркомера. Тропонин –комплекс из 3 субъединиц: 2 глобулярные I и C и 1 фибриллярная субъединица Т. Тропонин Т связывает комплекс с актином (на каждой 7 глобуле), тропонин I ингибирует реакцию между актином и миозином, тропонин С – связывает Са2+ (4 катиона), ингибируя действие тропонина I.Слайд 13Этапы мышечного сокращения и расслабления
1.Гидролиз АТФ миозиновой головкой
2. Связывание комплекса
миозин+АДФ+Ф с актином
3. Высвобождение АДФ и Ф из актомиозинового комплекса
4.
Связывание комплекса миозин – актин с новой молекулой АТФ5. Расслабление – отделение миозин+АТФ от актина
Слайд 14Особенности сокращения сердечной мышцы
Источником Ca2+является внеклеточная
жидкость. Поэтому, при снижении
концентрации
кальция во внеклеточной
жидкости сердечная деятельность
прекращается.
Скелетная мышца в этих условиях
может сокращаться часами.Слайд 15Особенность сокращения гладкой мышцы
Двигательный импульс изменяет проницаемость мембраны не для
Na+, а для Са2+,который поступает в клетку через наружную мембрану
(Т- системы канальцев нет).Далее, Са2+ связывается не с тропонином С, а с кальмодулином и активирует киназу миозина. Фосфорилированный миозин взаимодействует с актином.
Слайд 16Роль Са2+в метаболизме мышечной ткани.
Связывание Са2+с тропонином С изменяет конформацию
тропонин-тропомиозинового комплекса, тем самым освобождает активный центр актина.
Взаимодействие Са2+ в
головкой миозина нейтрализует его отрицательный заряд и сближает АТФ с активным центром АТФ-азы миозина.Са2+ увеличивает активность креатинфосфокиназы (т.е. увеличивает образование АТФ в первые секунды сокращения)
Са2+активирует киназу фосфорилазы (т.е. увеличивает распад гликогена и концентрацию глюкозы.
Слайд 17АТФ – зависимые процессы при мышечном сокращении
1. Работа Na +-
насоса клеточной мембраны по перемещению ионов калия и натрия против
градиента и обеспечение потенциала +50 мВ.Еще более существенные затраты АТФ – на возвращение ионных градиентов к исходному уровню.
2. Са2+- насос саркоплазматического ретикулума
3. Превращение химической энергии гидролиза АТФ в механическую энергию сокращения.
Слайд 18Метаболические процессы, поддерживающие необходимую концентрацию АТФ при мышечной работе
Креатинфосфокиназная
реакция
Гликогенолиз, гликолиз
Аэробное окисление глюкозы, жирных кислот, кетоновых тел
Аденилаткиназная реакция
Природа
метаболического топлива различна: в скелетной мышце –окисление жирных кислот в покое и при неинтенсивных сокращениях, анаэробный гликолиз – при экстремальных сокращениях, в сердечной –в большей степени окисление кетоновых тел. Слайд 20При интенсивной мышечной работе запас АТФ истощается за 1 секунду!
1.Еще
несколько секунд запас АТФ поддерживает КРЕАТИНФОСФАТ(запас его в покое в
5 раз больше, чем АТФ).2. Образующийся АДФ вступает в аденилаткиназную реакцию.
Кроме дополнительного источника АТФ, эти низкоэргические фосфаты (АДФ, АМФ) мощно стимулируют активность ферментов гликогенолиза, гликолиза и окисления жирных кислот, ЦТК и окислительное фосфорилирование.
Слайд 21В мышцах функционируют разные моторные единицы в составе которых разные
мышечные волокна, отличающиеся формами миозина, АТФ-азной активностью и т.д.
SLOW-ME -
медленные, красные волокна. Много миоглобина, волокон,митохондрий.FAST- ME- быстрые, белые. Больше гликогена, мало миоглобина:
FR – быстро сокращаются , устойчивы к утомлению, много митохондрий.
FF – быстоутомляемые, митохондрий меньше, активен гликолиз (анаэробный метаболизм).
Слайд 25Особенности углеводного обмена
Поступление глюкозы усиливается при мышечной работе или
под влиянием инсулина. В покое – биосинтез гликогена, при работе
– гликолиз или тканевое дыхание и образование АТФ.Миоциты (особенно медленносокращающиеся –гладкие, сердечная) ,поглощают глюкозу незначительно. При голодании мышцы прекращают использовать глюкозу. Км гексокиназы на 3 порядка ниже, чем в печени. Фосфорилирование глюкозы необратимо.
(гл-6-фосфатазы нет).
Слайд 26Углеводный обмен
Активность ключевых ферментов гликолиза в 20 раз выше, чем
в печени.
Гликолиз практически необратим, ферментов глюконеогенеза нет.
Пентозофосфатный путь также
практически не функционирует (НАДФН в мышцах почти не требуется). В скелетных мышцах: глю ? ПВК? лактат (ЛДГ5 )? кровь. В печени –глюконеогенез (цикл Кори, снижение лактатацидоза!), в других органах – окисление и образование АТФ.
В сердечной – глю-->ПВК? ацетилКоА;
Лактат (из крови)?ПВК (ЛДГ1 )? ацетил КоА.
Слайд 27Углеводный обмен
После приема углеводной пищи, в покое создается запас гликогена
(1-2% от массы ткани). 15 мин бега – распадается 100
г гликогена.Ключевой фермент гликогенолиза –гликогенфосфорилаза активируется фосфорилированием киназой фосфорилазы.
В покое (низкая концентрация Са2+.адреналина и цАМФ) – гликогенфосфорилаза аллостерически активируется АМФ и Фн.
Умеренные нагрузки: раздражение нерва--->повышение конц. Са2+->аллост. активация киназы .фосфорилазы.
Экстрим. сокращение: адреналин->цАМФ->ФПК->фосфорилирование киназы фосфорилазы – активация гликогенфосфорилазы.
Разная степень активации гликогенолиза в соответствием с потребностями в энергии!!!
Слайд 28Липидный обмен
Преобладают реакции катаболизма.
Жировые депо могут формироваться в прилежащих к
мышцах тканях. В миоцитах биосинтеза жирных кислот и ТАГ не
происходит. В покое и при длительной аэробной работе – окисление жирных кислот.Гладкие мышцы и сердечная и в покое предпочитают глюкозе жирные кислоты и кетоновые тела.
Адреналин в начале работы стимулирует не только гликолиз в мышцах, но и липолиз в жировых депо.
В печени – неполное окисление жирных кислот->кетогенез. Более всего кетоновые тела окисляются сердечной мышцей.
Слайд 29L-КАРНИТИН(N-гуанидин-N-метилглицин)
Содержание карнитина в мышцах много >>, чем в печени или
др. органах.
Синтезируется в печени и почках из лиз и
мет при участии витаминов С, В3, В6, В9, В12, Fe.Потребность для взрослых до 300 мг/сут, увеличивается в 5-10 раз при серьезных! физических нагрузках.
Содержится в белковых продуктах (мясных. молочных).
Слайд 30Аминокислотный и белковый обмен
Тестостерон активирует синтез белков, кортизол – подавляет.
При
голодании организм использует мышечные белки как резерв аминокислот (для глюконеогенеза
в печени или как источник энергии).Мерой деградации мышечных белков может служить выделение с мочой метилгистидина (минорная аминокислота, характерная для мышц)
Слайд 31аминокислоты
Скелетные мышцы – основной компартмент деградации аминокислот, особенно с разветвленной
цепью.
В кровь активно поступают глутамин (глутаминсинтазная реакция) и аланин
(переаминирование с ПВК), унося азот аммиака в печень и почки.Удаление ПВК (в виде аланина), как и лактата – предотвращает закисление среды в мышцах и метаболический ацидоз в крови.
Слайд 32Гормонально-метаболическая ситуация в организме при физической нагрузке
Скелетные мышцы, имея большую
массу (до 50% веса тела) играют огромную роль в обмене
веществ всего организма.Физическая нагрузка приводит к изменению концентрации электролитов (Na+, K+, Ca2+), глюкозы, кислотно-щелочного баланса.
Адреналин способствует перераспределению кровотока и соответственно снабжению О2 работающих мышц.
Инсулин усиливает поступление в миоциты аминокислот, глюкозы, жирных кислот.
В крови увеличивается концентрация аминокислот, органоспецифичных ферментов мышц, лактата. Ацетилхолина, Са2+.
Слайд 33Литература:
Трудные вопросы биохимии. Избранные лекции: учебное пособие/ под редакцией Т.С.Федоровой,
В.Ю.Сереброва. – Томск: СибГМУ, 2006.-318с. (Статья Тимина О.Е.)
Биохимия. Версия 1.0
/Электрон. ресурс/: Электронное учебное пособие/ Т.Н. Замай, Н.М. Титова и др. –Красноярск: ИПК СФУ, 2008.-Чиркин А.А., Данченко Е.О. Биохимия
Слайд 34Вопросы для семинара:
1.Биохимические механизмы мышечного утомления.
2. Биохимические основы тренировки (скоростной
и силовой).
3. Обмен нуклеиновых кислот и белков. Гипертрофия и гиперплазия
мышечных волокон.4. Спортивное питание.