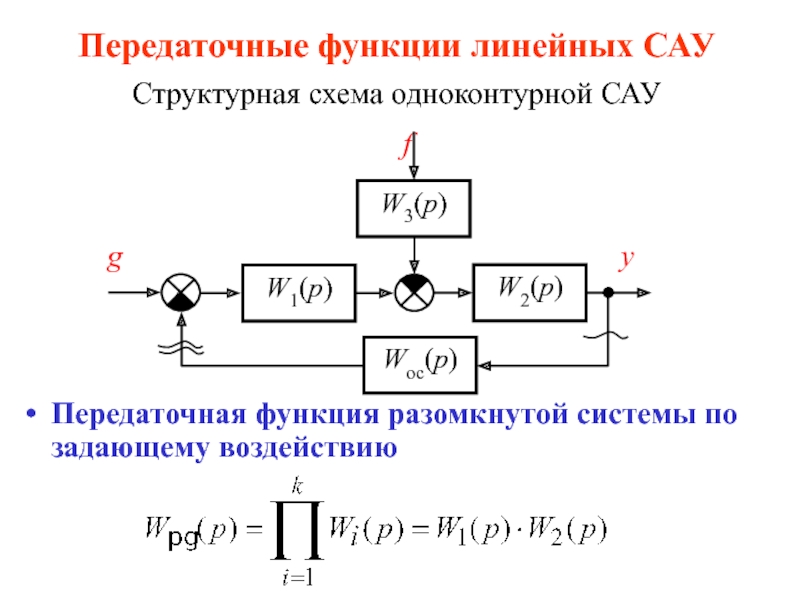
Слайд 1Липиды и обмен липидов
Липиды – гидрофобные вещества, эфиры жирных кислот
и спиртов.
Классификация:
Простые: нейтральные жиры (глицерофосфолипиды) и воска
Сложные: фосфолипиды (глицеро- и
сфинголипиды); гликолипиды (цереброзиды, ганглиозиды, сульфатиды); липопротеины (ХМ, ЛПОНП, ЛПНП, ЛПВП)
Неомыляемые : стероиды и терпены
Слайд 4ФУНКЦИИ ЛИПИДОВ
1. Энергетическая (1 г липидов при окислении дает 9,3
ккал; 1 моль пальмитиновой кислоты – 130 АТФ). Резервный видоспецифический
нейтральный жир, депонированный в адипоцитах.
Но! Жирные кислоты окисляются только в митохондриях, в аэробных условиях; не проникают через гематоэнцефалический барьер.
Т.о. жирные кислоты не всегда и не во всех клетках могут служить источником энергии.
Слайд 5Функции липидов
Структурная: холестерол и фосфолипиды – структурные компоненты мембран.
Метаболическая:
холестерол образует большое число биоактивных стероидов, витамин Д, желчные кислоты;
Защитная,
антибактериальная, термоизоляционная: подкожная жировая клетчатка, сальник, миелиновая оболочка периферических нервов, альвеолярный сурфактант, кожное сало.
Слайд 6Функции липидов
Регуляторная: стероидные гормоны, фосфатидилинозитол и его производные: диацилглицерол и
инозитолфосфат (вторичные мессенджеры гормонов); производные полиненасыщенных жирных кислот: простагландины, лейкотриены,
тромбоксаны и др.
Слайд 7Патология липидного обмена
Первичные нарушения:
Гиперлипопротеинемия, дислипопротеинемия (гиперхолестеринемия: атеросклероз)
Ожирение
Желчнокаменная болезнь
Метаболический ацидоз (кетонемия)
Вторичные
гиперлипопротеинемии сопровождают сахарный диабет, нефроз, гепатит, хронический алкоголизм.
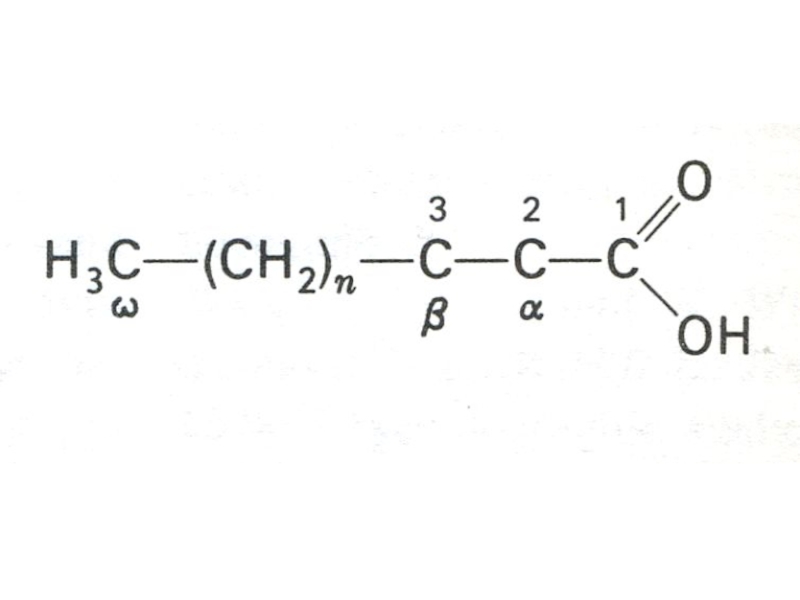
Слайд 8Жирные кислоты
> 70 жирных кислот идентифицированы в организме.
Свободные жирные кислоты
находятся в основном в плазме крови (транспортируются альбумином), в клетках
жирные кислоты - в виде эфиров со спиртами.
В клетках синтезируются в основном жирные кислоты насыщенные, с четным числом атомов С, имеющие компактную укладку (цис-конформация).
Две классификации: Сn:m,Δ или ω:3,6 , где n – число атомов С, m – количество двойных связей; Δ - место двойной связи (считая от СООН группы); ω – место двойной связи, считая от СН3 – группы.
Например: линолевая кислота С18:2 Δ 9,12 или ω− 6.
Слайд 9ЖИРНЫЕ КИСЛОТЫ
Галогеновое число определяет число двойных связей в жирной кислоте.
У человека возможен синтез только пальмитоолеиновой и олеиновой кислот (мононенасыщенные).
Полиненасыщенные (линолевая, линоленовая, арахидоновая) – незаменимые (эссенциальные).
Количество двойных связей определяет температуру плавления: для пальмитиновой к-ты 630С, олеиновой 13,50С, линолевой -110С.
Соли жирных кислот – мыла (образуют мицеллы).
Липиды экстрагируются из тканей органическими растворителями, разделяются и идентифицируются хроматографически (по растворимости).
Спектрофотометрически жирные кислоты не определяются (нет сопряженных двойных связей)
Слайд 10Производные ненасыщенных жирных кислот - ЭЙКОЗАНОИДЫ
Семейства простагландинов, тромбоксанов, лейкотриенов др.
- биологически активные вещества, действуют в концентрации 10 -9М, как
гормоны местного действия, через рецепторы и систему циклических нуклеотидов и других посредников.
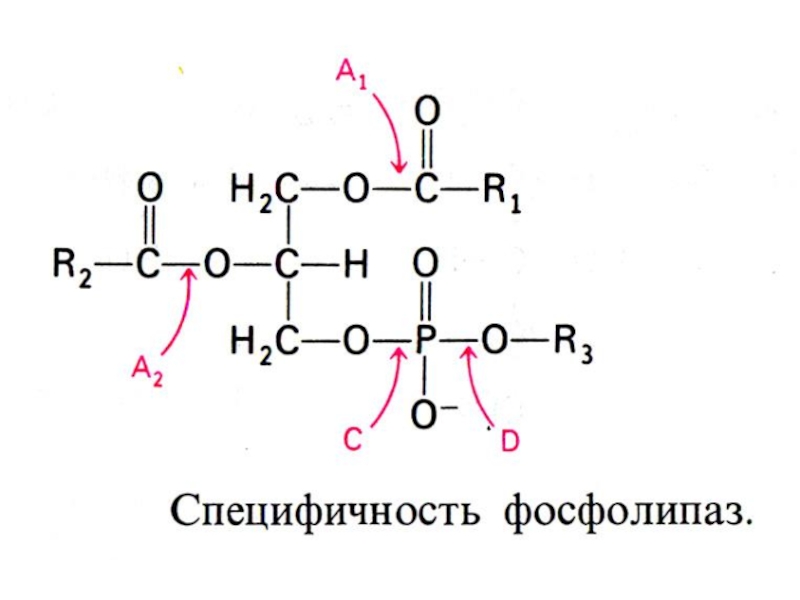
Образуются в мембранах клеток из С20 полиненасыщенных кислот , продуктов гидролиза фосфолипидов мембран под действием фосфолипазы А2 или С (ингибируется стероидными гормонами).
Слайд 11ПРОСТАГЛАНДИНЫ
Образуются при участии циклооксигеназы из арахидоновой кислоты (С20:4).
Ингибируется аспирином по
механизму ковалентной модификации фермента – ацетилирование).
Слайд 12Внешний обмен липидов
Потребность в жирах – 80 -100 г/сут (возрастает
при необходимости перехода энергетического обмена с преимущественно углеводно-липидного на липидно-углеводный).
Важно
поступление полиненасыщенных жирных незаменимых (полиненасыщенных) кислот.
Условие гидролиза жиров в ЖКТ – эмульгирование, что делает их доступными для действия липаз, растворенных в водной среде. Колипазы.
Естественной эмульсией является только молоко.
Особенность пищеварения у детей – наличие липазной активности в желудке.
Слайд 13ВНЕШНИЙ ОБМЕН ЛИПИДОВ
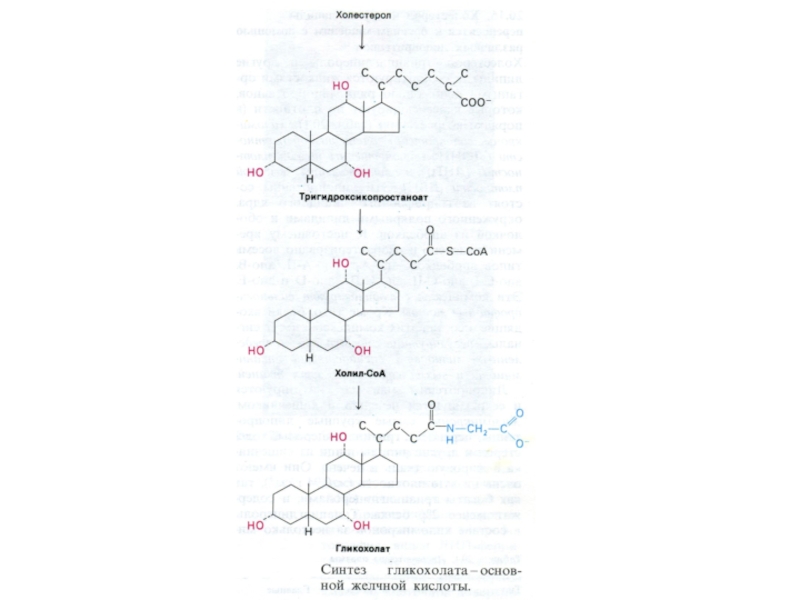
Основные эмульгаторы жиров в ЖКТ – желчные кислоты
– производные холестерола, но и фосфолипиды и жирные кислоты служат
являются поверхностно активными веществами и являются эмульгаторами.
Желчные кислоты образуются в гепатоцитах после окисления боковой цепи и действии холестерол-гидроксилазы. Далее холановые кислоты коньюгируют с остатками глицина или таурина и образуют соли калия или натрия.
До 80% холестерола превращается в холевые кислоты и «сбрасываются» в желчные капилляры.
Желчные кислоты и фосфолипиды поддерживают холестерин желчи в растворимом состоянии, предотвращая образование «камней» в желчном пузыре
Являясь амфипатичными молекулами холевые кислоты способствуют эмульгированию липидов и участвуют в формировании мицелл, в составе которых всасываются гидрофобные вещества в кишечнике ( в том числе жирорастворимые витамины).
.
Слайд 17ВНЕШНИЙ ОБМЕН ЛИПИДОВ
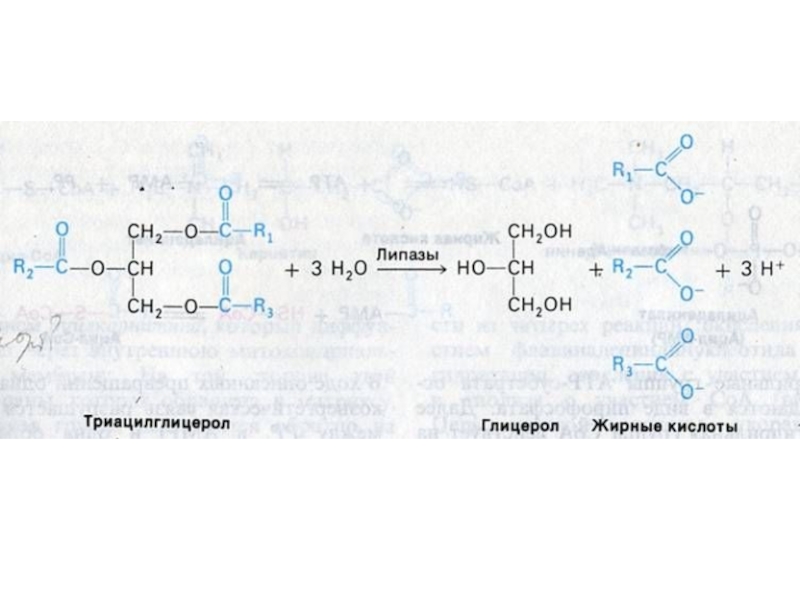
Гидролиз нейтральных жиров в 12 –п кишечнике: моно-
, ди- и триглицеридлипазы: продукты – глицерин, моно- и ди-ацилглицеролы
(чаще 2- МАГ).
Гидролиз фосфолипидов (фосфотидилхолина,например): фосфолипаза А1, А2, С и Д. Продукты: 1,2 ацилглицеролы; 2-ацилглицеролфосфорилхолин, лизофосфатидилхолин (амфипатичное соединение!), фосфатидная кислота, холин.
Гидролиз эфиров холестерола: холестерол-эстераза. Продукты: холестерол и жирная кислота.
Липазы тонкого кишечника активируются трипсином.
Слайд 18ВСАСЫВАНИЕ ПРОДУКТОВ ГИДРОЛИЗА В ЖКТ
Мелкие эмульгированные капли жира (до 0,5
мкм) проникают через кишечную стенку без предварительного гидролиза.
Глицерин и короткие
жирные кислоты (до 10 С- атомов) диффундируют самостоятельно.
Длинные жирные кислоты, 2 - МАГ,ХЛ и ЭХЛ всасываются в составе мицелл (окруженные фосфолипидами и желчными кислотами) (мицеллярная диффузия или пиноцитоз).
Желчные кислоты совершают многократную энтерогепатическую циркуляцию (синтез 3 -7 г при потребности 100-200 г). До 0,6 г/сут теряется с калом.
Слайд 19Ресинтез жиров в энтероцитах
На основе продуктов гидролиза экзогенных жиров в
энтероцитах синтезируются видоспецифичные липиды. Чаще всего 2-МАГ этерифицируется остатками олеиновой
кислоты.
Фосфолипиды образуются на основе фосфатидной кислоты и активных форм холина, серина и т.д.
Слайд 20Транспортные формы экзогенных липидов
Продукты ресинтеза жиров (ТАГ, ЭХЛ. ФЛ) в
энтероцитах образуют комплекс с Апо В-48 (незрелые хиломикроны), поступая через
лимфу в кровь, они обогащаются Апо С-II (активатор ЛП-липазы) и Апо Е (узнается клеточными рецепторами).
ЛП-липаза эндотелия тканевых капилляров гидролизует ТАГ в составе ХМ, снабжая клетки жирными кислотами. ЛП-липаза синтезируется в гепатоцитах и активируется гепарином, инсулином, СТГ.
Остаточные (ремнантные)ХМ поглощаются гепатоцитами.
Липиды, синтезирующиеся в печени (эндогенные) транспортируются в крови в составе ЛПОНП (Апо В-100).
Слайд 21Кругооборот эндогенных липидов
Липиды, синтезирующиеся в печени (эндогенные) транспортируются в
крови в составе ЛПОНП (Апо В-100).
ЛПОНП под действием ЛП-липазы отдают
жирные кислоты ТАГ в клетки разных органов, становясь атерогенными ЛППП и ЛПНП (обогащены ХЛ и ЭХЛ).
В печени образуются незрелые ЛПВП (Апо А – активатор ЛХАТ). Проходя через сосудистые стенки, захватывают в тканях ХЛ и транспортируют его в печень (антиатерогенное действие – дренажная система ХЛ).
Имея в своем составе фермент ЛХАТ, ЛПВП способны нагружаться большим количеством ХЛ.
Слайд 22Промежуточный обмен липидов
Внутриклеточный липолиз:
Адипоциты. Постабсорбтивный период, голодание, физическая нагрузка.
ТАГ-липаза. Активна
в фосфорилированном состоянии.
Адреналин (в высоких концентрациях взаимодействует с β− рецепторами,
увеличивает концентрацию цАМФ и активирует ФПК, фосфорилирующую липазу); инсулин в абсорбтивный период активирует фосфатазу и снижает активность липазы.
Слайд 23Промежуточный обмен липидов
Жирные кислоты транспортируются в крови в комплексе с
альбумином.
Проникая в клетки, жирные кислоты (мембранные транспортные белки), подвергаются окислению
или становятся субстратами для липогенеза.
Продукт β-окисления ацетил-КоА окисляется далее в ЦТК или становится субстратом для кетогенеза или липогенеза ( в зависимости от нужд клетки в данный момент).
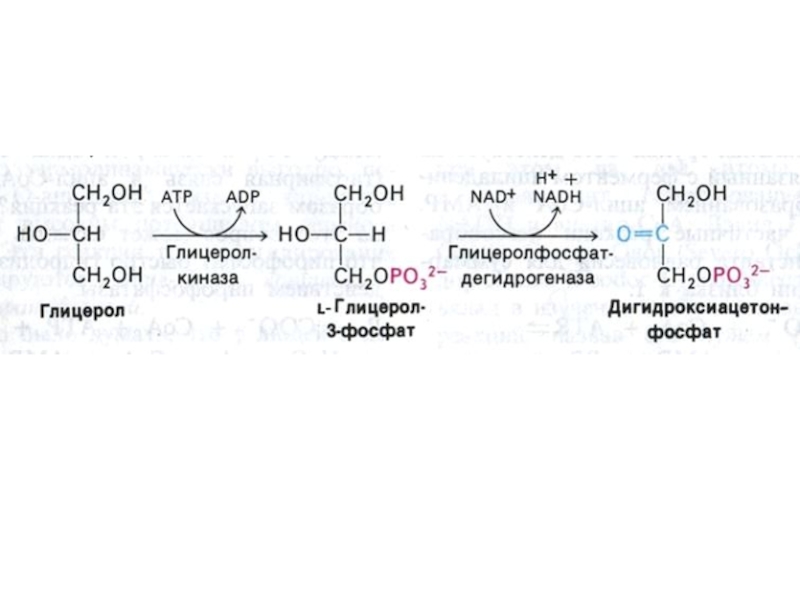
Слайд 24Метаболизм глицерина
Глицерин образуется как продукт липолиза или возникает при восстановлении
избытка диоксиацетонфосфата (метаболит гликолиза).
Глицерин становится субстратом для липогенеза, глюконеогенеза или
окисляется через диоксиацетонфосфат по гликолитическому пути.
Назовите ключевые ферменты этих метаболических превращений и посчитайте энергетическую ценность окисления глицерина.
Слайд 26Окисление жирных кислот
Печень, миокард, скелетные мышцы более 50% энергии получают
при окислении жирных кислот.
Ленинджер, Кеннеди показали, что окисление жирных
кислот идет в митохондриях, требует присутствия О2 ,АТФ, КоА.
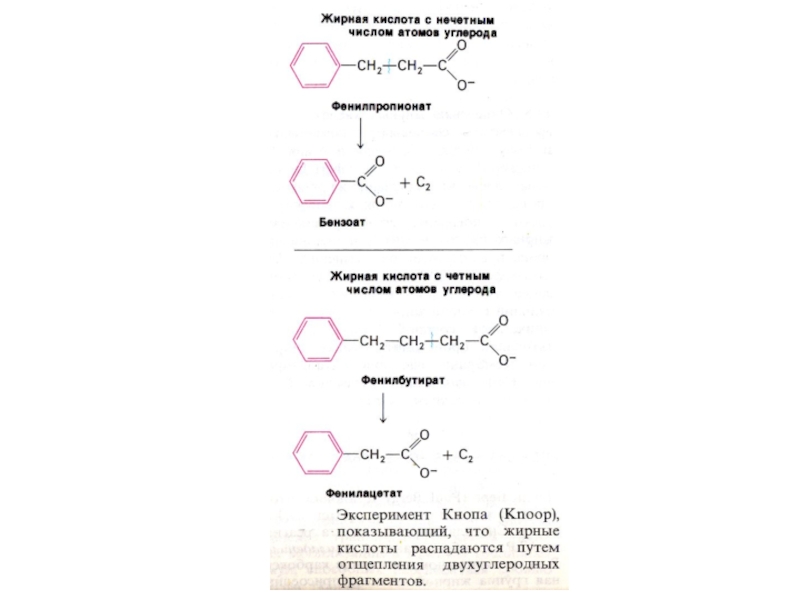
Ведущим является механизм окисления по β − атому (опыты Кноопа).конечным продуктом является ацетил-КоА (Линен).
Окислению по − α −углеродному атому подвергаются длинноцепочечные жирные кислоты (в основном в нервной ткани) и разветвленные экзогенные кислоты. Этот путь окисления не связан с синтезом АТФ.
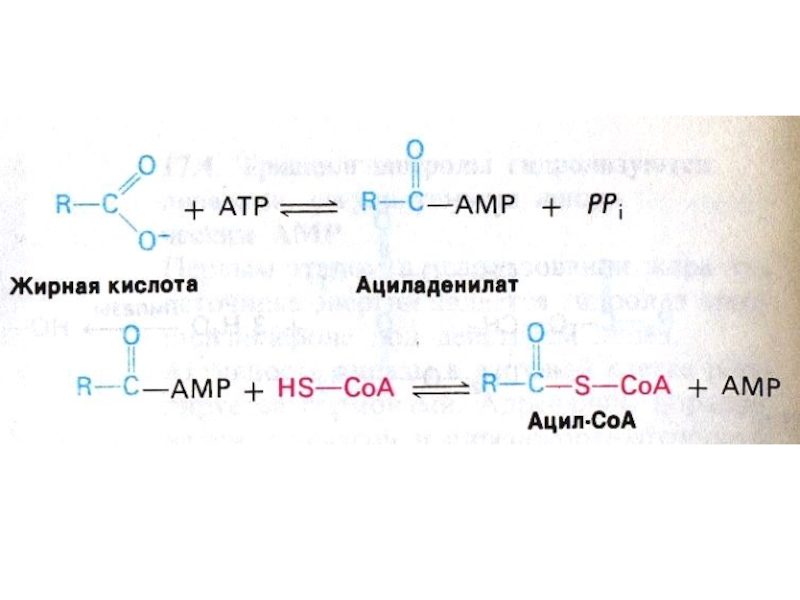
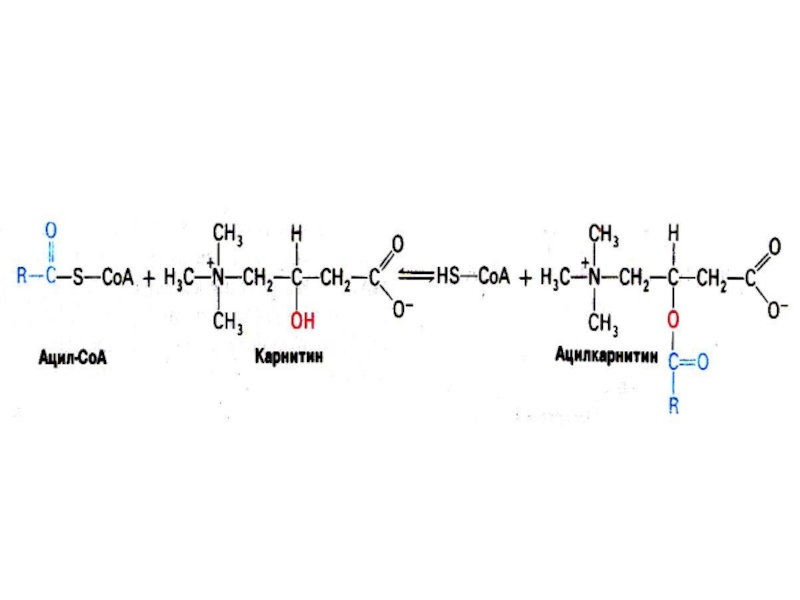
Слайд 28Активация и транспорт жирных кислот
На наружной мембране митохондрий ацил- Коа
синтетаза :
R- СООН + АТФ + HS -КоА ? ацил
–КоА + АМФ +РРн .(через стадию образования ациладенилата).
Короткие (С<9) жирные кислоты способны проникать через внутреннюю митохондриальную мембрану, транспортером длинноцепочечных жирных кислот является карнитин (витаминоподобное вещество, одноатомный спирт. производное метионина и лизина).
Этап преодоления жирными кислотами этого барьера определяет скорость их окисления в митохондриях.
С внутренней мембраной МХ ассоциированы ацилКоА-карнитинтрансфераза I и карнитин-КоА трансфераза II , образующие эфиры жирных кислот с карнитином на внешней стороне и с КоА – на внутренней стороне мембраны. Мембрану ацилкарнитин преодолевает с помощью специфических транслоказ.
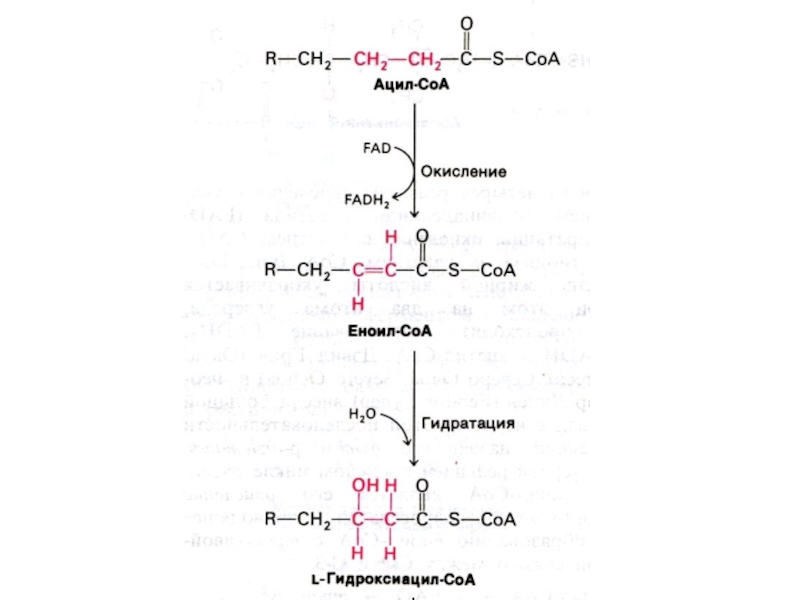
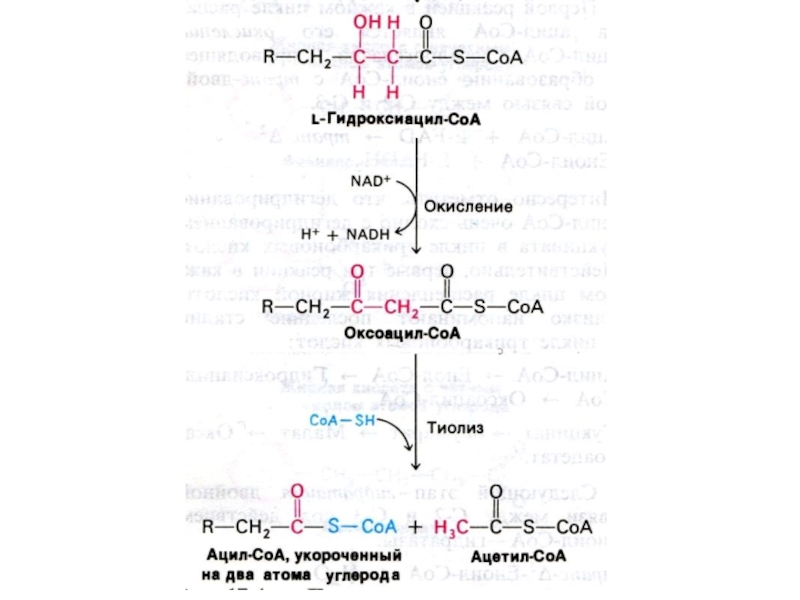
Слайд 31Механизм реакций β −окисления жирных кислот.
Ступенчатый процесс последовательно повторяющихся
4-х реакций. С участием ФАД- и НАД- зависимых дегидрогеназ происходит
отщепление 2-х углеродного фрагмента (ацил-КоА).
На следующем этапе ацил-КоА окисляется в ЦТК.
Слайд 34Особенности окисления жирных кислот:
С нечетным числом атомов:
3-х углеродный остаток (пропионил-КоА)
карбоксилируется до сукцинил-КоА, поступающий в ЦТК.
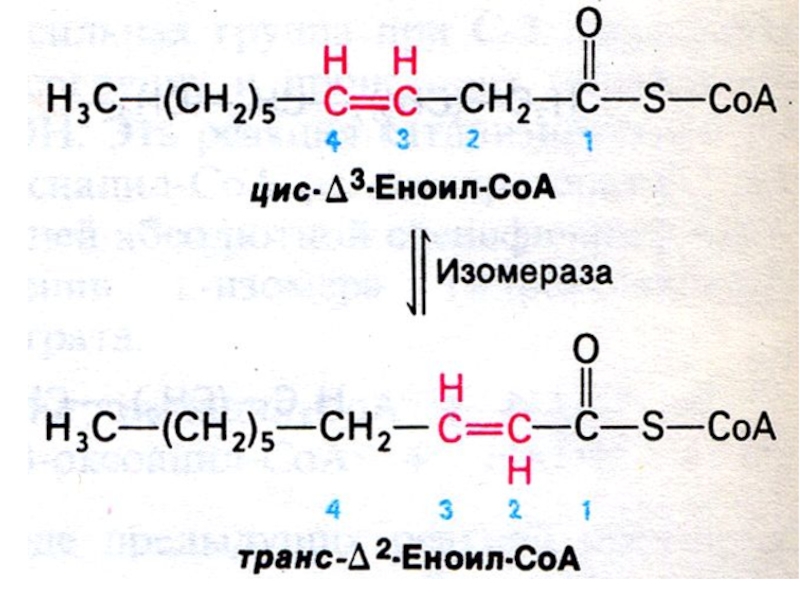
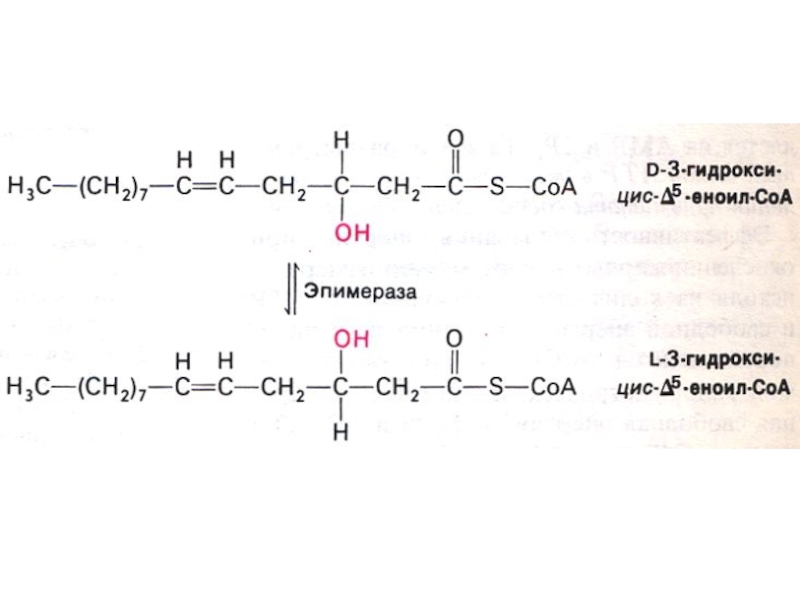
С двойными связями (ненасыщенные):
Требует участия
дополнительных ферментов: Δ3,4 – цис –Δ2,3 – транс- изомеразы (переносит двойную связь) и эпимеразы (Д изомер превращает в L изомер).
Слайд 37Энергетика окисления жирных кислот
Каждый этап β –окисления сопровождается образованием ФАДН2
и НАДН (реокисление их в дыхательной цепи приводит к синтезу
2 и 3 АТФ).
Этапов β – окисления: (n/2)-1,где: n – число С- атомов в жирной кислоте.
Окисление ацетил-КоА в ЦТК в конечном итоге приводит с образованию 12 АТФ.
1 АТФ затрачивается на активацию жирной кислоты.
Т.о. окисление пальмитиновой кислоты имеет энергетический выход – 130 АТФ.
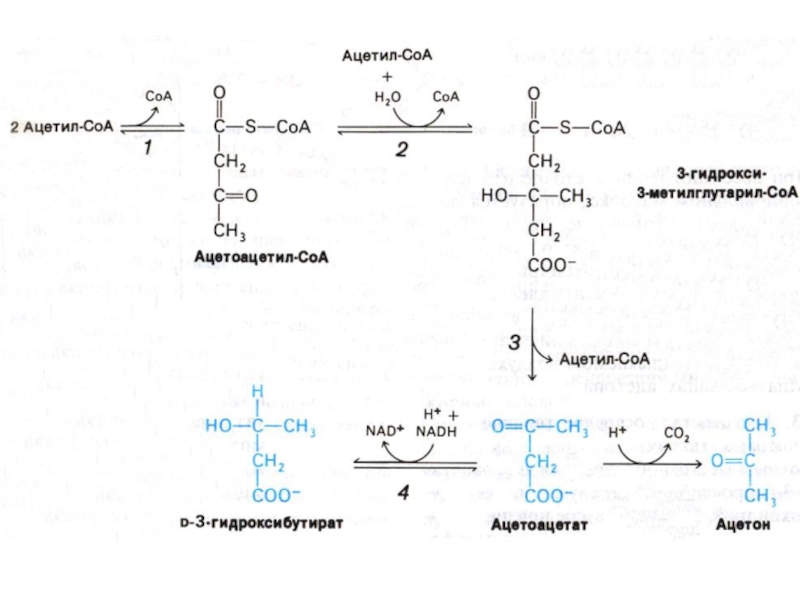
Слайд 38КЕТОГЕНЕЗ
Избыточное образование ацетил-КоА или снижение его утилизации в ЦТК (причины!)
приводит к активации кетогенеза в митохондриях гепатоцитов (печень перераспределяет недоокисленные
продукты на энергетические нужды других органов.
Конденсация ацетильных фрагментов приводит к образованию β− гидроксиметил-глутарил-КоА, а затем кетоновых тел: ацетона, гидроксибутирата и ацетоацетата.
В норме концентрация кетоновых тел в крови низкая, при голодании, диабете она увеличивается до 100 раз. При дефиците глюкозы мозг активно потребляет кетоновые тела. Почки, миокард, скелетные мышцы также используют их как источники энергии.
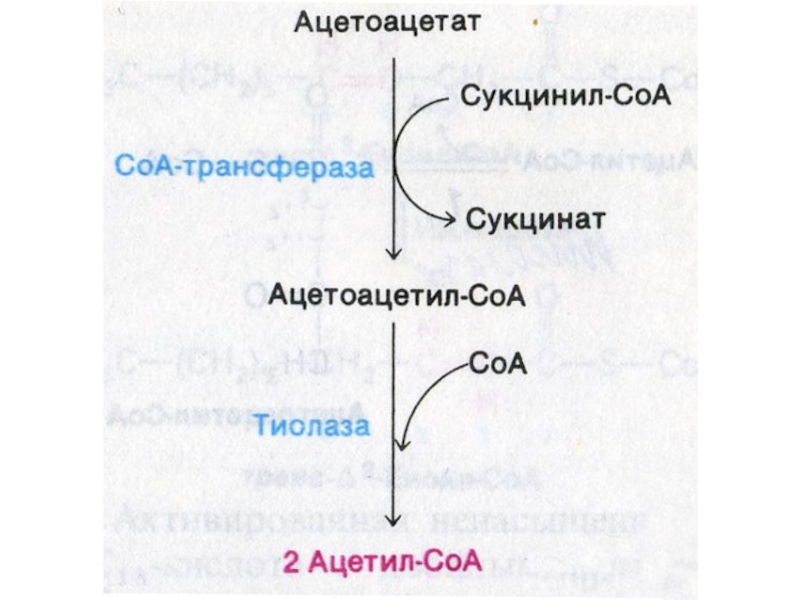
Слайд 40Окисление кетоновых тел
Печень не способна утилизировать кетоновые тела.
В периферических
тканях гидроксибутират окисляется до ацетоацетата.
Далее ацетоацетат активируется КоА (с помощью
сукцинил-кетоацил- трансферазы).
Ацетоацетил-КоА тиолазой расщепляется до 2-х молекул ацетил-КоА и окончательно окисляется в ЦТК.
Токсичный ацетон удаляется с потом, мочой, выдыхаемым воздухом.
Слайд 42Липогенез
Абсорбтивный период. Инсулин.
Ресинтез собственных жиров на основе продуктов гидролиза экзогенного
жира в энтероцитах (этерификация 2- МАГ олеил-КоА).
Этерификация диоксиацетонфосфата активированными жирными
кислотами и восстановление с участием НАДФН в печени.
Слайд 43ЛИПОГЕНЕЗ
Субстраты:
глицерол-3-фосфат (образуется глицеролкиназой в энтероцитах и нефроцитах из глицерина; из
диоксиацетонфосфата (НАДФН зависимая дегидрогеназа) в миоцитах и адипоцитах; В печени
активны оба фермента.
активные формы жирных кислот (ацилКоА).
Слайд 44Липогенез
Избыток глюкозы обеспечивает:
1. запас гликогена
2. ДАФ ?глицерол-3-фосфат
3. ПВК ? ацетил-КоА
? жирные кислоты
4. катаболизм глюкозы в пентозофосфатном пути обеспечивает биосинтез
липидов восстановленным эквивалентом НАДФН и энергией АТФ.
Слайд 45Биосинтез жирных кислот
Цитозоль. Ацилсинтетаза (пальмитоил-синтетаза). Не обращение β – окисления!
ацетил
– КоА
АТФ, НАДФН
СО2, витамин Н
цитрат
3 этапа: перенос ацетил-КоА из МХ
в цитоплазму; образование основного субстрата – малонил-КоА; наращивание жирнокислотной цепи.
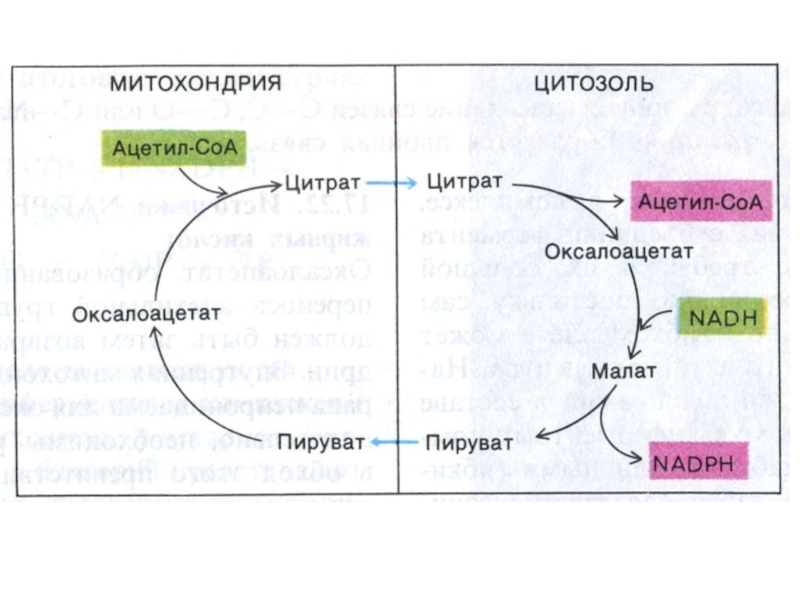
Слайд 47Транспорт ацетил-КоА в цитоплазму
В ситуации накопления АТФ и НАДН ингибируется
изоцитрат ДГ и накапливающийся цитрат выходит из МХ в цитозоль.
цитрат + НS-КоА ? Ацетил-КоА + ОА.
второй путь передачи ацетильных фрагментов – с участием карнитина.
Слайд 48Транспорт ацетил-КоА в цитоплазму
Возвращение ОА в МХ:
1.ОА –> малат
(НАД зависимая цитоплазматическая МДГ); Малат –транслоказа переносит малат в МХ,
где он окисляется МХ МДГ до ОА.
2. «Яблочный» фермент (МДГ декарбоксилирующая, НАДФ-зависимая):
малат? ПВК (образование НАДФН, необходимого для биосинтеза липидов).
ПВК переносится транслоказой в МХ.
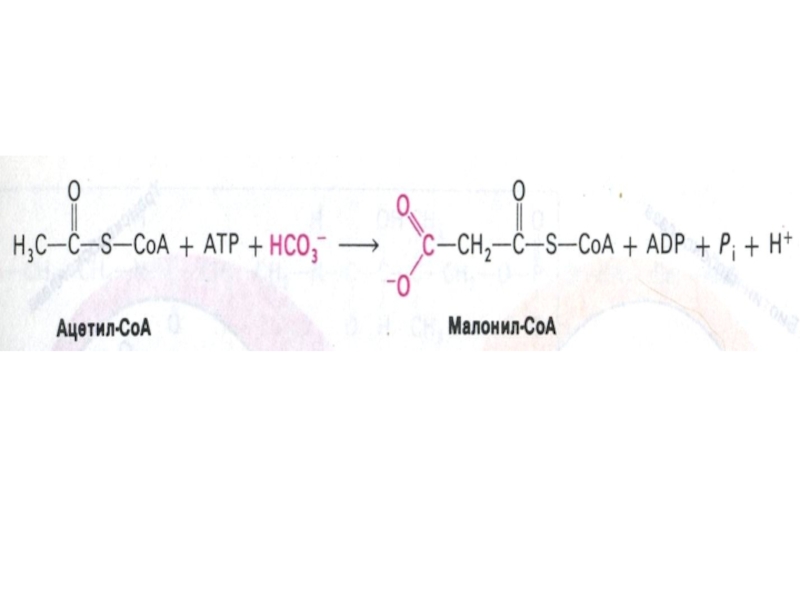
Слайд 50Образование малонил-КоА
ацетил-КоА- карбоксилаза (биотин-зависимая) – регуляторный фермент синтеза жирных кислот.
активная форма –нефосфорилирована (в присутствии инсулина, цитрата);
неактивная форма – фосфорилирована
(в присутствии глюкагона, адреналина, малонил-КоА, пальмитоил-КоА)
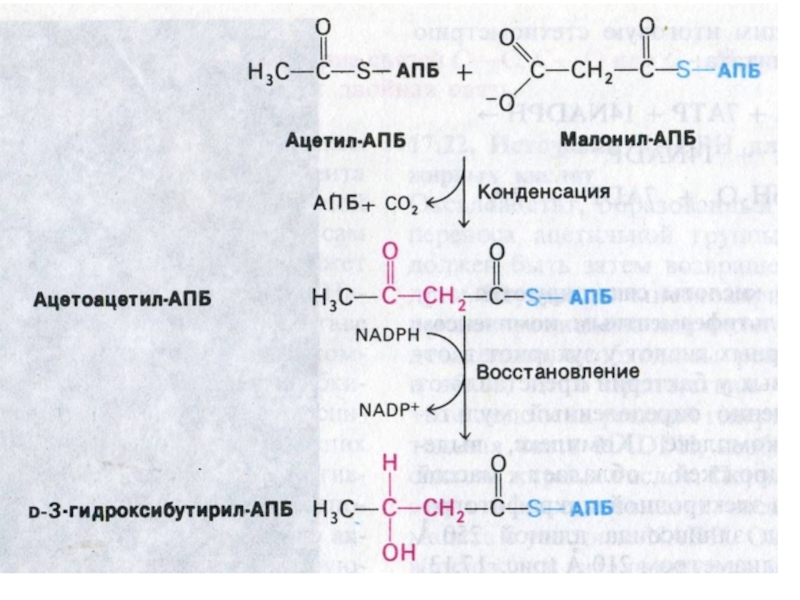
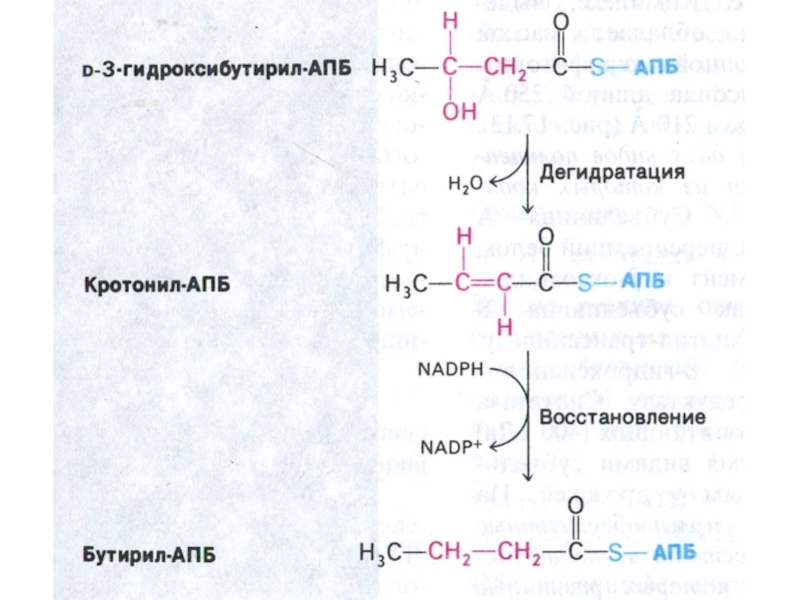
Слайд 51Синтетаза жирных кислот
мультиферментный комплекс (гомодимер, поэтому синтезируется две цепи одновременно).
6
ферментов и АПБ (2 SH- группы).
Ацетил-КоА – SАПБ –трансфераза
малонил-КоА
– SАПБ – трансфераза
кето-ацил-АПБ-синтетаза
кето-ацил-АПБ-редуктаза (НАДФН)
гидроксиацил-АПБ-дегидратаза
эноил-АПБ-редуктаза (НАДФН)
Тиоэстераза гидролитически отщепляет готовый продукт от синтетазного комплекса (в основном – пальмитат, в молочной железе – и короткие жирные кислоты)
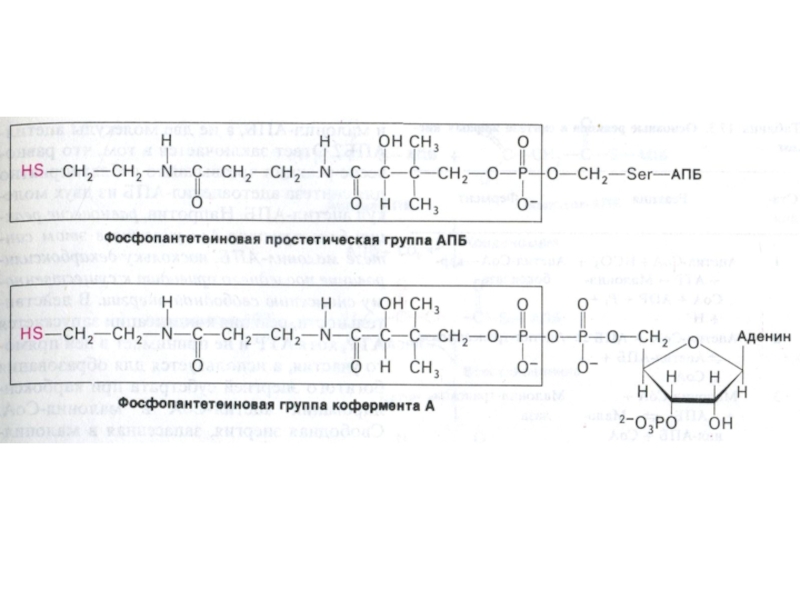
Слайд 53АПБ – структура и функция
Активный центр этого белка – фосфопантотеновая
кислота и тиоэтиламин (аналогичные структуре HS – КоА), ковалентно связанные
с белком.
Функция АПБ – ковалентно связывать и передавать от одного фермента к другому ацильные фрагменты.
Связь ацильных остатков с АПБ – тиоэфирная, с SH группой цистеина АПБ или SH - тиоэтиламина.
Слайд 56Пальмитоил- синтетаза
Ацетил-КоА + 7 малонил-КоА + 14 НАДФН ?C16:0 +
7 СО2 +SH-АПБ + 14 НАДФ+ + 6Н2О.
Удлинение ацильной цепи
м.б. в ЭПС (с участием малонил-КоА и НАДФН) или в МХ (как обращение β –окисления).
Синтез ацильных цепей с нечетным числом атомов начинается с пропионил-КоА (вместо ацетил-КоА).
Реакция десатурации (оксигеназа микросом) приводит к образованию мононенасыщенных пальмитоолеиновой и олеиновой кислот.
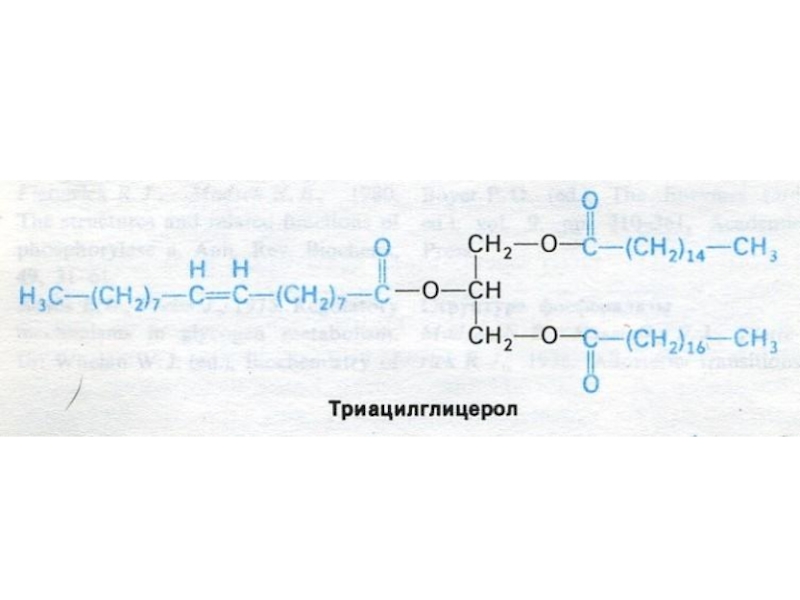
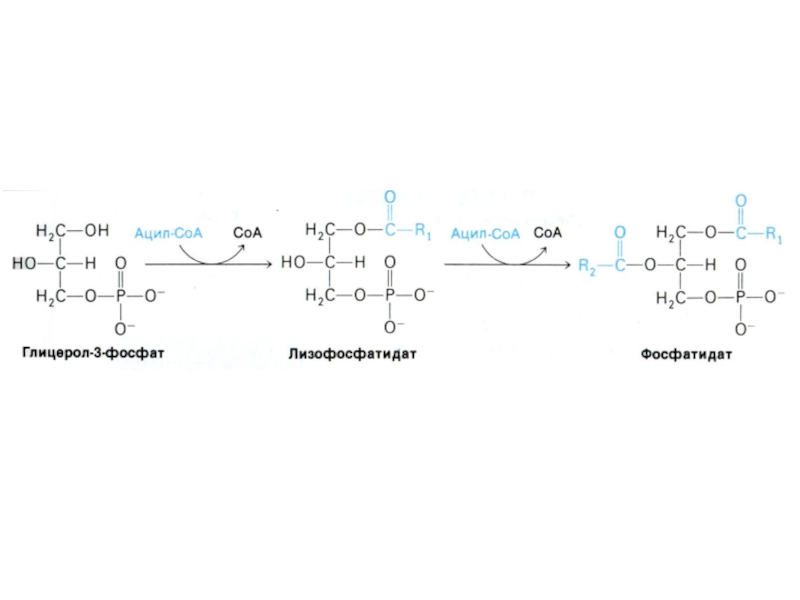
Слайд 57Синтез триацилглицеролов
Ацил-КоА- синтетаза активирует жирные кислоты с затратой АТФ через
стадию образования ацил-аденилатов.
Перенос ацилтрансферазой активированных жирных остатков на глицерол-3 фосфат.
1,2-
диацилглицерол-3 – фосфат (фосфатидная кислота) – общий предшественник для биосинтеза нейтральных жиров и фосфолипидов.
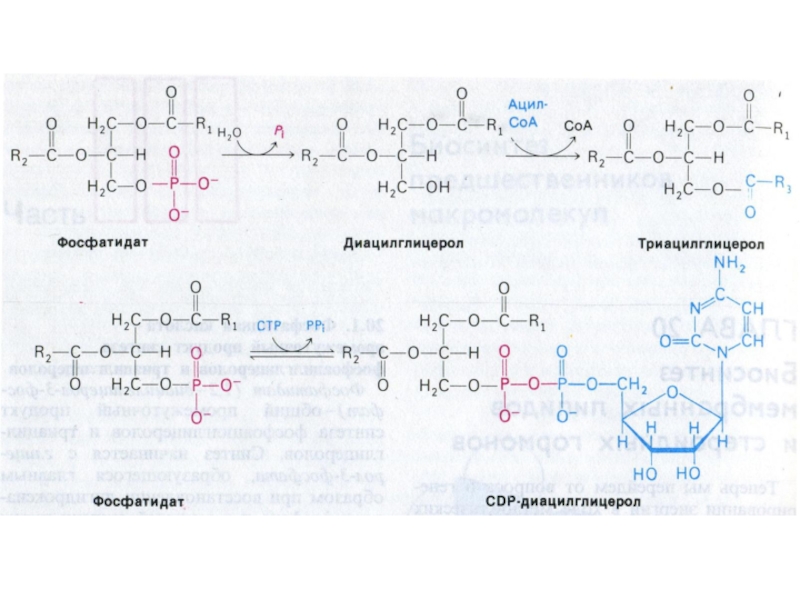
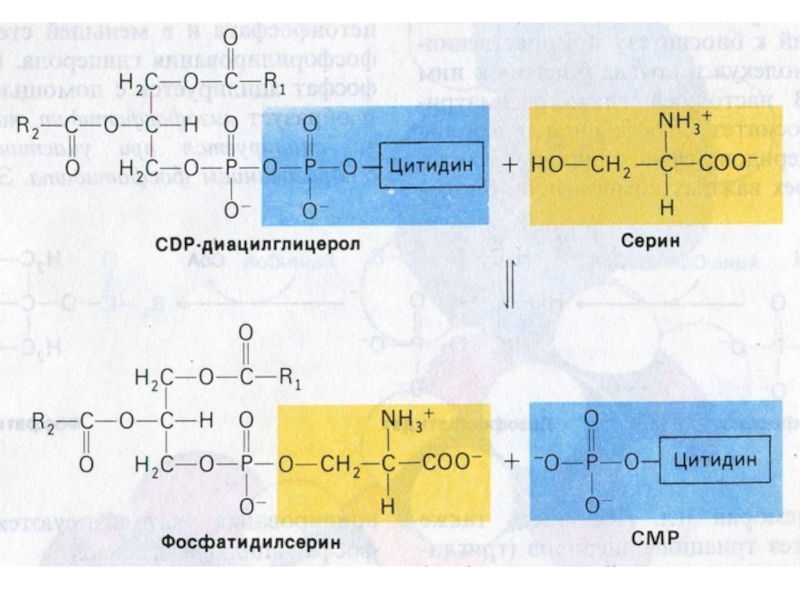
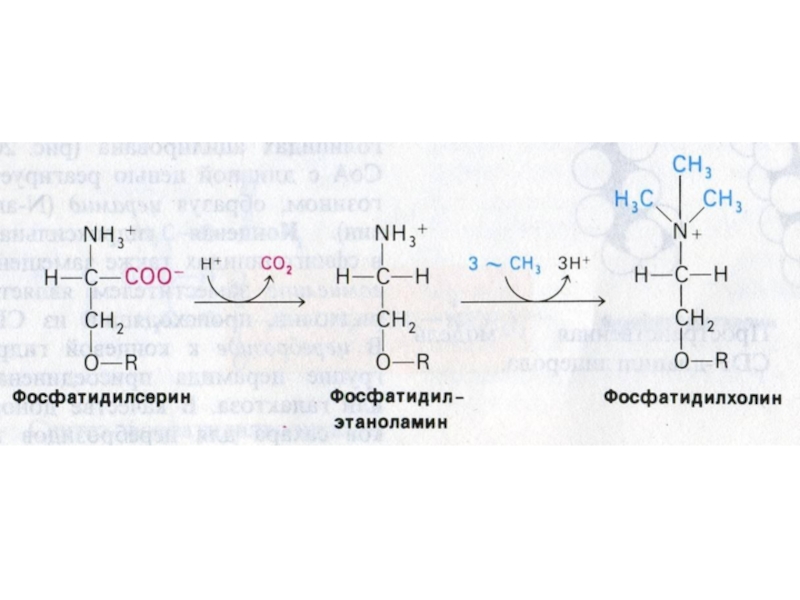
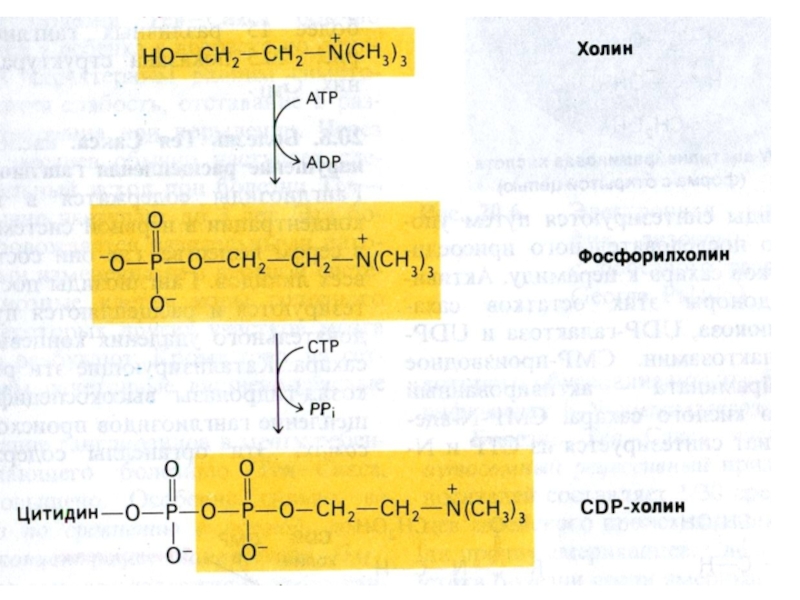
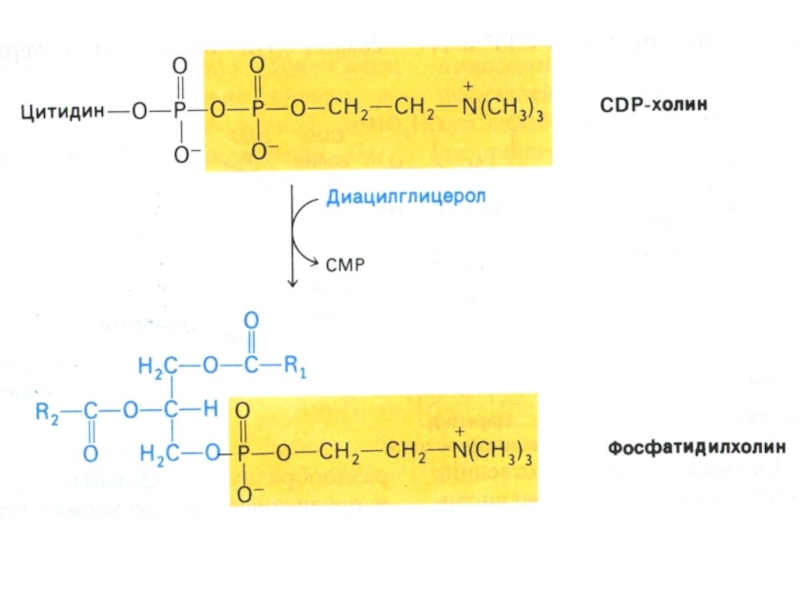
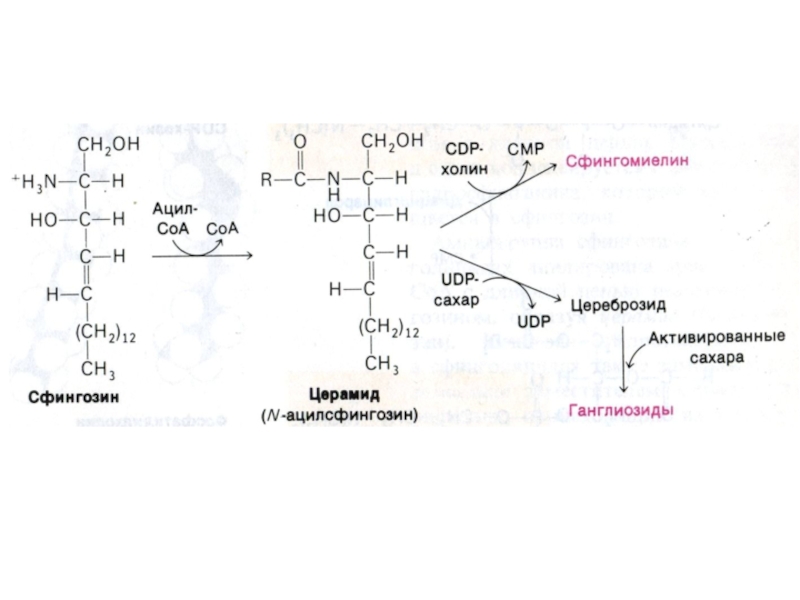
Слайд 60Синтез фосфолипидов
Синтез ТАГ и ФЛ конкурируют за общие субстраты для
собственного синтеза (фосфатидная кислота).
Синтез ФЛ требует участия ЦТФ, а также
серина, метионина (SАМ), холина.
2 пути синтеза ФЛ: активация 1,2 – диацилглицерола с участием ЦТФ или активация этаноламина, холина.
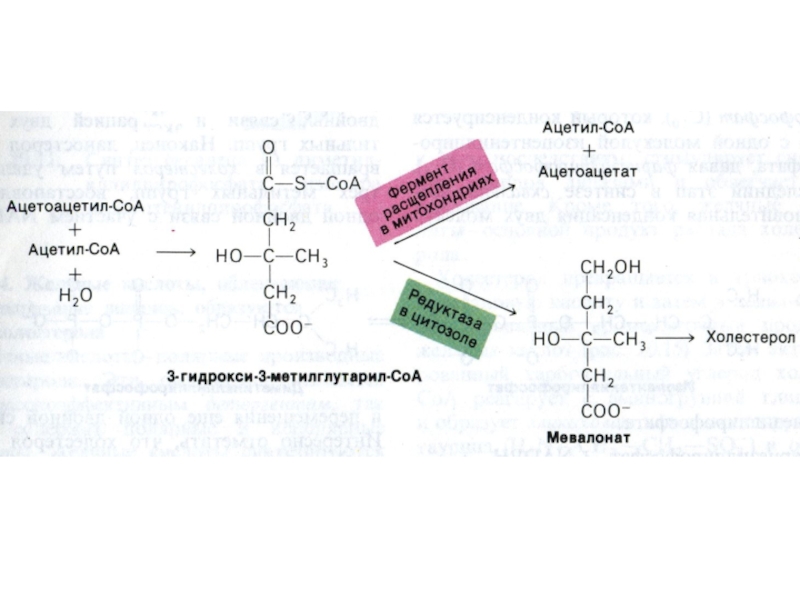
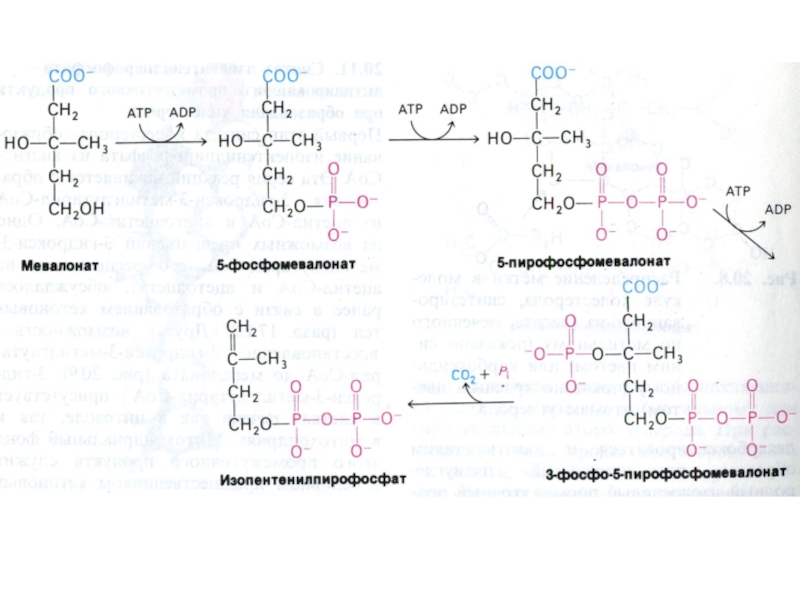
Слайд 67Синтез холестерола
1.Конденсация 3-х ацетил-КоА ?гидроксиметилглутарил –КоА
2. восстановление НАДФН-редуктазой? мевалоновая
кислота
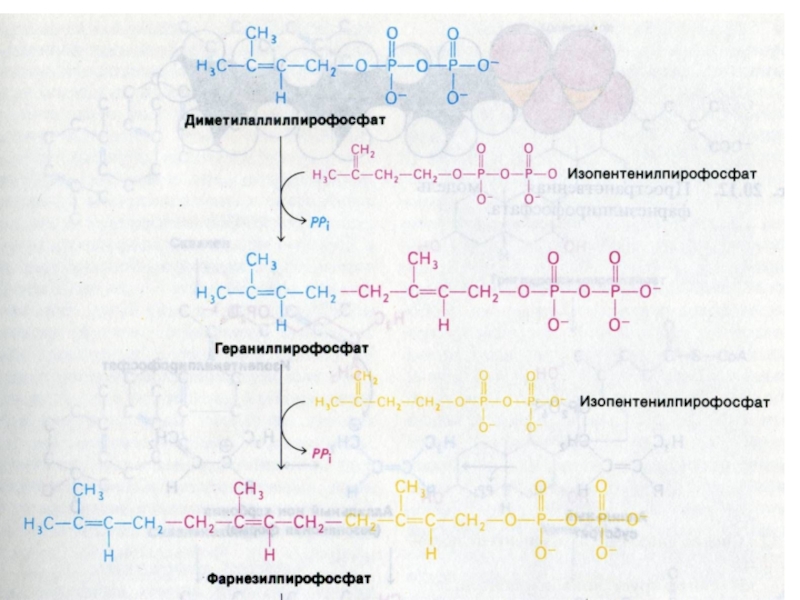
3. фосфорилирование и декарбоксилирование? образование С5- активных изопренов
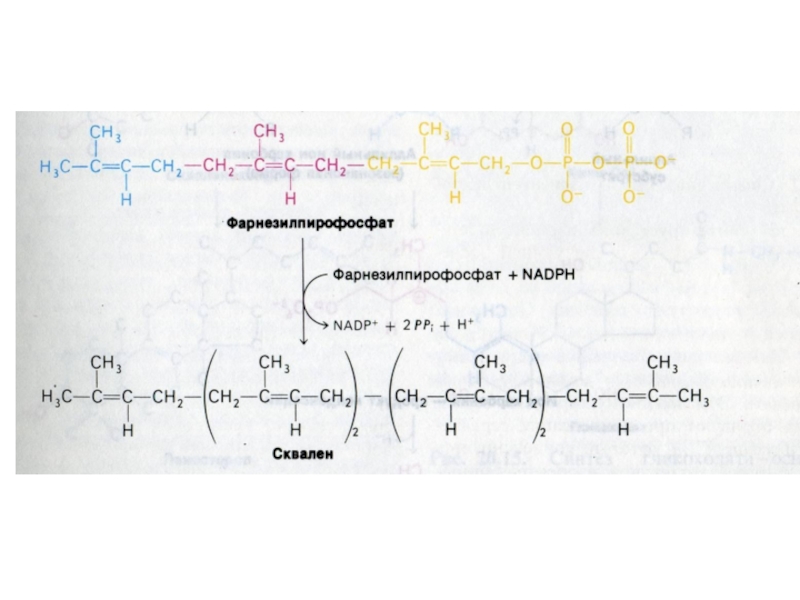
4. конденсация 5
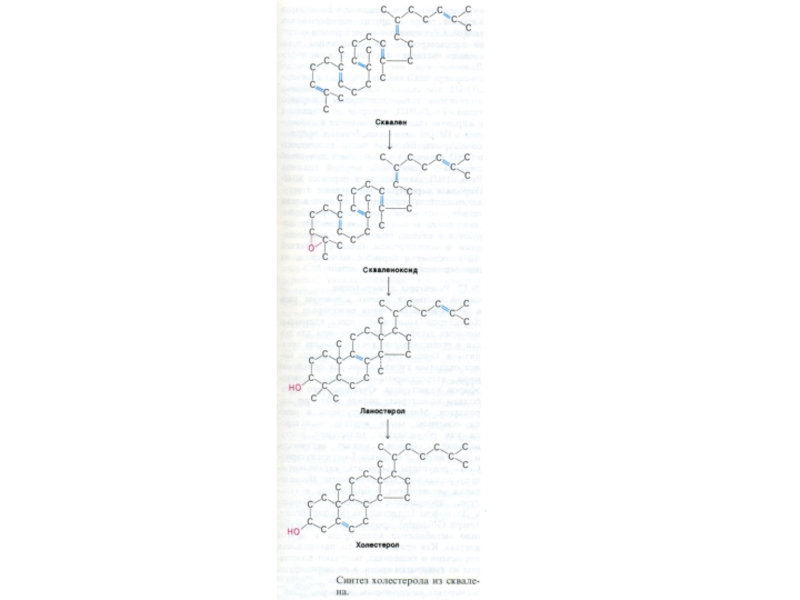
С углеродных звеньев ? сквален (30 С линейный продукт)
5. микросомальная эпоксидация? образование циклопентанпергидрофенантрена - ланостерола (С 30)
6. Удаление 3 СН3 и восстановление двойных связей ? холестерол
Слайд 68Метаболизм холестерола
0,5 г эндогенного и 0,5 г экзогенного ХЛ
10% ХЛ
находится в виде эфиров с жирными кислотами (форма депонирования и
транспорта); в мембранах клеток – свободный ХЛ.
Этерификация происходит в гепатоцитах (АХАТ) и ЛПВП (ЛХАТ).
Экзогенный ХЛ не подвергается изменению в кишечнике, всасывается в составе мицелл.
Выводится ХЛ из организма в составе желчи (желчные кислоты и свободный ХЛ).
Слайд 74Транспортные формы ХЛ
Экзогенный ХЛ транспортируется в составе хиломикронов, ремнантные формы
которых поглощаются печенью.
Эндогенный ХЛ, образующийся в печени после этерификации,
уходит в кровь в виде ЛПОНП.
Отдавая жирные кислоты клеткам, ЛПОНП?ЛППП?ЛПНП (атерогенные формы ЛП).
Обратный транспорт ХЛ в печень осуществляют антиатерогенные ЛПВП.