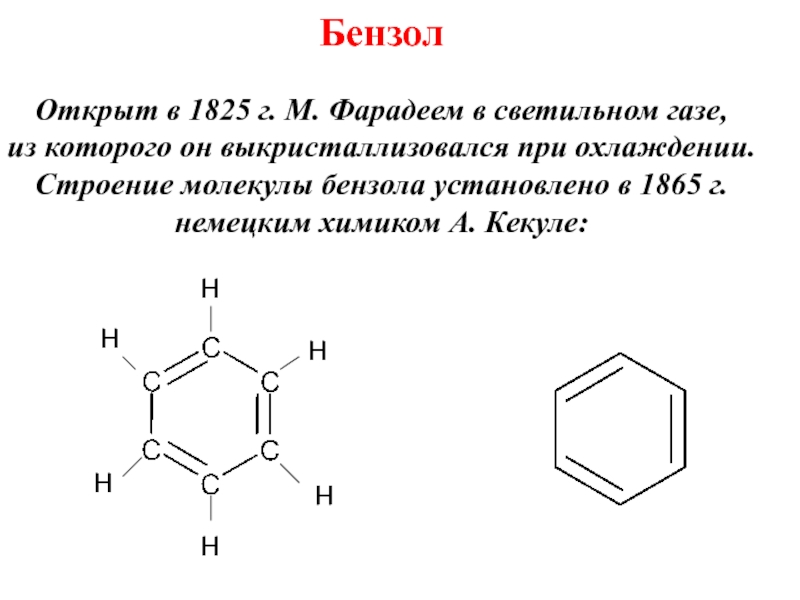
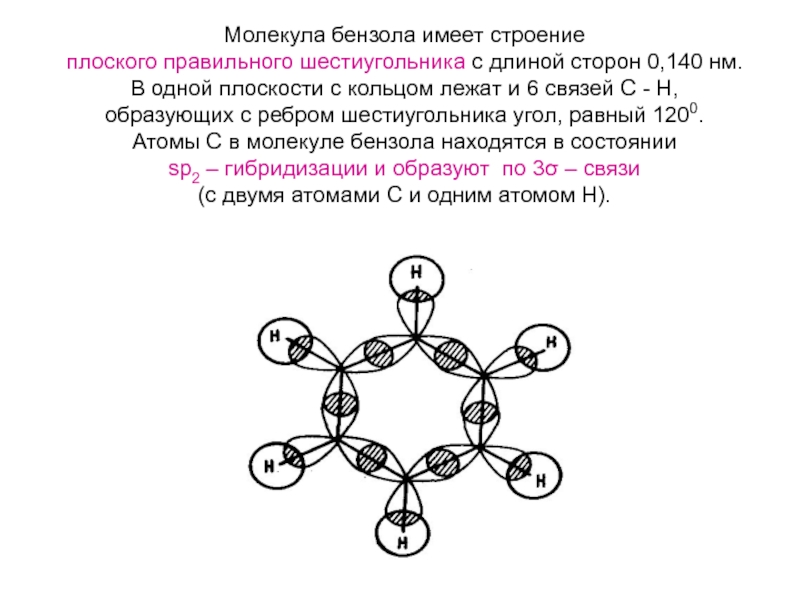
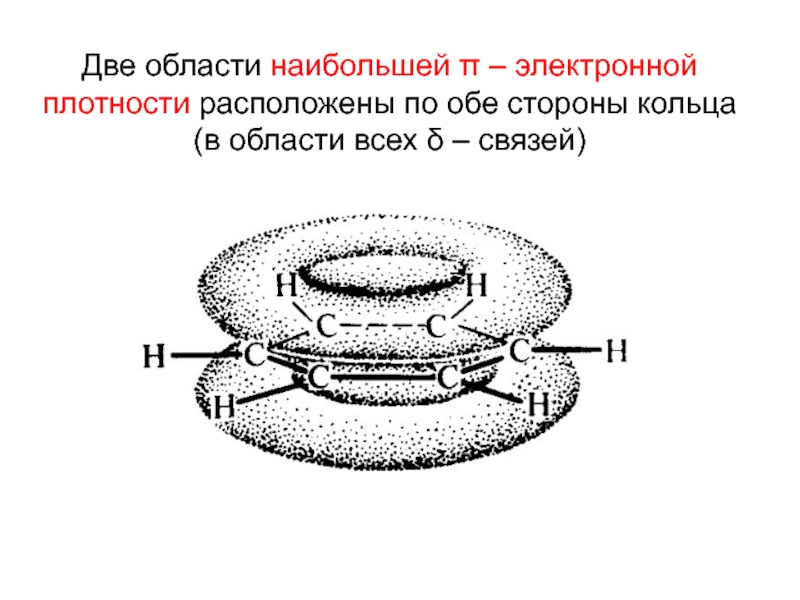
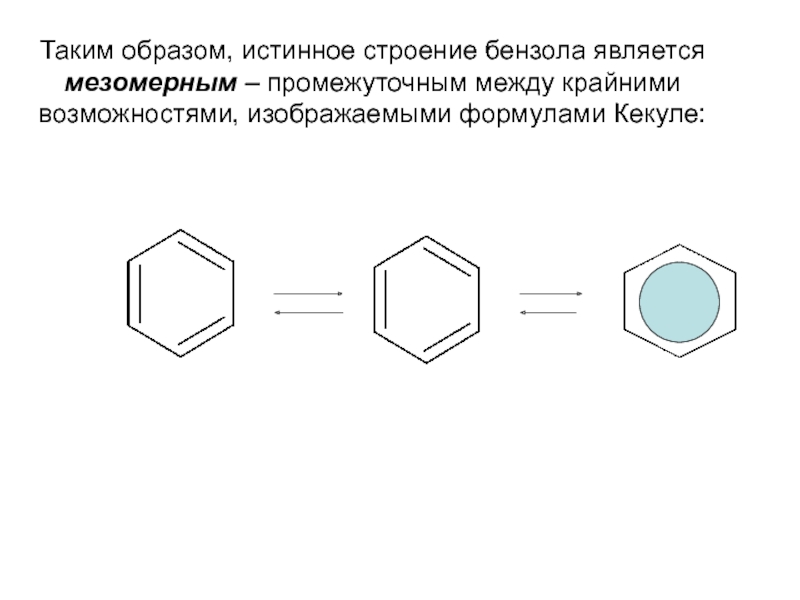
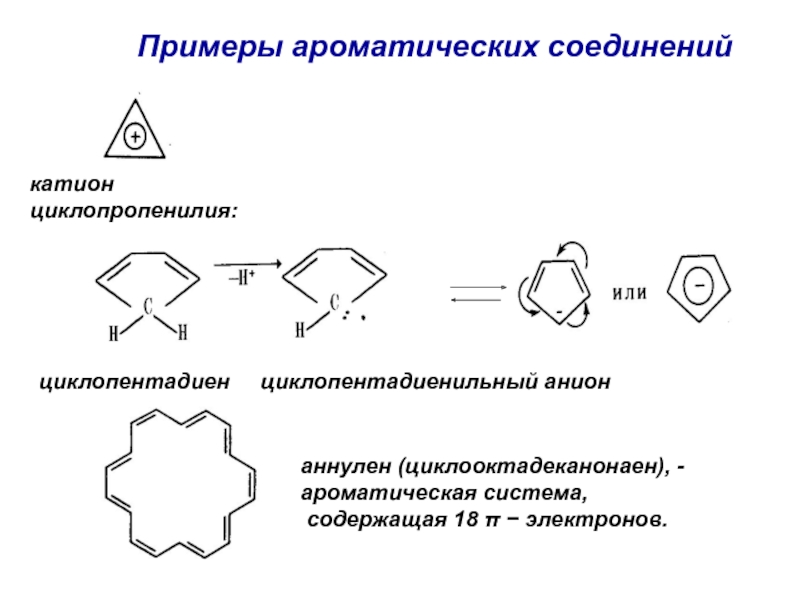
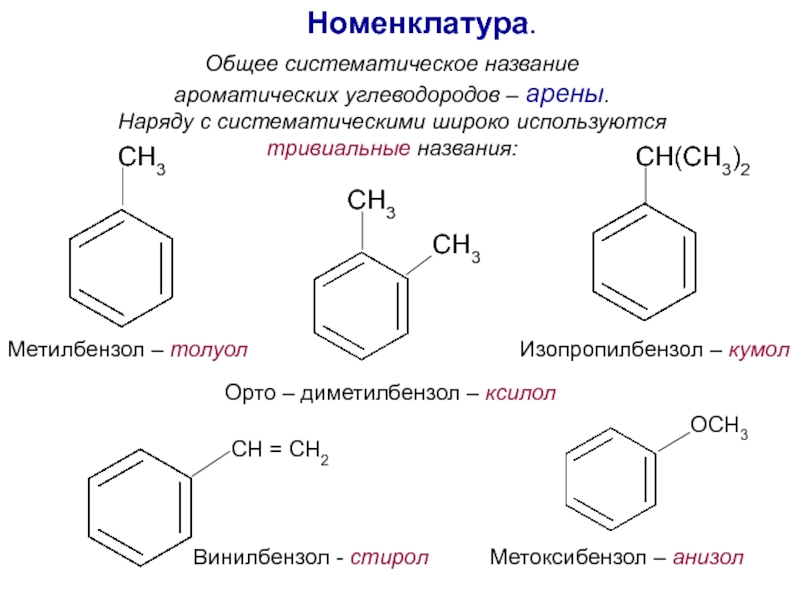
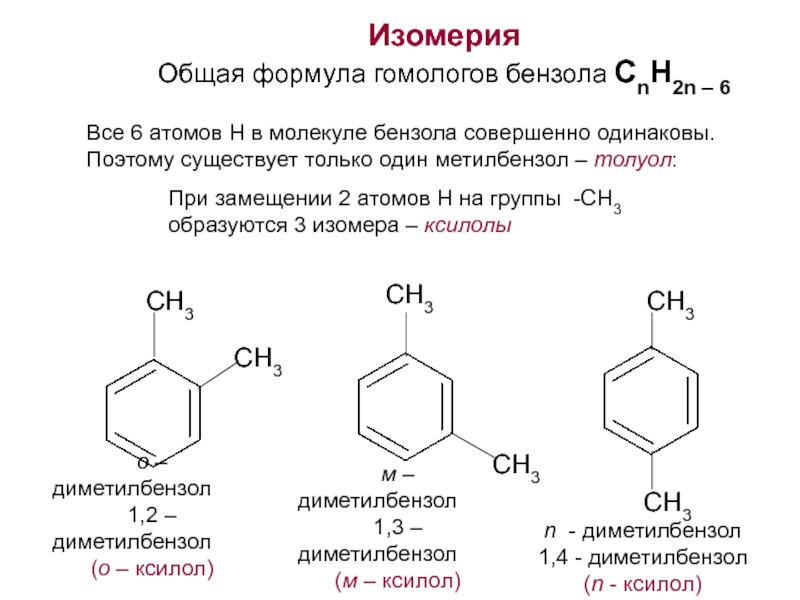
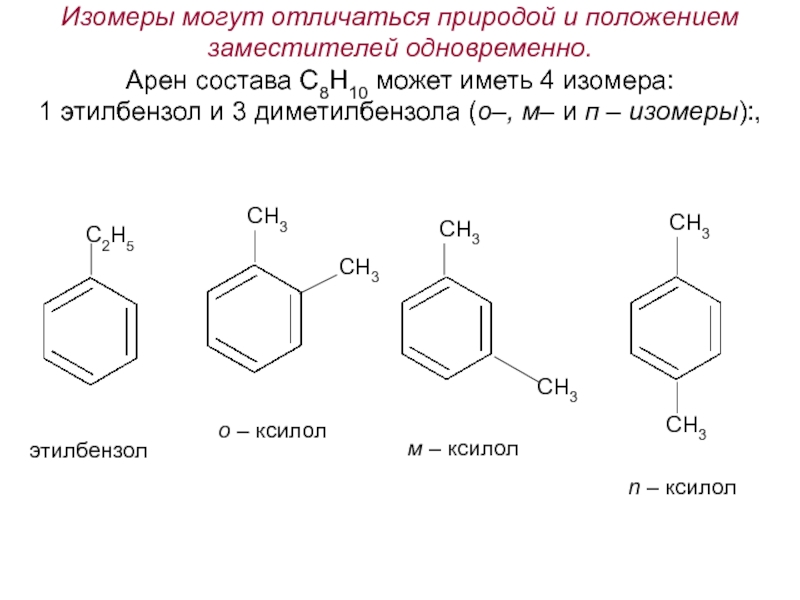
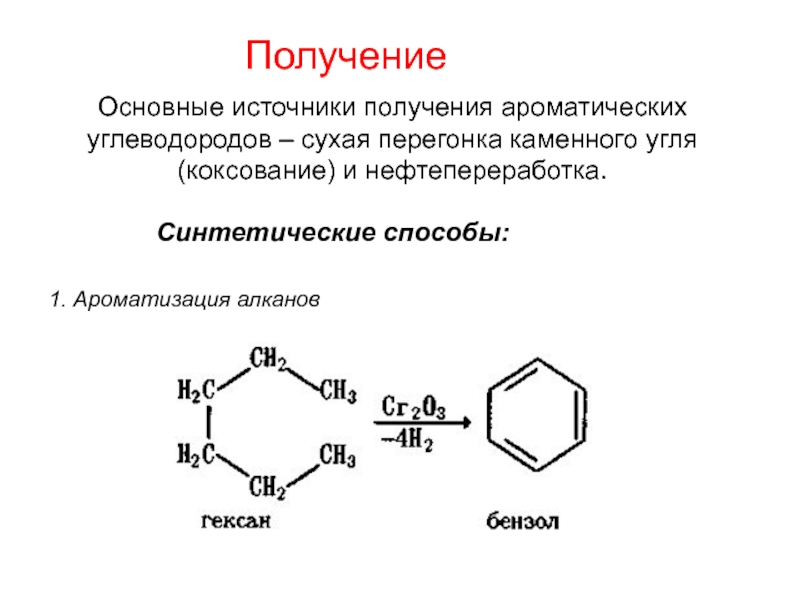
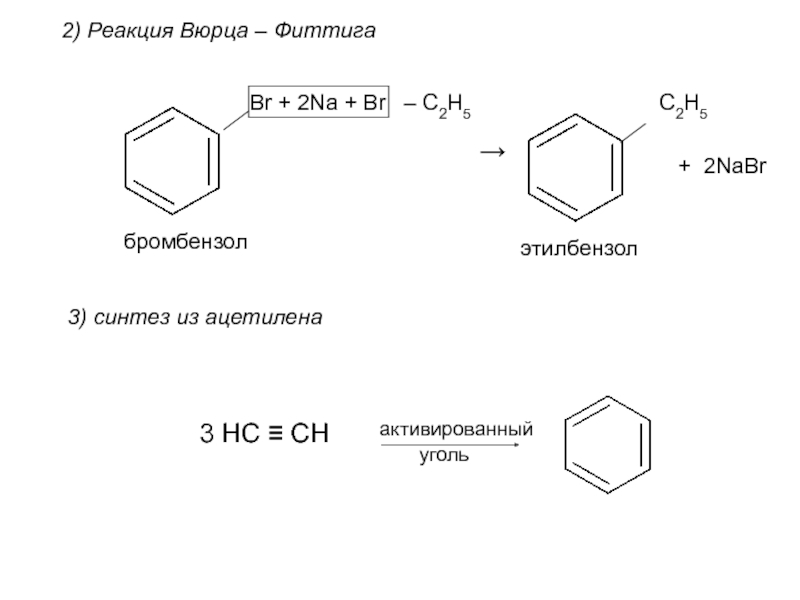
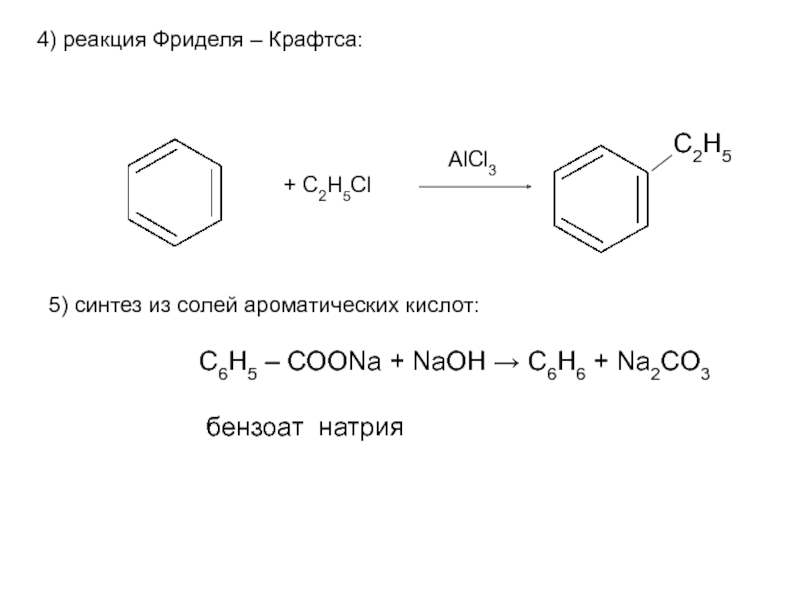
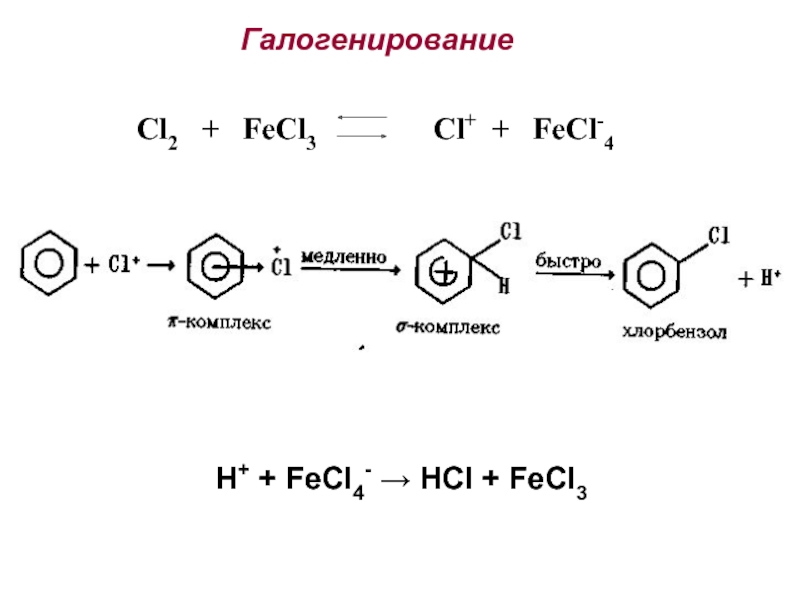
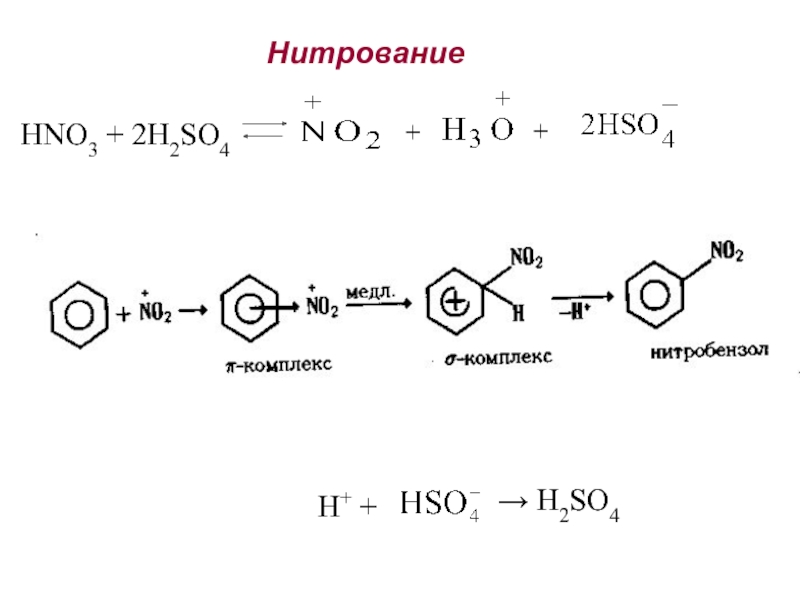
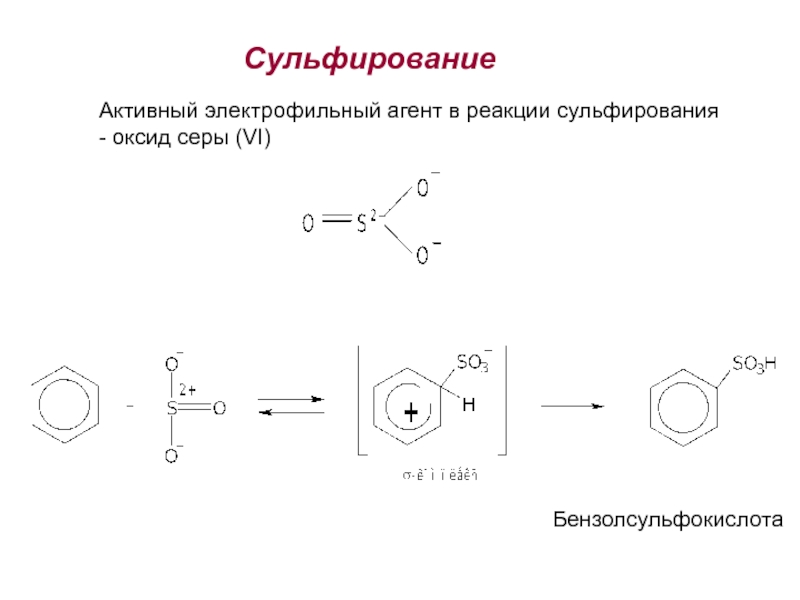
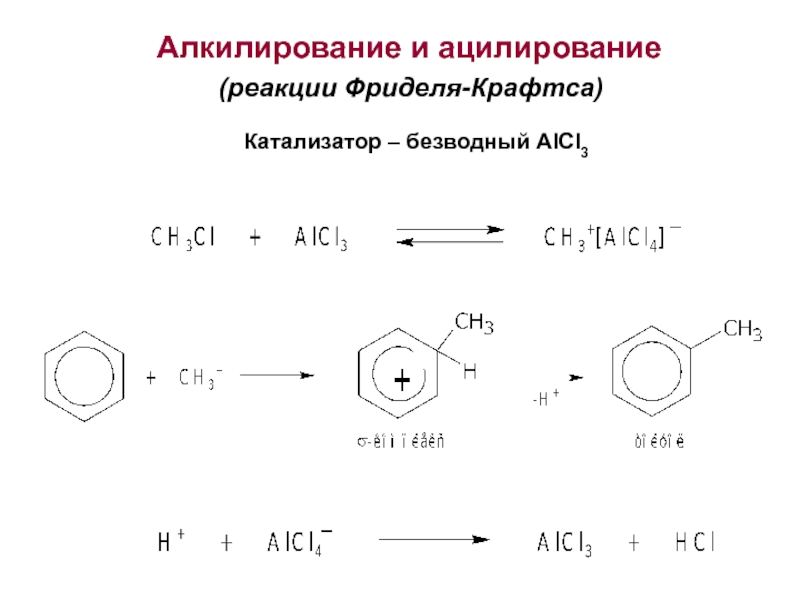
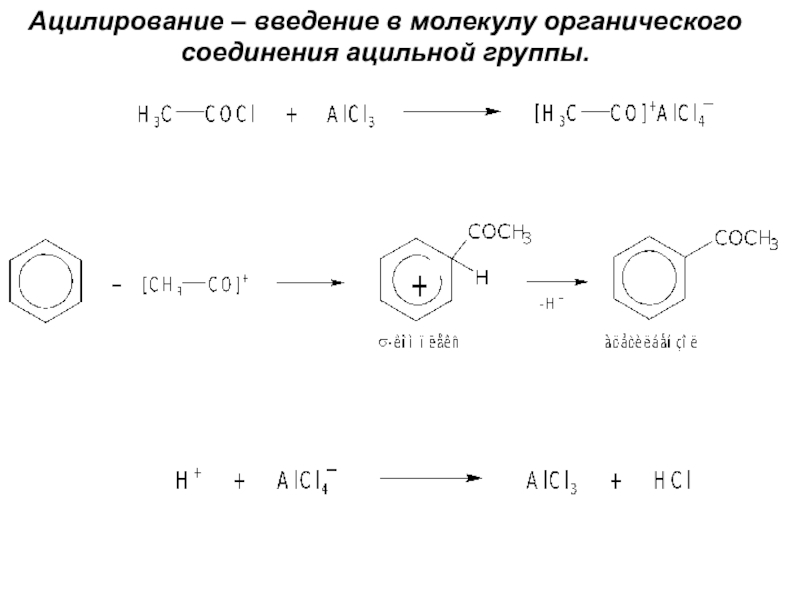
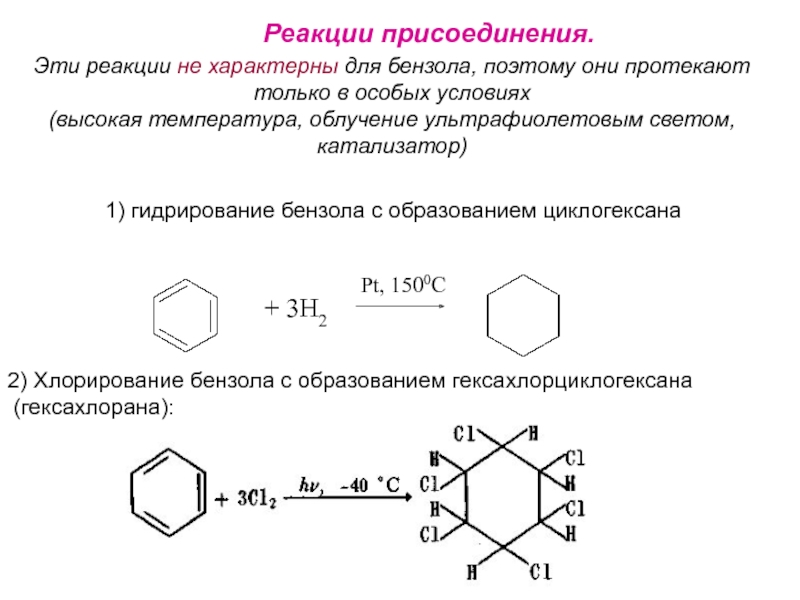
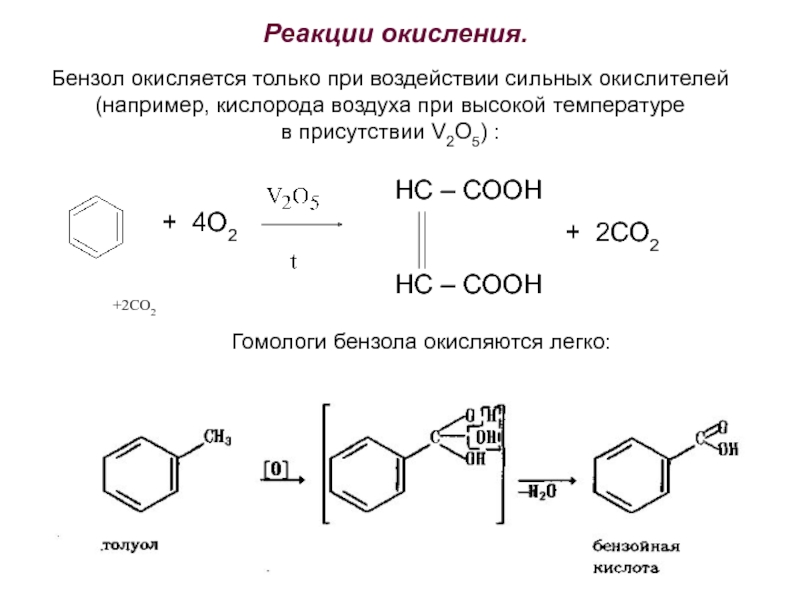
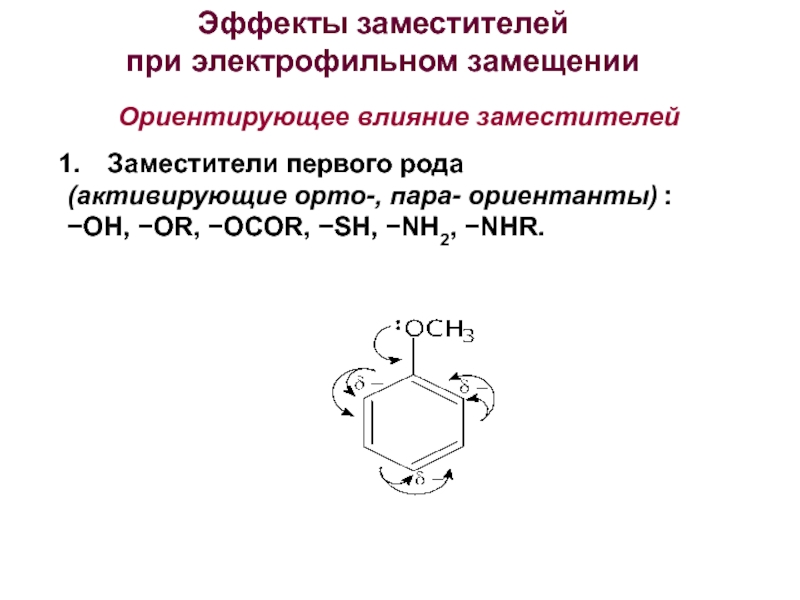
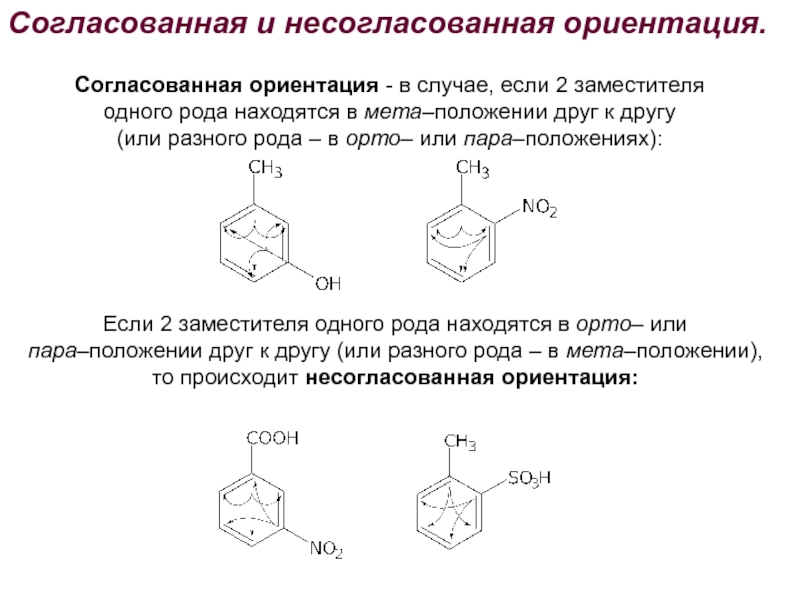
Номенклатура. Изомерия.
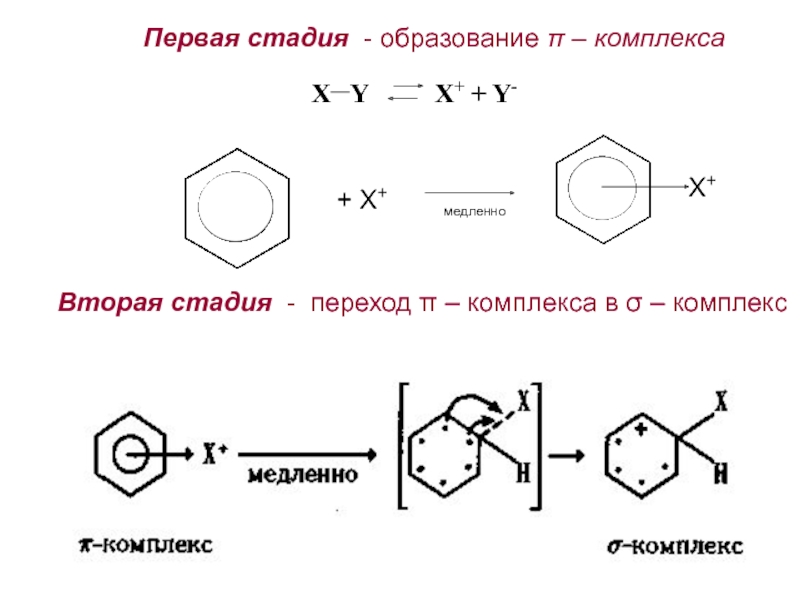
2. Способы получения. Физические и химические свойства. Механизм
электрофильного замещения. Правила ориентации заместителей в бензольном ядре.3. Химические свойства и применение важнейших производных бензола. Полициклические арома-тические углеводороды.