Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкины
Содержание
- 1. Алкины
- 2. АлкиныАлкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь.СnН2n-2
- 3. АлкиныНоменклатура и изомериябутин-1(этилацетилен) бутин-2(диметилацетилен) 2-метилпентен-1-ин-4 Изомерия:Структурная.,По положению тройной связи.Оптическая
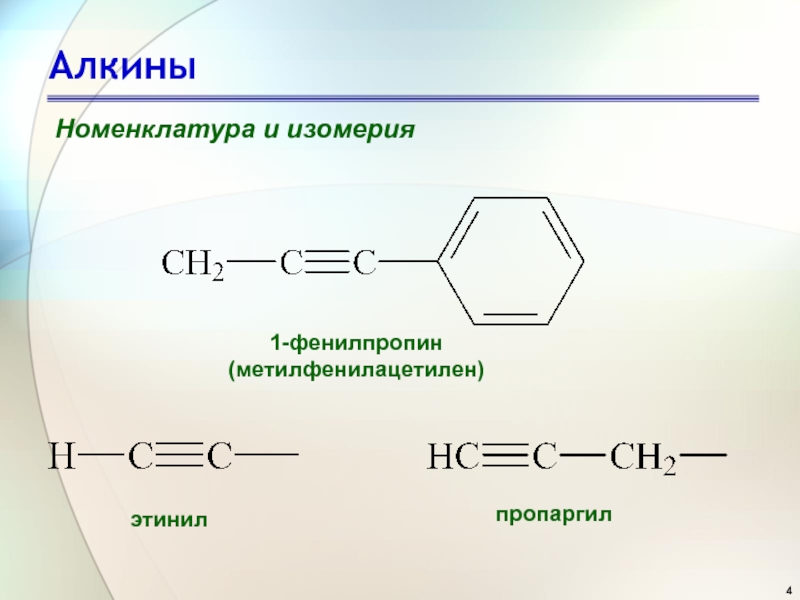
- 4. АлкиныНоменклатура и изомерия1-фенилпропин(метилфенилацетилен) этинил пропаргил
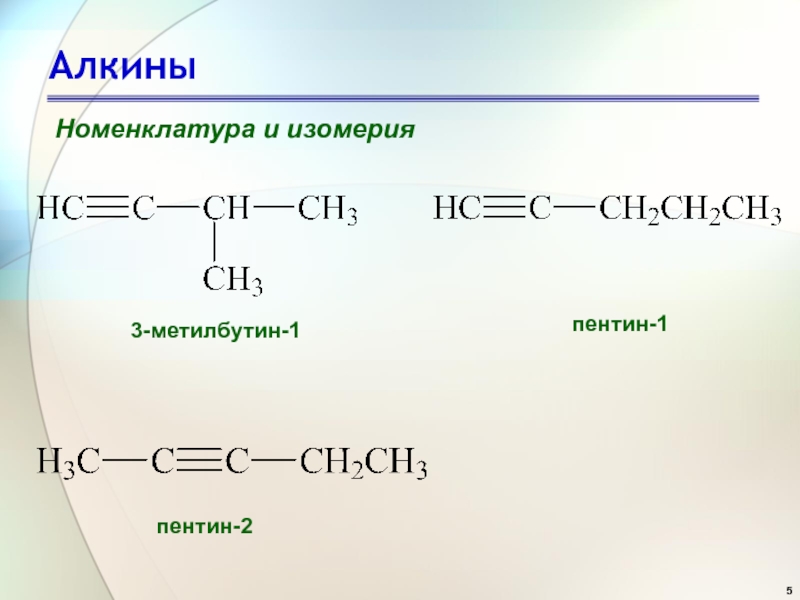
- 5. АлкиныНоменклатура и изомерия3-метилбутин-1 пентин-1 пентин-2
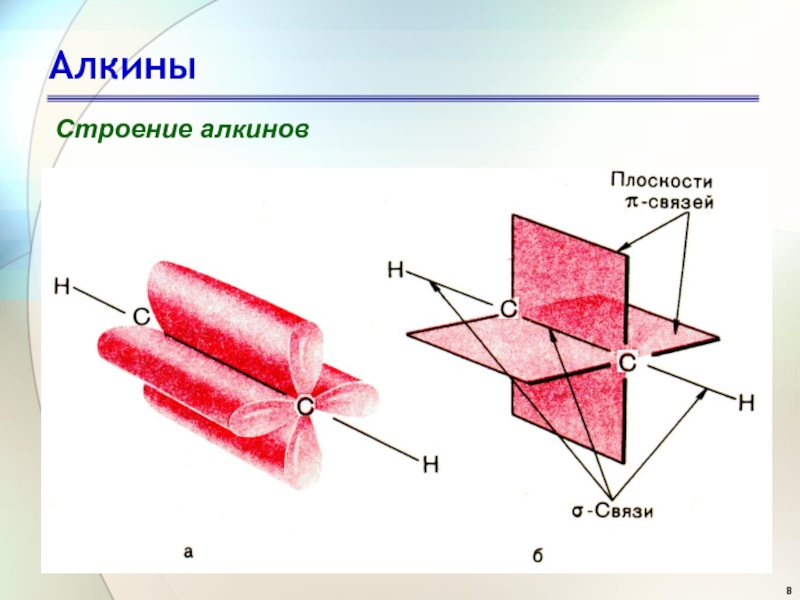
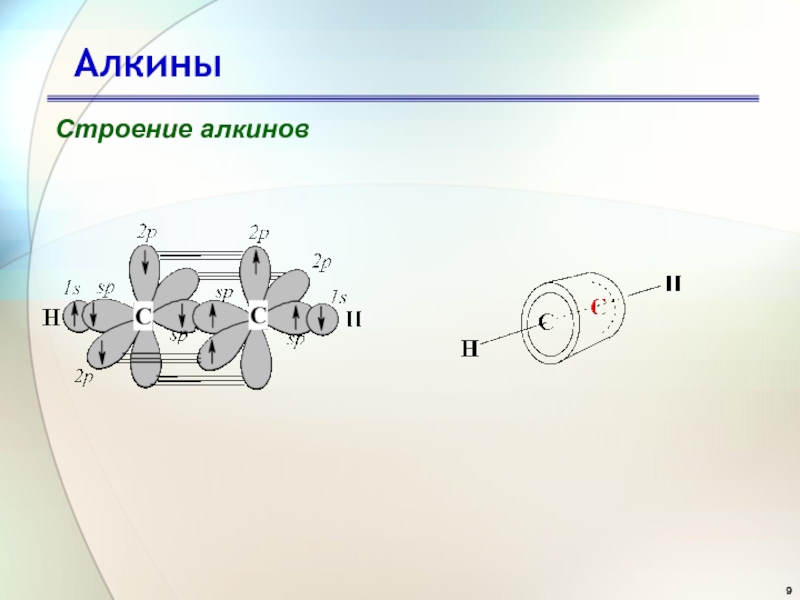
- 6. АлкиныСтроение алкиновацетилен(этин)
- 7. АлкиныСтроение алкинов
- 8. АлкиныСтроение алкинов
- 9. АлкиныСтроение алкинов
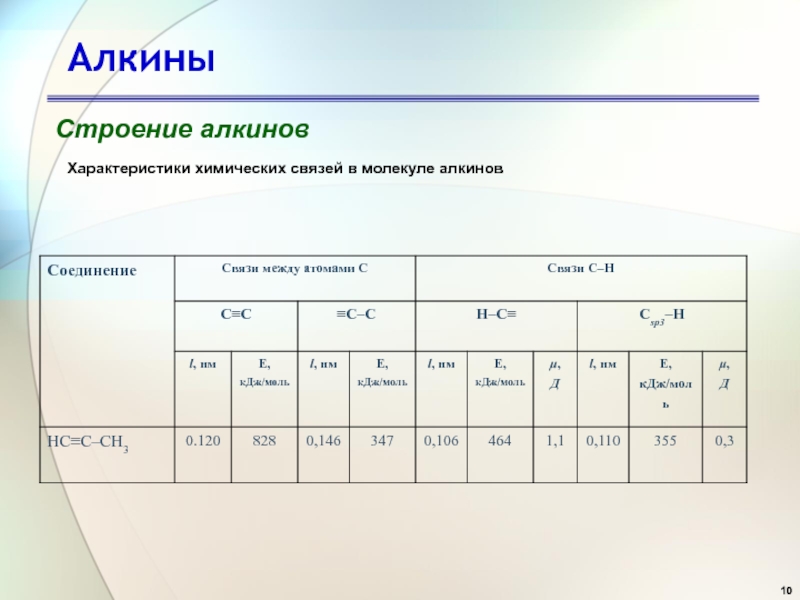
- 10. АлкиныСтроение алкиновХарактеристики химических связей в молекуле алкинов
- 11. АлкиныСтроение алкиновОбщая энергия тройной связи составляет 837
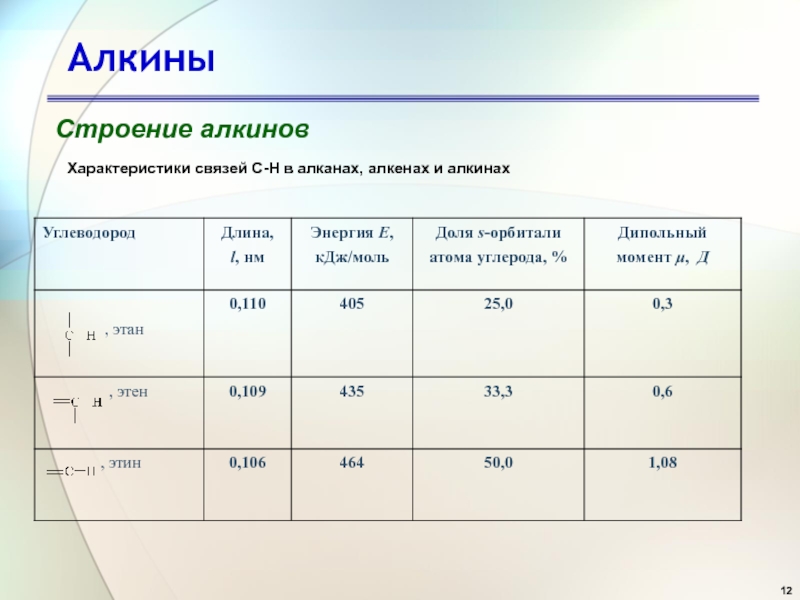
- 12. АлкиныСтроение алкиновХарактеристики связей С-Н в алканах, алкенах и алкинах
- 13. АлкиныСтроение алкиновСвязь углерод-водород в этилене образована в
- 14. АлкиныСтроение алкиновПо мере возрастания s-характера гибридной орбитали
- 15. АлкиныСтроение алкиновСвязь ≡С–Н имеет заметную полярность, связанную
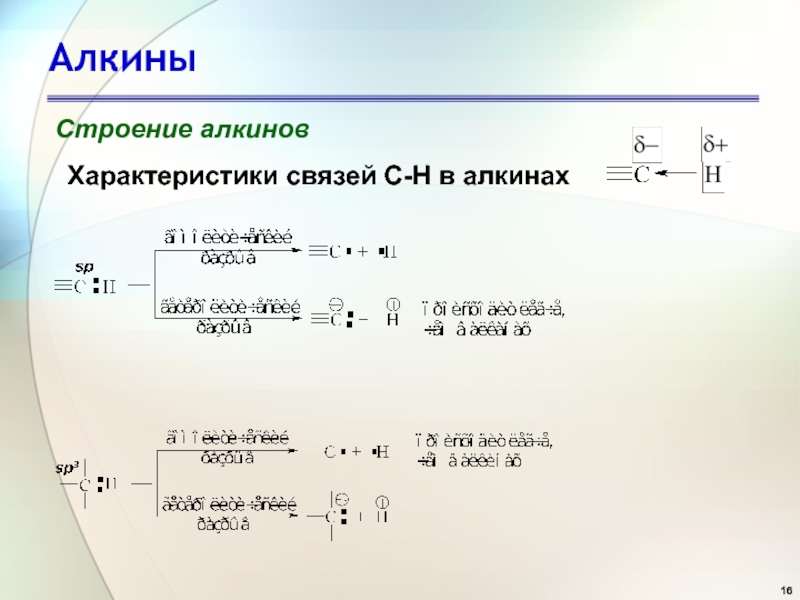
- 16. АлкиныСтроение алкиновХарактеристики связей С-Н в алкинах
- 17. АлкиныХимические свойства1) Раскрытие кратной связи - реакции
- 18. АлкиныХимические свойстваКислотность алкинов
- 19. АлкиныХимические свойстваКислотность алкинов Существует несколько определений терминов
- 20. АлкиныКислотность алкинов
- 21. АлкиныКислотность алкинов Водород группы ≡С–Н имеет небольшой
- 22. АлкиныКислотность алкинов Кислотные свойства ацетилена и других
- 23. АлкиныКислотность алкинов Ацетилениды щелочных металлов гидролизуются водой.
- 24. АлкиныКислотность алкинов Реакция Иоцича
- 25. АлкиныКислотность алкинов Ацетилениды Ag и Cu –
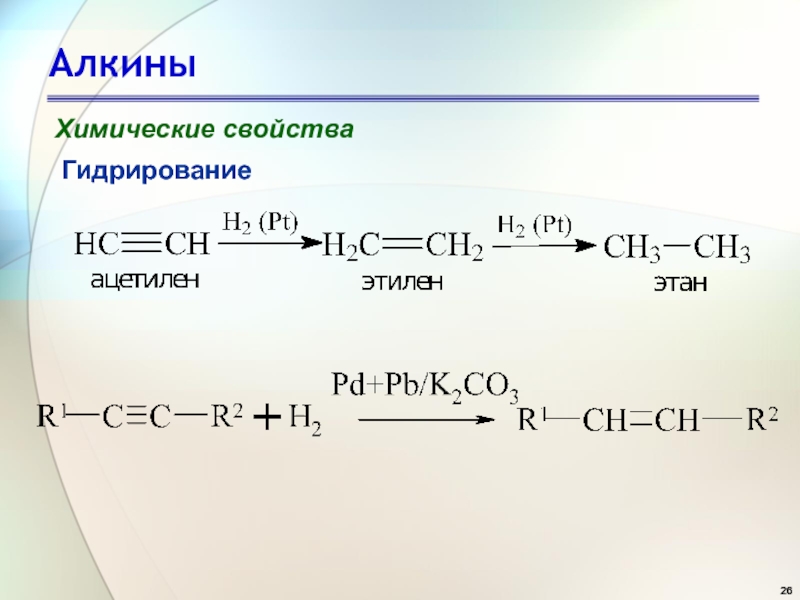
- 26. АлкиныХимические свойстваГидрирование
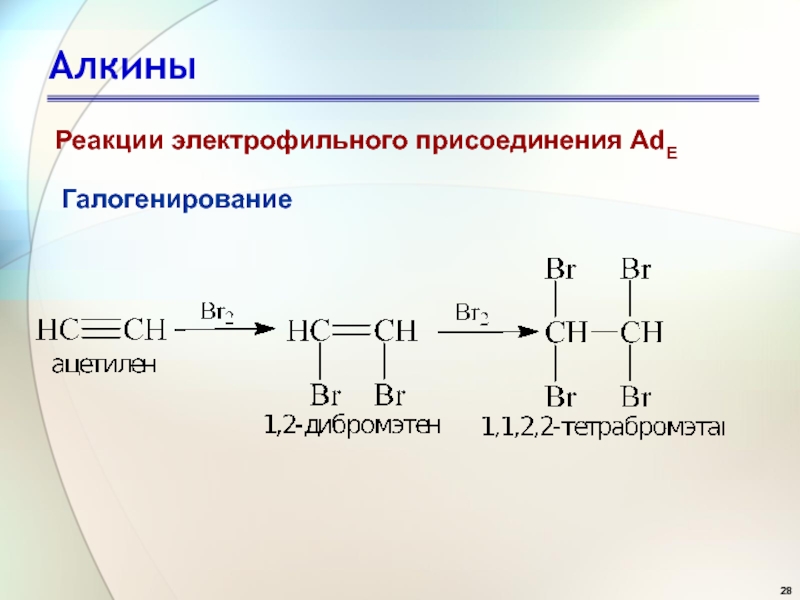
- 27. АлкиныГалогенированиеРеакции электрофильного присоединения AdEАлкины, как и алкены,
- 28. АлкиныГалогенированиеРеакции электрофильного присоединения AdE
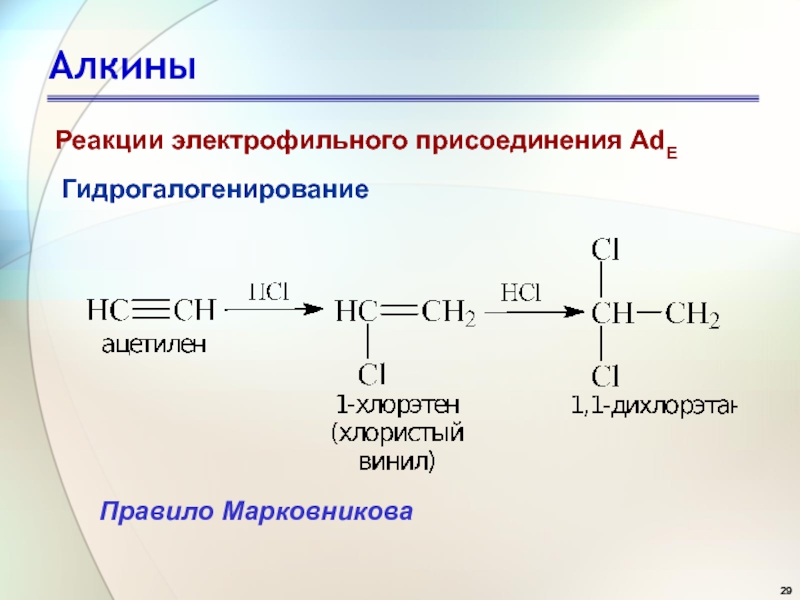
- 29. АлкиныГидрогалогенированиеПравило МарковниковаРеакции электрофильного присоединения AdE
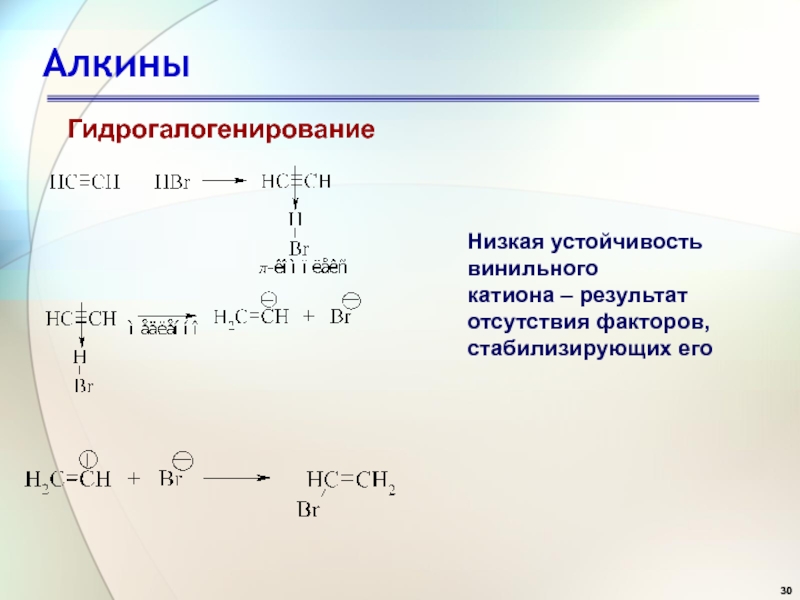
- 30. АлкиныГидрогалогенированиеНизкая устойчивость винильного катиона – результат отсутствия факторов, стабилизирующих его
- 31. АлкиныГидрогалогенированиеПравило Марковникова
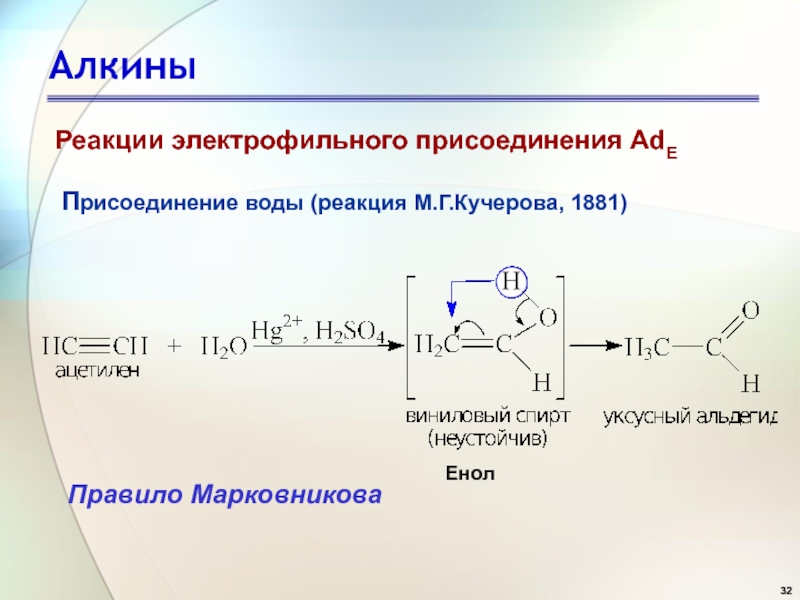
- 32. АлкиныПрисоединение воды (реакция М.Г.Кучерова, 1881) Правило МарковниковаЕнолРеакции электрофильного присоединения AdE
- 33. АлкиныПрисоединение воды (реакция М.Г.Кучерова) Правило МарковниковаРеакции электрофильного присоединения AdE
- 34. АлкиныХимические свойстваГидратация алкинов по Кучерову КучеровМихаил Григорьевич (1850 - 1911).
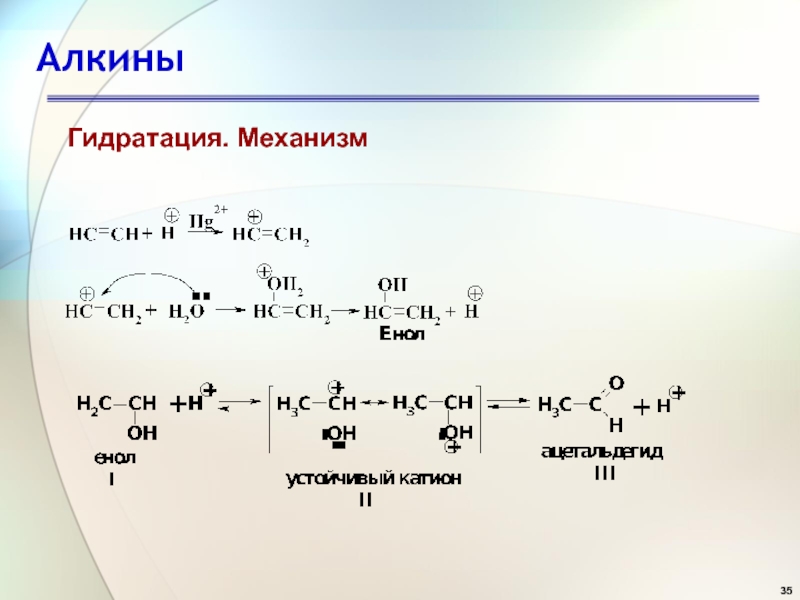
- 35. АлкиныГидратация. Механизм
- 36. АлкиныКето-енольная таутомерия (динамическая изомерия) OH-кислота сильнее, чем CH-кислота
- 37. АлкиныПрисоединение карбоновых кислотРеакции электрофильного присоединения AdEГомологи ацетилена
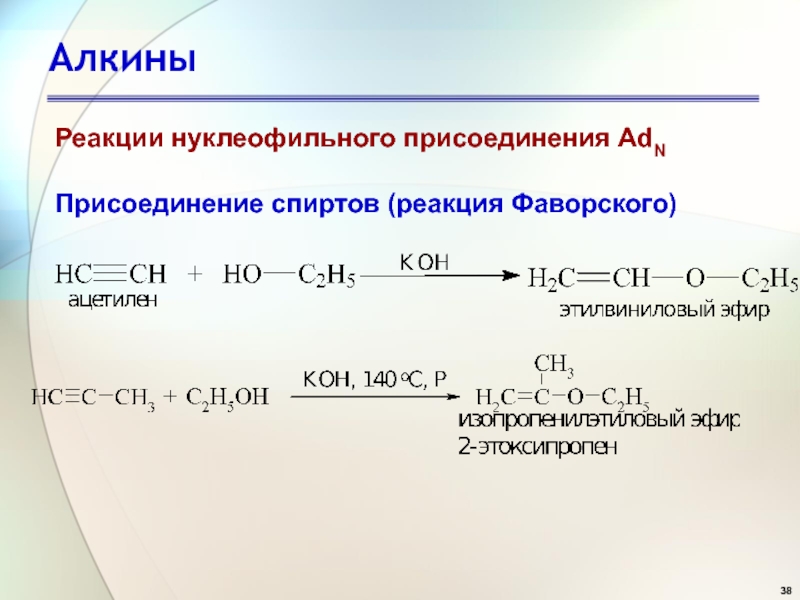
- 38. АлкиныПрисоединение спиртов (реакция Фаворского) Реакции нуклеофильного присоединения AdN
- 39. АлкиныФаворский Алексей Евграфович 1860 - 1945
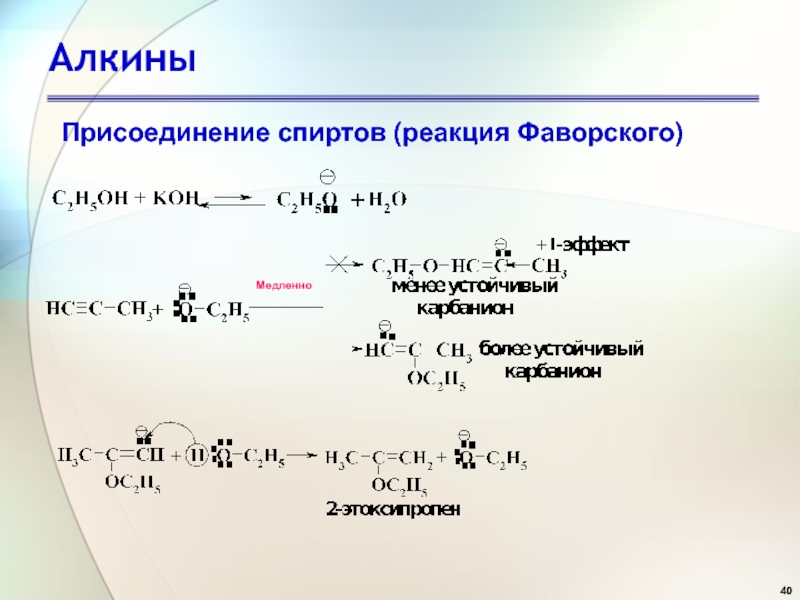
- 40. АлкиныПрисоединение спиртов (реакция Фаворского) Медленно
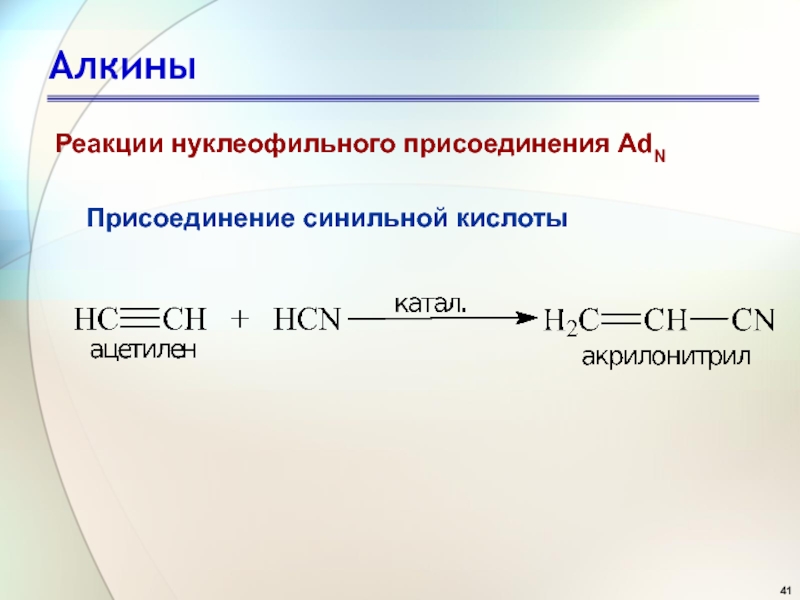
- 41. АлкиныПрисоединение синильной кислотыРеакции нуклеофильного присоединения AdN
- 42. АлкиныПрисоединение к альдегидам и кетонамМеханизм реакции AdN.Реакции нуклеофильного присоединения AdN
- 43. АлкиныПрисоединение к альдегидам и кетонамВ настоящее время
- 44. АлкиныПрисоединение к альдегидам и кетонамМеханизм реакции AdN.В.Реппе, 1925 г. Cu2C2 Реакции нуклеофильного присоединения AdN
- 45. АлкиныХимические свойстваСинтез 1,3-бутадиена (В.Реппе, 1925 г.).
- 46. АлкиныРЕППЕ Вальтер Юлиус1892 г. – 1969 г.
- 47. АлкиныХимические свойстваЧасто для этих реакций используется комплекс
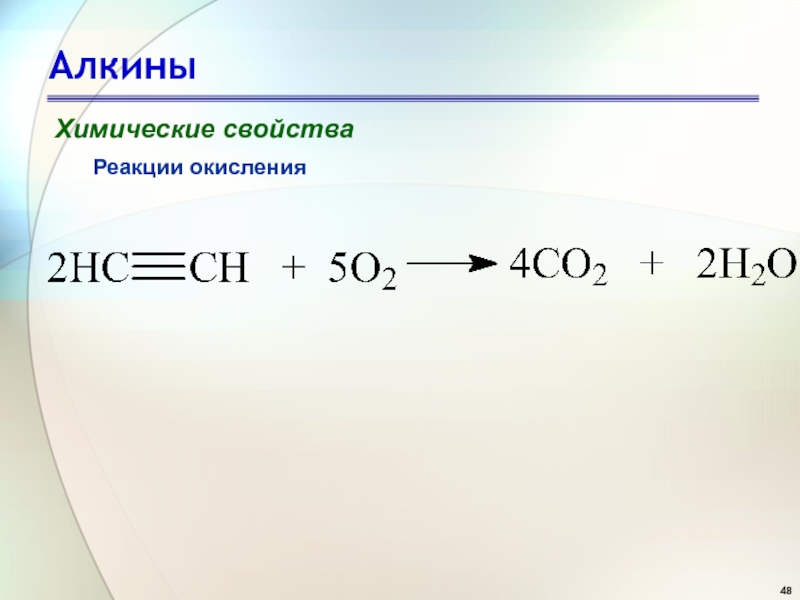
- 48. АлкиныХимические свойстваРеакции окисления
- 49. АлкиныХимические свойстваРеакции окисления
- 50. АлкиныХимические свойстваРадикальное присоединение бромоводорода AdR
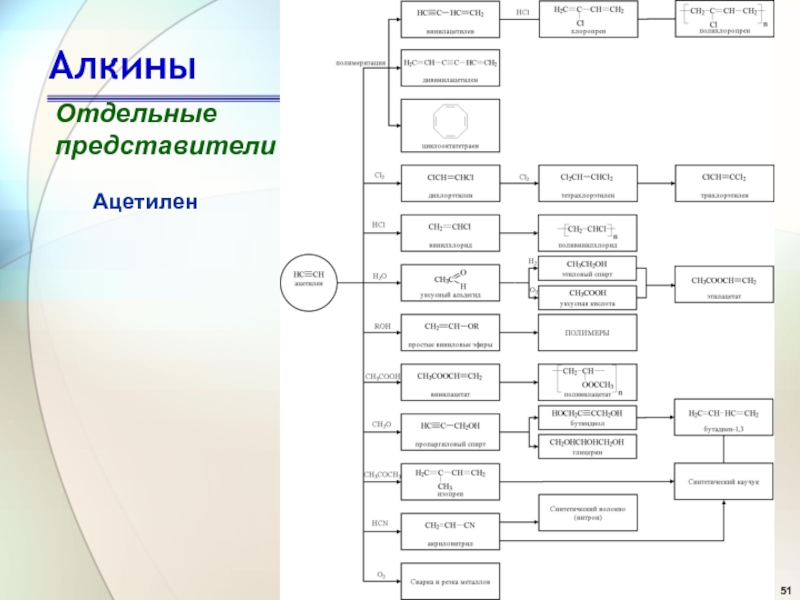
- 51. АлкиныОтдельныепредставителиАцетилен
- 52. АлкиныСпособы полученияКрекинг
- 53. АлкиныСпособы полученияИз карбида кальция
- 54. АлкиныСпособы полученияОкислительный пиролиз метана
- 55. АлкиныСпособы полученияДегидрогалогенирование вицинальных дигалогеналкановИзомеризация
- 56. АлкиныСпособы полученияДегидрогалогенирование геминальных дигалогеналканов
- 57. АлкиныСпособы полученияАлкилирование ацетиленид-иона и карбанионов терминальных алкинов
- 58. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Алкины
Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными
атомами имеется одна тройная связь.
Слайд 3Алкины
Номенклатура и изомерия
бутин-1
(этилацетилен)
бутин-2
(диметилацетилен)
2-метилпентен-1-ин-4
Изомерия:
Структурная.,
По положению тройной
связи.
Оптическая
Слайд 11Алкины
Строение алкинов
Общая энергия тройной связи составляет 837 кДж/моль, т.е. не
является суммой энергий трех ординарных связей (351∙3=1053 кДж/моль) или одной
ординарной и двух двойных (351 + 260∙2= 871 кДж/моль).Это можно рассматривать как результат отталкивания связывающих электронов трех связей, которые вынуждены быть сближенными в пространстве.
Длина связи С≡С составляет 0,120 нм (для сравнения - в этане 0,154 нм, в этилене 0,134 нм). Сравним характеристики связи С-Н
Слайд 13Алкины
Строение алкинов
Связь углерод-водород в этилене образована в результате перекрывания sp2-
гибридных орбиталей. По сравнению с
sp3- орбиталью, sp2-орбиталь имеет меньшую
долю p-орбитали и большую долю s-орбитали. Электроны на
s-орбиталях удерживаются ядром прочнее, чем на
p-орбиталях. Это означает, что s-электроны обладают меньшей энергией и меньшей подвижностью, чем
p-электроны. sp-Орбиталь, как имеющая больший вклад
s-характера (50%), изначально лежит ниже по энергии, чем
sp2- (33.3%) и sp3- (75%) орбитали.
Слайд 14Алкины
Строение алкинов
По мере возрастания s-характера гибридной орбитали её эффективный размер
уменьшается и одновременно уменьшается длина связи с другим атомом. Поэтому
связь водорода с sp-гибридизованным атомом углерода (sp – 1s) должна быть короче, чем с sp2-гибридизованным атомом углерода (sp2-1s) и тем более чем с sp3-гибридизованным (sp3-1s).Чем больше доля s-состояния в гибридной орбитали, тем более электроотрицательной она будет. Электроотрицательность орбиталей углерода изменяется в следующем порядке: sp > sp2 > sp3.
Слайд 15Алкины
Строение алкинов
Связь ≡С–Н имеет заметную полярность, связанную с большей долей
s-состояния гибридной орбитали и вследствие этого с большей близостью электронной
пары связи ≡С–Н к углероду.В результате смещения электронного облака σ-связи от атома водорода к атому углерода атом водорода становится отчасти положительно заряженным - кислотным.
Энергия диссоциации связи углерод-водород в ацетилене
≡С–Н больше, чем в этилене; sp-гибридизация затрудняет гомолитический разрыв связи ≡С–Н с образованием радикалов, но облегчает гетеролитический разрыв этой связи с образованием ионов
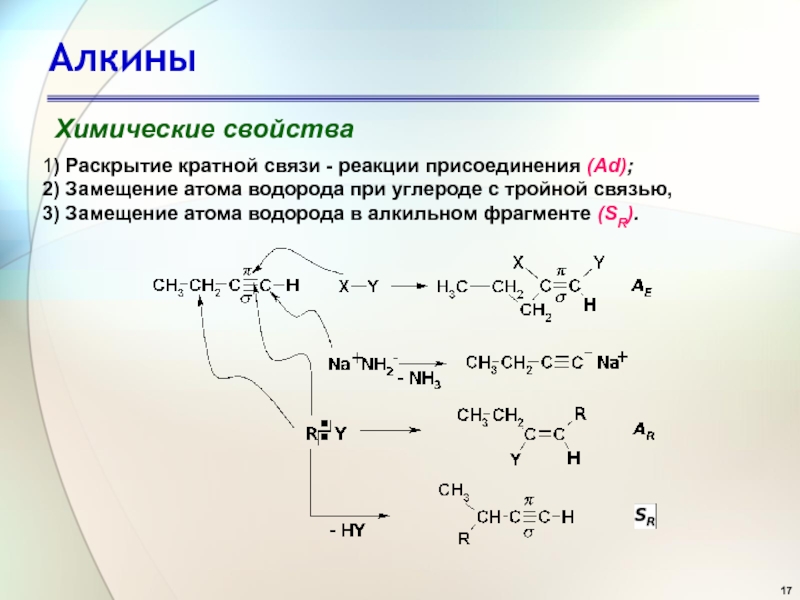
Слайд 17Алкины
Химические свойства
1) Раскрытие кратной связи - реакции присоединения (Ad);
2) Замещение
атома водорода при углероде с тройной связью,
3) Замещение атома водорода
в алкильном фрагменте (SR).Слайд 19Алкины
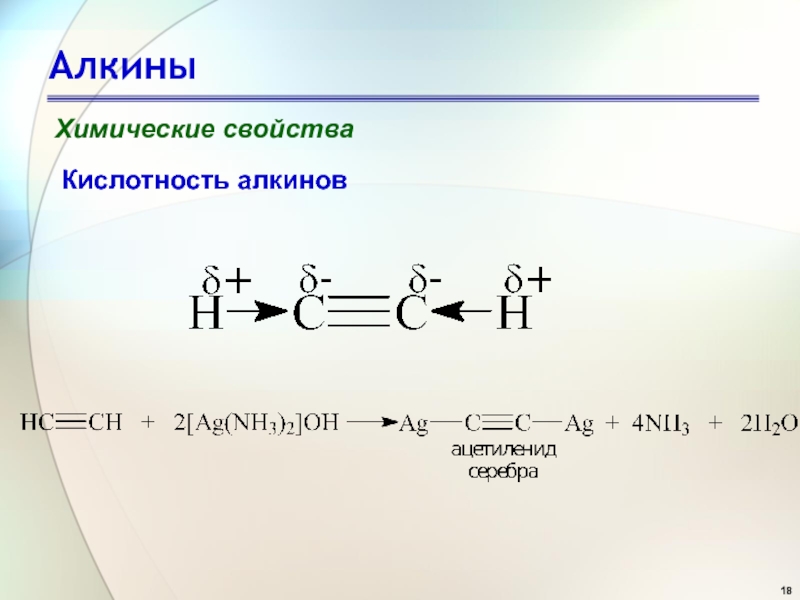
Химические свойства
Кислотность алкинов
Существует несколько определений терминов кислота и основание.
Согласно Бренстеду - Лоури, кислоты представляет собой вещества, отдающие протон,
а основания – вещества, присоединяющие протон
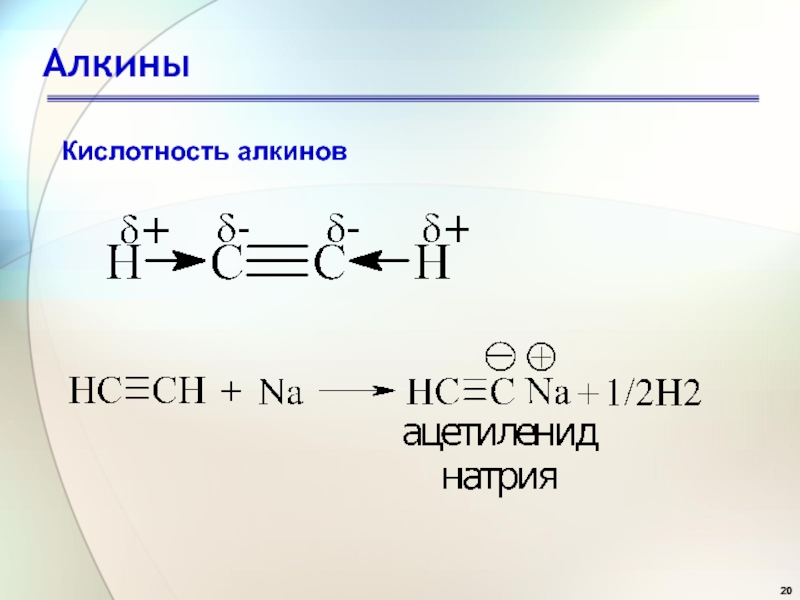
Слайд 21Алкины
Кислотность алкинов
Водород группы ≡С–Н имеет небольшой положительный заряд, поэтому
можно говорить о его ”кислотности“.
Электроотрицательность Csp3 < Csp2
N < CspКонстанты кислотности некоторых соединений
Слайд 22Алкины
Кислотность алкинов
Кислотные свойства ацетилена и других алкинов с концевой
тройной связью могут проявляться в жидком аммиаке. При действии очень
сильных оснований они образуют соли – ацетилениды, в которых связь металл-углерод ионная.
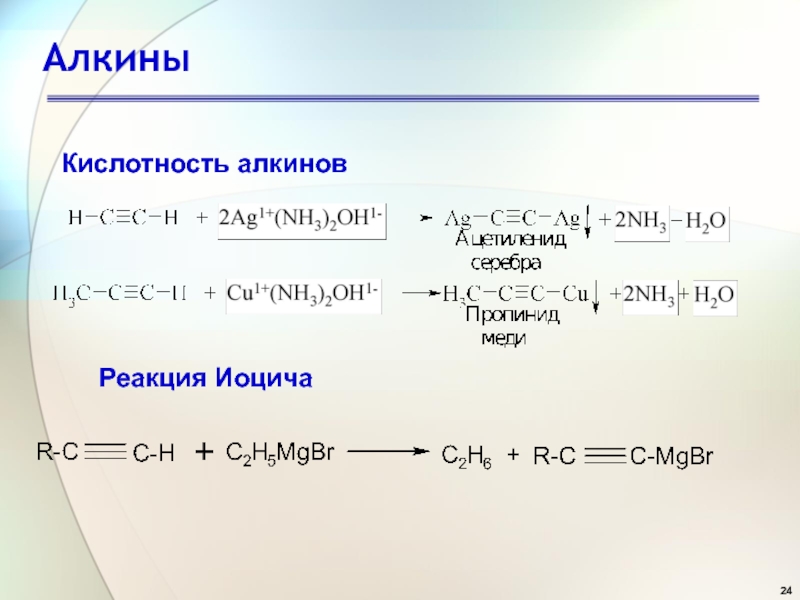
Слайд 25Алкины
Кислотность алкинов
Ацетилениды Ag и Cu – ковалентные соединения
Ацетилениды
щелочных металлов – ионные соединения
Соли алкинов сильные нуклеофилы. Их
используют для получения алкинов сложного строенияСлайд 27Алкины
Галогенирование
Реакции электрофильного присоединения AdE
Алкины, как и алкены, имеют доступные для
атаки
π-электроны и вступают в реакции электрофильного присоединения. Но из-за
повышенной электроотрицательности sp-гибриди-зованных атомов углерода и укороченности связей поляризуемость π-электронов тройной связи С≡С уменьшена, поэтому тройная углерод-углеродная связь по сравнению с двойной связью С=С менее реакционноспособна в отношении электрофильных реагентов.
Слайд 30Алкины
Гидрогалогенирование
Низкая устойчивость винильного
катиона – результат
отсутствия факторов,
стабилизирующих его
Слайд 32Алкины
Присоединение воды (реакция М.Г.Кучерова, 1881)
Правило Марковникова
Енол
Реакции электрофильного присоединения AdE
Слайд 33Алкины
Присоединение воды (реакция М.Г.Кучерова)
Правило Марковникова
Реакции электрофильного присоединения AdE
Слайд 34Алкины
Химические свойства
Гидратация алкинов по Кучерову
Кучеров
Михаил Григорьевич
(1850 -
1911).
Слайд 37Алкины
Присоединение карбоновых кислот
Реакции электрофильного присоединения AdE
Гомологи ацетилена с концевой тройной
связью реагируют с кислотами в соответствии с правилом Марковникова
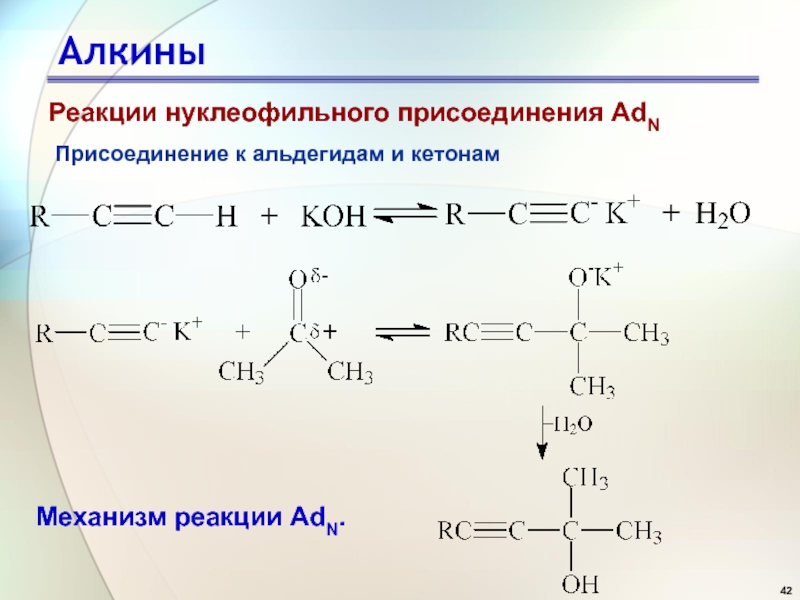
Слайд 42Алкины
Присоединение к альдегидам и кетонам
Механизм реакции AdN.
Реакции нуклеофильного присоединения AdN
Слайд 43Алкины
Присоединение к альдегидам и кетонам
В настоящее время реакция получения спиртов
ацетиленового ряда осуществляется в растворе жидкого аммиака или диметилсульфоксида (ДМСО).
Механизм
реакции AdN.Реакции нуклеофильного присоединения AdN
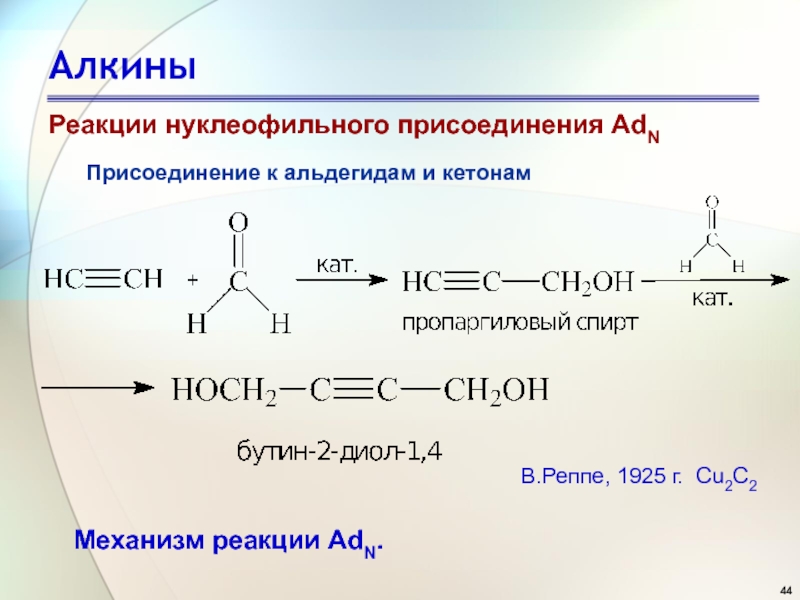
Слайд 44Алкины
Присоединение к альдегидам и кетонам
Механизм реакции AdN.
В.Реппе, 1925 г. Cu2C2
Реакции нуклеофильного присоединения AdN
Слайд 47Алкины
Химические свойства
Часто для этих реакций используется комплекс Иоцича, образующийся при
действии алкина на магнийорганические соединения Комплекс Иоцича легко реагируют с
альдегидами, кетонами, углекислотой, образуя важные кислородсодержащие продукты.Механизм реакции AdN.