Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Антибиотики
Содержание
- 1. Антибиотики
- 2. Основная концепцияПодавление жизнедеятельности микроорганизмов – возбудителей инфекционных
- 3. Антимикробные ЛСАнтибактериальныеАнтимикобактериальные (противотуберкулёзные)ПротивогрибковыеПротивовирусныеПротивопротозойные
- 4. Антибактериальная терапияНа долю АБ приходится 3-25% от
- 5. Этапы развития«Магическая пуля» - P. Ehrlich, 1900-еПрепарат
- 6. Антибиотики и смертность от инфекционных болезней в развитых странах (P. Periti , 1997)ЭрАмпГентЦфтАмкИмиЦипАзиВанФепМоксЛин
- 7. Антибактериальные препаратыАнтибиотики (природные и полусинтетические):Вещества биологического происхождения
- 8. Характеристика микроорганизмов Патогенность - способность микроорганизмов вызывать
- 9. Чувствительность микроорганизмов Чувствительные
- 10. Микробиологические термины МПК (Минимальная подавляющая концентрация)
- 11. Микробиологические термины МБК – минимальная бактерицидная
- 12. МетодыСерийных разведенийВ агареВ бульонеМакровариантМикровариантПо количеству концентраций«Длинный ряд»По пограничным концентрациямПо способу регистрации ростаВизуальноСпектрофотометрическиПо ферментативной активностиДиффузионныеДиско-диффузионныйЕ-тест
- 13. Распределение МПК антибиотиков в отношении E. coli - EUCAST
- 14. Распространение методов оценки чувствительностиОпрос 192 стационаров Европы89%
- 15. РЕЗИСТЕНТНОСТЬ (%) P. aeruginosa К КАРБАПЕНЕМАМ В ОРИТ НЕСКОЛЬКИХ СТАЦИОНАРОВ*Данные РЕЗОРТ 2002-04
- 16. Терапевтическая широтаТерапевтическая широта определяется разницей между эффективными (Э) и токсическими (Т) концентрациямиКонцентрации, мкг/млТЭ
- 17. Параметры фармакокинетики АБ Сmax – максимальная
- 18. Элементы фармакокинетикиСmaxВремяКонцентрация препарата мкг/млTmax T 1/2AUC
- 19. Динамика антибактериальных эффектов в процессе леченияБактерицидныйэффектБактериостатическийэффектСубингибирующий эффектПостантибиоти-ческий эффектМБКМПККонцентрация антибиотика в плазмеВремяСубингибирующий эффект
- 20. Предиктор эффективности терапии АБэто период времени,
- 21. Фармакокинетические предикторы эффективности АБ терапии
- 22. Характеристика механизмов действия АБ и антибактериального эффекта
- 23. Механизмы действия антибактериальных препаратовЦелостностьцитоплазматической мембраныСинтез клеточной стенкиТранскрипция РНКБиосинтезнуклеотидовСинтезбелкаТопоизомеразаПолипептидРепликация ДНКиРНКПептидные антибиотики-АминогликозидыМакролидыТетрациклиныХлорамфениколФузидиевая к-таСрептограминыОксазолидиноныБета-лактамыГликопептидыФосфомицинБацитрацинИзониазидЦиклосеринЭтамбутолЭтионамид-ХинолоныНитрофураныНитроимидазолыРифамициныСульфаниламидыТриметоприм
- 24. Резистентность Природная
- 25. Гипотеза «резервуара»Swartz, M.N., 1997Levy, S.B., 1998Heinemann A.J., 2000Частота резистентностиВремяВнедрениеАБПоявление клиническихR штаммовСнижение потребления АБУвеличение потребления
- 26. Причины появления и распространения резистентностиИзбыточной применение АБ
- 27. Outpatient antibiotic use ESAC YEARBOOK 2006
- 28. Hospital use of antimicrobials ESAC YEARBOOK 2006
- 29. Механизмы развития приобретенной резистентностиИзменение места (мишени) действия
- 30. Механизмы развития приобретенной резистентностиИзменение проницаемости клеточной стенки
- 31. Предотвращение распространения резистентностиЗнание механизмов формирования и распространенияРазработка и реализация мероприятий по сдерживанию
- 32. РЕЗИСТЕНТНОСТЬ К АНТИБИОТИКАМ БАКТЕРИАЛЬНЫХ ВОЗБУДИТЕЛЕЙ НОЗОКОМИАЛЬНЫХ ИНФЕКЦИЙ В РОССИИРЕВАНШ 2006-07: 36 стационаров 26 городов
- 33. Общая характеристика антибактериальных препаратов
- 34. Основные группы антибактериальных препаратовБета-лактамыАминогликозидыФторхинолоныМакролидыГликопептидыОксазолидиноныТетрациклиныСульфаниламидыРифампинХлорамфениколФосфомицинФузидиевая кислотаПолипептиды (полимиксин)
- 35. Бета-лактамные антибиотики
- 36. Механизм действия бета-лактамных антибиотиковONRЦитоплазматическаямембранаПенициллинсвязывающие белки - ПСББета-лактамное кольцоПептидогликановый каркас микробной клеткиЗамыкание поперечных сшивок между параллельными цепямиБлокадаПСБ
- 37. Устойчивость к бета-лактамным антибиотикамЦитоплазматическаямембранаПСББета-лактамазаOАнтибиотикООбразованиекомплекса и разрушение антибиотикаАктивный ферментNNNOРазрушенный антибиотикМодифицированныйПСБ со сниженной аффинностью к антибиотикам
- 38. ЦитоплазматическаямембранаПСББета-лактамазаOИнгибиторОNNИнгибиция бета-лактамазОбразование стабильного комплексафермент-ингибитор«Суицидная» ингибициябета-лактамазы
- 39. Классификация бета-лактамных антибиотиков I. ПенициллиныI. Пенициллины
- 40. Классификация бета-лактамных антибиотиков ЦефалоспориныI поколение II поколение
- 41. Классификация бета-лактамных антибиотиковIII. Карбапенемы IV. Монобактамы Имипенем Азтреонам Меропенем Эртапенем ДорипенемV. Комбинированные (защищенные) препараты Ампициллин/сульбактам Амоксициллин/клавуланат Тикарциллин/клавуланат Пиперациллин/тазобактам Цефоперазон/сульбактам Ампициллин/оксациллин
- 42. Спектр активности бета-лактамовПриродные → уреидопенициллиныЗначительное расширение грам
- 43. Устойчивость к бета-лактамным антибиотикамФерментативная инактивацияБета-лактамазыМодификация мишеней действияПоявление
- 44. Основные классы бета-лактамазСериновые бета-лактамазыКлассы А, С и DМеталло-бета-лактамазыКласс В
- 45. Характеристика бета-лактамазФерменты 1.Стафилококковые, плазмидные, класс А2.Плазмидные грам (-)
- 46. Происхождение PBP и сериновых бета-лактамаз
- 47. Разнообразие бета-лактамаз Класс С Класс А и D
- 48. Природные пенициллиныПреимущества:Мощное бактерицидное действие:Г (+) кокки: стрептококки,
- 49. Распределение МПК пенициллина в отношении S. pneumoniae
- 50. Природные пенициллиныНедостатки:Приобретённая резистентность:Г (+) кокки: стафилококки, пневмококки
- 51. Природные пенициллины Показания:Инфекции БГСА: тонзиллит, фарингит, рожа,
- 52. Полусинтетические пенициллины Оксациллин - Антистафилококковый пенициллин
- 53. Появление метициллинрезистентностиМетициллин: полусинтетический пенициллин, устойчивый к действию
- 54. Механизм устойчивостиSens. Rez ПСБ1 ПСБ2 ПСБ2а ПСБ3 ПСБ4Дополнительный пенициллинсвязывающий белокKuhl S.A., 1978Brown D.F.J., 1980Низкая аффинность ко всем β-лактамамКлиническая неэффективность всех β-лактамов
- 55. Staphylococcal cassette chromosome mec (SSCmec) [Hiramatsu 2001]
- 56. Staphylococcal cassette chromosome mec (SSCmec) [Chongtrakool P., 2006]mecA – комплексccr – комплекс (рекомбиназа)
- 57. Эпидемиология ORSAПараллельные процессыКлональное распространение штаммов и эволюция
- 58. Типирование MRSAТипирование основного генома MLST – multilocus
- 59. Клональность бактерий
- 60. Глобальная клональная структура MRSA - MLST
- 61. Клональность MRSA в Москве Афанасьев М.А., Ильина
- 62. Методы оценки чувствительности стафилококковСерийных разведенийДиско-диффузионныйСкрининг на агареСерологическая детекция ПСБ2аПЦР детекция mecA гена
- 63. Критерии чувствительности стафилококков методом серийных разведенийКритерии чувствительности
- 64. CLSI - 2006Использование дисков с цефокситином предпочтительнееВыдача ответаОксациллинчувствительныйОксациллинустойчивый При оценке S. lugdunensis Только цефокситин
- 65. Оценка чувствительности к оксациллину - цефокситинуCLSI –
- 66. Гетерогенность устойчивости
- 67. Происхождение метициллинрезистентностиГен mecAДополнительный ПСБ – ПСБ2аПроисхождение неизвестноНаибольшая
- 68. Устойчивость S. aureus к метициллину (оксациллину) –
- 69. Внебольничные ORSAШтаммы генетически связанные с госпитальными Штаммы
- 70. MRSA в Европе – EARSS 2007
- 71. Распространение ORSA в России при нозокомиальных инфекциях 1995
- 72. Динамика распространение устойчивости среди ORSA к антибактериальным препаратам разных групп
- 73. Аминопенициллины АмпициллинБолее расширенный спектр антимикробной активности:
- 74. Аминопенициллины Показания:Инфекции ВДП: острый средний отит,
- 75. Антисинегнойные пенициллиныКарбоксипенициллины: карбенициллин, тикарциллин. Уреидопенициллины: азлоциллин, пиперациллин.
- 76. Ингибиторозащищённые пенициллины Соединения, инактивирующие β-лактамазы:
- 77. Ингибиторозащищённые пенициллиныПоказания к лечению бактериальных инфекций:ВДП: о.
- 78. Частота вероятной продукции AmpC Исследование «MICROMAX», Сидоренко
- 79. Частота (%) вероятной продукции бета-лактамаз расширенного спектра
- 80. Распространение CTX-M бета-лактамаз в России [Edelstein M.,
- 81. CTX-M происхождениеПервичные хозяева – хромосомная локализацияCTX-M-2 группа
- 82. БЛРС в России1996 г. - Первое сообщение
- 83. Практически важные свойства AmpC бета-лактамазРаспространение Хромосомы большинства
- 84. Klebsiella spp. продуценты бета-лактамаз класса С (АмрС)212
- 85. Цефалоспорины
- 86. Цефалоспорины Общие свойства:Бактерицидное действиеШирокий терапевтический
- 87. Цефалоспорины Цефалоспорины I → III
- 88. Показания для применения цефалоспоринов I поколенияПарентеральные -
- 89. Показания для применения цефалоспоринов II поколенияПарентеральные -
- 90. Показания для применения парентеральных цефалоспоринов III поколения
- 91. Показания для применения парентеральных цефалоспоринов III поколения
- 92. Показания для применения оральных цефалоспоринов III поколенияЦефиксим,
- 93. Показания для применения цефалоспоринов IV поколенияТяжелые, преимущественно
- 94. Эволюция бета-лактамаз класса АВыделение стафилококковой беталактамазы -
- 95. Клиническое значение AmpC бета-лактамазСелекция гиперпродуцентов возможна в
- 96. Распространение устойчивости к цеф III в Европе в 2007E. coli K. pneumoniae
- 97. MYSTIC, Россия Устойчивость энтеробактерий к цефалоспоринам III обусловленная продукцией БЛРС и AmpC
- 98. Карбапенемы Имипенем Меропенем Эртапенем Дорипенем
- 99. Карбапенемы – антибактериальная активностьНаиболее широкий спектр антимикробной
- 100. Различия в антимикробной активности меропенема и имипенемаГрамположительные
- 101. КарбапенемыСтруктурное сходство с другими β-лактамными АБ.Показания: тяжёлые инфекции, в т.ч. госпитальные (полирезистентные микроорганизмы, смешанная микрофлора)
- 102. КарбапенемыИмипенем/Циластатин 1:1(Тиенам) - Циластатин – ингибитор дегидропетидазы
- 103. Активность бета-лактамов в отношении P. aeruginosaПрепараты в
- 104. Структура эффлюксного насоса ВнешняямембранаПериплазматическоепространствоЦитоплазматическая мембранаАнтибиотикБелки внешнейМембраныOprJ, M, NЛинкерные протеиныMexA, C, E, XЭкспортирующие протеиныMexB, C, F, Y
- 105. КарбапенемазыКласс А – NMC, IMI, SME, KPC,
- 106. КарбапенемазыИнтенсивный гидролизумеренный гидролизнет гидролиза
- 107. Антибиотикорезистентность основных госпитальных патогенов (NNIS, 2004)
- 108. Металло-бета-лактамазы в РоссииVIM-тип, IMP-типСанкт-ПетербургМосква Ярославль СаратовКазань МагнитогорскЕкатеринбург ОмскТомскИркутск
- 109. Предпосылки для быстрого распространенияЛокализация генов в составе
- 110. Структура интегронов
- 111. Детекция металло-бета-лактамазФенотипические методыОснованы на ингибиции MBL Диско-диффузионныеСерийных разведенийГидролиз карбапенемовГенотипические методыПЦРГибридизацияКлонирование и секвенирование
- 112. Слайд 112
- 113. Перекрестная устойчивость P. aeruginosa к бета-лактамным антибиотикамТик S r/R R SТик+клав S/r r/R R S/rПипер S r/R r/R SПипер+таз S r/R r/R SЦефтаз S r/R r/R SЦефепим S S/r R SИми S S S RМеро S S r r AmpC Эффл OprD(-)
- 114. Различия в антимикробной активности меропенема и имипенемаГрамположительные
- 115. Больничный формуляр антибиотиков - карбапенемы ИмипенемГоспитальные инфекции МеропенемГоспитальные инфекции Особые показания:МенингитP.aeruginosa
- 116. Макролиды, кетолиды, линкозамиды и стрептограмины Объединены в одну группу общим механизмом действия
- 117. Химическая структура макролидных антибиотиков
- 118. Классификация макролидных антибиотиков
- 119. Линкозамиды и стрептограминыЛинкозамидыЛинкомицинКлиндамицинСтрептограминыСтрептограмин А и В
- 120. Эритромицин vs. современные макролидыПараметр Азитро Кларитро 16-ти чл.Спектр акт. ≈
- 121. Механизм действияНесмотря на различия в химической структуре макролидные и линкозамидные антибиотики обладают одинаковым механизмом действия
- 122. Структура бактериальной рибосомы50S субъединицаРибонуклеиновые кислоты23S рРНК5S рРНКРибосомальные белки30S субъединицаРибонуклеиновые кислоты5S рРНКРибосомальные белки30 S50 SПептидил трасферазный центр
- 123. Механизм действия макролидов5S рРНКДомен VДомен IIПептидил трансферазный центр5S рРНК5S рРНК2058752VIIVIIЭритромицинТелитромицин205875230S50SOOO-cladinose
- 124. Участок связывания макролидов с бактериальной рибосомой
- 125. Макролиды: общие свойстваПреимущественно бактериостатическое действие.Высокие концентрации в
- 126. Спектр антимикробной активности макролидовГрам (+)Streptococcus spp.S.pneumoniaeStaphylococcus sppC. diphtheriae МикобактерииАтипичныеMycoplasmaКроме M. hominisChlamydiaUreaplasmaГрам (-)M.catarrhalisLegionella spp.H. pyloriCampylobacter spp.N.gonorrhoeaeN.meningitidisB. pertussis
- 127. Фармакокинетика азитромицинаФагосомаФагоцитМежклеточное пространствоСосудистое русло
- 128. Сравнительная активность макролидов и линкозамидов в отношении S. pneumoniae
- 129. Сравнительная активность макролидов и линкозамидов в отношении S. pyogenes
- 130. Механизмы устойчивости к макролидамМодификация мишениМетилирование (erm -гены)Мутации
- 131. Распространение устойчивости S. pneumoniae к эритромицину в Европе EARSS - 2007
- 132. Динамика распространения устойчивости к макролидам в Москве
- 133. Клиническое применение макролидовОсновные показанияВнебольничная пневмонияУрогенитальный хламидиоз и
- 134. ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ВЫБОР МАКРОЛИДОВ ПРИ РЕСПИРАТОРНЫХ ИНФЕКЦИЯХ
- 135. Линкозамиды: Линкомицин, Клиндамицин Бактериостатическое действие.Активность: Г(+) кокки,
- 136. Хинолоны
- 137. Общая структура хинолоновN1467ОCOOHFXRRRRНалидиксовая кислота - 1962 1967Норфлоксацин - 1978 1986
- 138. ХлорохинХинолоны НафтуридоныНалидиксовая к-таНорфлоксацин ЭноксацинТосуфлоксацинТровафлоксацинГемифлоксацинОфлоксацин ЦипрофлоксацинЛевофлоксацинГрепафлоксацинСпарфлоксацинКлинафлоксацинМоксифлоксацинГатифлоксацин«Родословное дерево» хинолонов
- 139. Хинолоны в РоссииНефторированныеНалидиксовая к-таПипемидиевая к-таОксолиниевая к-таФторированныеНорфлоксацинПефлоксацинЦипрофлоксацинОфлоксацинЛомефлоксацинЛевофлоксацинСпарфлоксацинМоксифлоксацинГемифлоксацин
- 140. Классификация хинолоновImproved activity against Gram-positive and ‘atypical’ pathogens
- 141. Организация бактериальной хромосомы и механизм действия хинолоновБактерия
- 142. Мишени действия хинолонов – ДНК-гиразы и топоизомеразы IV СуперспиралиКатенаныУзлыТопо IVГираза ГиразаТопо IVТопо IVТопо IV
- 143. Механизм действия хинолоновДля изменения суперспирализации необходимо внести
- 144. Чувствительность мишеней к различным хинолонам (IC50, мкг/мл)E.
- 145. Сравнительная активность в отношении Грам (-) флоры Нор Ципро*,
- 146. Сравнительная активность в отношении Грам (+) флоры
- 147. Распределение МПК фторхинолонов в отношении «дикой» популяции S. pneumoniae - EUCASTЦипрофлоксацинЛевофлоксацинОфлоксацинМоксифлоксацин
- 148. Устойчивость к хинолонамДетерминанты локализованные на хромосомеМодификация мишеней
- 149. Механизмы устойчивости к хинолонам [Heddle.J. AAC, 2002]Мутации
- 150. Фенотипы устойчивости к хинолонам грам (+)Нал. к-та - - - -Нор - - - -Ципро, Офло, S R R RПефло, ЛомеЛево S S R RСпар, Мокси S S S R
- 151. Фенотипы устойчивости к хинолонам грам (-)Нал. к-та S R R RНор S S R RЦипро, Офло, S S S RПефло, Ломе,Лево S S S RСпар, Мокси S S S R
- 152. Динамика устойчивости S. pneumoniae к фторхинолонам в КанадеCanadian Bacterial Surveillance Network, March 2006
- 153. Неудачи лечения пневмонии фторхинолонамиЗафиксированы на фоне применения
- 154. Клиническое значение - фторхинолоны средства выбора Нор Ципро*, Офло
- 155. Клиническое значение - фторхинолоны средства выбора Нор Ципро*, Офло
- 156. Клиническое значение - фторхинолоны средства выбора Нор Ципро*, Офло
- 157. Нежелательные реакции фторхинолоновТорможение развития хрящевой ткани –
- 158. АминогликозидыI поколениеСтрептомицин - 1944 Применяются по узкимНеомицин
- 159. Механизм действия аминогликозидовИнгибиция биосинтеза белкаСвязывание с 30S
- 160. Аминогликозиды - спектр активностиАктивны, Активны Не активныЭффективны только in vitro------------------------------------------------------------------------------------Энтеробактерии Микоплазмы СтрептококкиP. aeruginosa Haemophilus spp. ЭнтерококкиСтафилококки Легионеллы АнаэробыМикобактерии Сальмонеллы Псевдомонады Шигеллы (кроме P. aeruginosa)
- 161. Аминогликозиды - активность (МПК, мкг/мл) Гент Амик Тобр Нетил-----------------------------------------------------------------------------------------Enterobacteriaceae 0.5 -
- 162. Аминогликозиды - характер бактерицидного действияI - бактериостатики
- 163. Устойчивость к аминогликозидамI. Ферментативная инактивация молекулы антибиотиков
- 164. Аминогликозидмодифицирующие энзимыСубстратная специфичность основных ферментов грам –
- 165. Устойчивость к аминогликозидамЧастота устойчивости снижается в ряду:Гентамицин
- 166. Синергизм аминогликозидов и бета-лактамов в отношении энтерококковБета-лактамы
- 167. Фармакокинетика аминогликозидов C max T 1/2 AUC мкг/мл часГентамицин 1мг/кг 4.0 1.8 62.0Тобрамицин 1
- 168. Аминогликозиды - терапевтическая широтаТерапевтическая широта определяется разницей
- 169. Ото- и вестибулотоксичность аминогликозидов (3% - 15%)Гентамицин
- 170. Нефротоксичность аминогликозидов (12% - 15%)Ранние проявленияЭнзимурия (аланинаминотрасфераза
- 171. Аминогликозиды - нейромышечная блокадаЧастота усиливается при одновременном
- 172. Ото- и нефротоксичность амикацина Частота побочных реакций Ото- Нефро-----------------------------------------------------------------Однократно(15 мг/кг) 4.5% 2.3%Двукратно(по 7.5 мг/кг) 8.8% 3.3%
- 173. Особенности аминогликозидовОграниченная терапевтическая широтаМало предсказуемая индивидуальная фармакокинетикаЗначимая
- 174. Место аминогликозидов в клиникеКак средства монотерапии значение
- 175. Показания для применения аминогликозидовПри амбулаторных инфекциях не
- 176. Аминогликозиды Стратегия выбора препаратаГентамицинБазовый препарат в отделениях
- 177. Гликопептидные антибиотикиВанкомицинТейкопланин
- 178. Спектр активностиБактериостатическая активностьStaphylococcus spp. – в т.ч. MRSAStreptococcus spp.Enterococcus spp.Clostridium spp.
- 179. Механизм действия гликопептидных антибиотиковИнгибиция синтеза пептидогликана в
- 180. Механизмы устойчивости к гликопептидам - энтерококки S RФормирование нового
- 181. Устойчивость энтерококков к гликопептидамПриродно низкая чувствительностьE. casseliflavus,
- 182. Фенотипы устойчивости энтерококков к гликопептидам
- 183. Генетическая организация детерминант устойчивости к гликопептидамПлазмидная локализация
- 184. Распространение VREСеверная АмерикаNNIS – 2003 - 27.5%Россия
- 185. Клональность VRE в онкогематологическом стационаре
- 186. VRE глобального клонального комплекса СС17 в России
- 187. Резистентность грам (+) в Европе http://www.rivm.nl/earss/
- 188. Устойчивость стафилококков к гликопептидамВанкомицин внедрен в 1958
- 189. ТерминологияVRSA – Vancomycin Resistant Staphylococcus aureus VISA
- 190. Промежуточный уровень устойчивости S. aureus к ванкомицину
- 191. hetero-Vancomycin- Intermediate S. aureus (hVISA).Штаммы S. aureus
- 192. Механизм устойчивости стафилококков к гликопептидамSieradzki, K., Pinho M. G., Tomasz A. 1999.
- 193. Механизм устойчивости стафилококков к гликопептидамSakoulas J., et
- 194. Методы детекцииПопуляционный анализТрудоемкий, требует спирального инокулятораУпрощенный популяционный
- 195. Критерии чувствительности к ванкомицину (изменены в 2006)чувствительные
- 196. Распространение hVISA [Liu C., Chambers H.F,
- 197. Клиническое значение снижения чувствительности к ванкомицинуMoise-Broder PA, et al. CID 2004
- 198. Высокий уровень устойчивости S. aureus к ванкомицину
- 199. Формирование штаммов VRSA в клиникеХронические инфекции, вызванные
- 200. Показания к применению Подтвержденные генерализованные инфекции, вызванные
- 201. Побочные эффектыRed-neck/red-man syndrome (синдром красной шеи )ГипотонияАнафилаксияПсевдомембранозный колитКожные реакции (от незначительной сыпи до синдрома Стивена-Джонса)Лекарственная лихорадкаФлебитыНефротоксичностьОтотоксичность
- 202. Предосторожности Внутривенная инфузия более 1 чБезопасные сывороточные
- 203. Новые антибактериальные препараты последних летОксазолидиноны – новый
- 204. Новые возможности терапии грам+ инфекций Линезолид
- 205. Оксазолидиноны - общая характеристикаЛинезолид – первый за
- 206. Спектр активности линезолидаОсновное значениеStaphylococcus spp.Включая оксациллин- и
- 207. Характеристика антибактериального действияIn vitro – бактериостатикIn vivo – бактерицидное действиеПодавление продукции бактериями факторов вирулентности
- 208. Фармакокинетика и дозированиеМаксимальные концентрации в сыворотке12 –
- 209. Показания к клиническому применениюОсложненные и неосложненные инфекции
- 210. Ванкомицин или ленезолид?ВанкомицинПри инфекциях вызванных чувствительными штаммами
- 211. Другие препаратыТетрациклиныРифампинКо-тримоксазолФузидиевая к-таХлорамфениколНитрофураны
- 212. ДаптомицинНарушает функции цитоплазматической мембраныБактерицидная активность Резистентность встречается
- 213. Даптомицин - активностьSader et al. BMC Infect Dis 2007;7:29
- 214. Устойчивость MRSA VR E. faecium к даптомицину
- 215. Даптомицин и S. aureusWootton et al. Antimicrob Agents Chemother 2006;50:4195–4197
- 216. Даптомицин клиникаКлинические неудачи при дозе 2 мг/кг/день
- 217. Тигициклин S. aureus активностьWootton et al. Antimicrob Agents Chemother 2006;50:4195–4197
- 218. ТигициклинНизкие МПК в отношении грам (+)Резистентность редкаРазрешен
- 219. ЦефтобипролЦефалоспорин с анти-MRSA активностьюСвязывается с PBP2′Предварительные клинические
- 220. ЦефтобипролJones. Clin Microbiol Infect 2007;13 Suppl 2:17–24
- 221. Факторы, определяющие природную чувствительность/устойчивость бактерийАффинность мишеней к
- 222. Приобретенная резистентность Модификация собственного геномаМутации в генах
- 223. Биохимические механизмы резистентностиФерментативная инактивация препаратаМодификация мишени действияЗащита
- 224. Критерии чувствительности Enterobacteriaceae к бета-лактамам CLSI EUCAST ≤S/R> ≤S/R>Меропенем 4/16 2/8ДорипенемЦефоперазон/сульбактам нет нетЦефепим 8/32 1/8Цефтазидим 8/32 1/8Цефотаксим 8/64 1/2Цефоперазон 16/64 нет
- 225. Распределение МПК бета-лактамов в отношении E. coli - EUCAST
- 226. Сравнительная активность карбапенемов в отношении E. coli
- 227. Сравнительная активность карбапенемов в отношении P. aeruginosa
- 228. Распределение МПК в фторхинолонов в отношении «дикой» популяции S. pneumoniae - EUCASTЦипрофлоксацинЛевофлоксацинОфлоксацинМоксифлоксацин
- 229. Метилирование Ферменты – метилазы, гены ermA –
- 230. Активное выведение (эффлюкс)Близкородственные гены mefA, и mefE,
- 231. Наиболее распространенные фенотипы S.
- 232. Клиническая проблемаПри устойчивости связанной с эффлюксом можно
- 233. Алгоритм диагностики и рекомендаций по лечению
- 234. Фенотипы и генотипы устойчивости к макролидам Staphylococcus sppВид Ген Фенотип Маркер 14-15 16-СliМетилирование erm MLSB, инд. R S erm MLSB, конст R RЭффлюкс msrA MSB R S
- 235. Редкие механизмы устойчивостиМутации в генах 23S рРНКМутации в рибосомальных белках L4, L22Проявляются различными фенотипами
- 236. Клональность штаммов S. pneumoniae с двумя генами
- 237. ЧАСТОТА ВЫЯВЛЕНИЯ РЕЗИСТЕНТНЫХ ШТАММОВ S.PYOGENES В
- 238. Механизмы устойчивости S. pneumoniae в России
- 239. Клиническое применение макролидовДополнительные показания (резервные средства)Тонзиллофарингит, острый
- 240. МАКРОЛИДЫ ПРИ НЕТЯЖЕЛЫХ РЕСПИРАТОРНЫХ ИНФЕКЦИЯХ Как правило,
- 241. Область, определяющая устойчивость к хинолонам ~ 40
- 242. Ступенчатое формирования устойчивости к фторхинолонамУстойчивость parC gyrAparC gyrAparC gyrA1-я ступеньселекции2-я ступеньселекцииCiproRLevoR
- 243. Формирование устойчивости к фторхинолонам с «двойным действием»Устойчивость
- 244. Предиктор эффективности фторхинолонов ПФК/МПК30 – 40 ?100 и более ?
- 245. Фармакодинамика фторхинолоновWispelwey B., CID, 2005
- 246. Концентрации антибиотиков предотвращающие селекцию мутаций (MPC
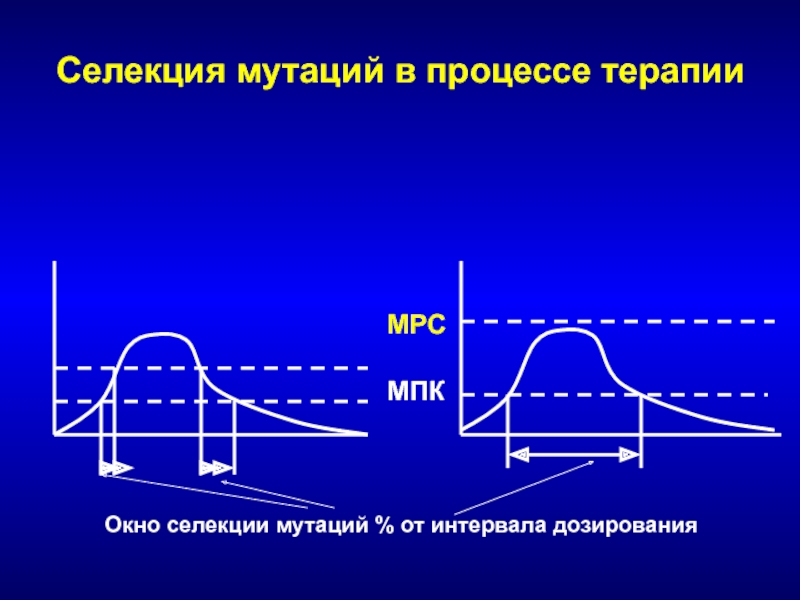
- 247. Селекция мутаций в процессе терапииОкно селекции мутаций % от интервала дозированияМПКMPC
- 248. r 2 0,91
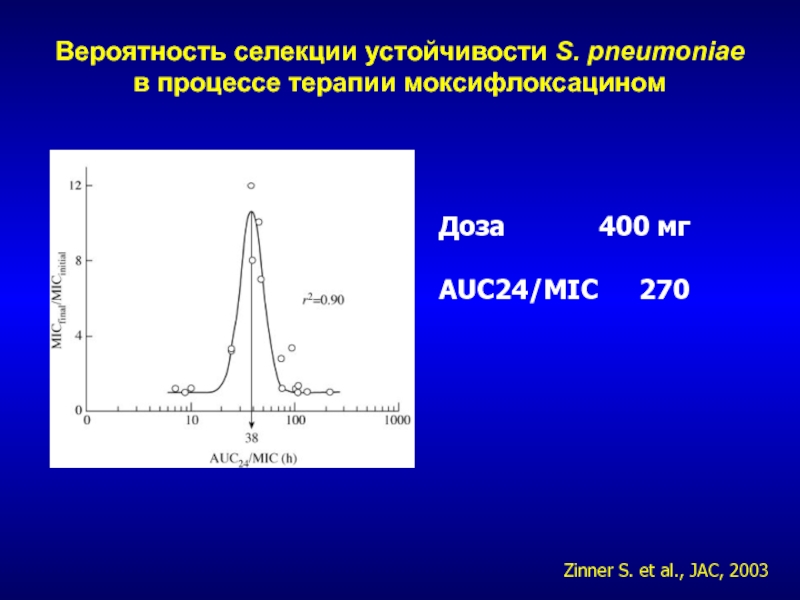
- 249. Вероятность селекции устойчивости S. pneumoniae в процессе терапии моксифлоксациномДоза 400 мгAUC24/MIC 270Zinner S. et al., JAC, 2003
- 250. Парадокс фторхинолонов в ИспанииGarcia-Rey C. et al.
- 251. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Клиническая фармакология антибиотиков
Кафедра факультетской терапии с курсом клинической фармакологии СибГМУ,
Томск.
Слайд 2Основная концепция
Подавление жизнедеятельности микроорганизмов – возбудителей инфекционных болезней способствует выздоровлению.
Антимикробные
ЛС – ЛС, избирательно угнетающие жизнедеятельность микрооганизмов:
не оказывая существенного токсического
воздействия на макроорганизмдействие на определённые виды бактерий
Слайд 3Антимикробные ЛС
Антибактериальные
Антимикобактериальные (противотуберкулёзные)
Противогрибковые
Противовирусные
Противопротозойные
Слайд 4Антибактериальная терапия
На долю АБ приходится 3-25% от общих назначений ЛС
Затраты
на проведение антимикробной терапии составляют до 30% бюджета лечебных учреждений,
50-60% от этой суммы приходится на долю АБ препаратовСлайд 5Этапы развития
«Магическая пуля» - P. Ehrlich, 1900-е
Препарат 606 для лечения
сифилиса
Открытие пенициллина
A. Fleming – 1929
Разработка лекарственного
Препарата
Florey & Chaini –
1940-eСинтез пронтозила
G. Domagk - 1935
Слайд 6Антибиотики и смертность от инфекционных болезней в развитых странах (P.
Periti , 1997)
Эр
Амп
Гент
Цфт
Амк
Ими
Цип
Ази
Ван
Феп
Мокс
Лин
Слайд 7Антибактериальные препараты
Антибиотики
(природные и
полусинтетические):
Вещества биологического происхождения или продукты их
химической модификации
Химиопрепараты
(синтетические)
Вещества не встречающиеся в живой природе
Слайд 8Характеристика микроорганизмов
Патогенность - способность микроорганизмов вызывать инфекционное заболевание у человека
Вирулентность
- степень патогенности
Метаболическая активность - продуцирование бактериями активных веществ (экзотоксинов,
ферментов и т.д.)Инвазивность - способность микроорганизмов преодолевать защитные барьеры
Слайд 9
Чувствительность микроорганизмов
Чувствительные
рост возбудителей прекращается при терапевтических концентрациях
АБ.
Умеренно чувствительные
для угнетения роста микроорганизмов требуются максимальные
дозы АБ.Устойчивые (резистентные) бактериостатический эффект может быть достигнут только in vitro при токсичных для человека концентрациях.
Слайд 10
Микробиологические термины
МПК (Минимальная подавляющая концентрация) - наименьшая концентрация АБ, способная
подавить видимый рост микроорганизма in vitro (мкг/мл или мг/л).
МПК 50
- минимальная подавляющая концентрация АБ для 50% исследованных штаммов (мкг/мл или мг/л).МПК 90 - минимальная подавляющая концентрация АБ для 90% исследованных штаммов (мкг/мл или мг/л).
Слайд 11
Микробиологические термины
МБК – минимальная бактерицидная концентрация, которая при исследовании in
vitro вызывает гибель 99,9% микроорганизмов от исходного уровня в
течение определённого периода времени, мкг/мл, мг/мл,_____________________________________________
Слайд 12Методы
Серийных разведений
В агаре
В бульоне
Макровариант
Микровариант
По количеству концентраций
«Длинный ряд»
По пограничным концентрациям
По способу
регистрации роста
Визуально
Спектрофотометрически
По ферментативной активности
Диффузионные
Диско-диффузионный
Е-тест
Слайд 14Распространение методов оценки чувствительности
Опрос 192 стационаров Европы
89% - диско-диффузионный метод
43%
- полуавтоматические методы
43.9% - Vitek
36.6% - ATB
9.8% - Walkaway
2.4% -
Autoscan70% - определение МПК
88.1% - Е-тест
11.9% - панели лабораторного изготовления
MacKenzie, CMI, 2006
Слайд 15РЕЗИСТЕНТНОСТЬ (%) P. aeruginosa К КАРБАПЕНЕМАМ В ОРИТ НЕСКОЛЬКИХ СТАЦИОНАРОВ*
Данные
РЕЗОРТ 2002-04
Слайд 16Терапевтическая широта
Терапевтическая широта определяется разницей между эффективными (Э) и токсическими
(Т) концентрациями
Концентрации, мкг/мл
Т
Э
Слайд 17
Параметры фармакокинетики АБ
Сmax – максимальная концентрация в сыворотке крови, мкг/мл.
AUC
– площадь под фармакокинетической кривой (отражает количество ЛС, поступившего в
кровь после однократного введения), мкг/мл/ч.Tmax - время, необходимое для достижения Сmax , ч.
Т1/2 (Период полувыведения) – время, необходимое для уменьшения концентрации препарата в крови вдвое.
Слайд 19Динамика антибактериальных эффектов в процессе лечения
Бактерицидный
эффект
Бактериостатический
эффект
Субингибирую
щий эффект
Постантибиоти-
ческий эффект
МБК
МПК
Концентрация антибиотика в
плазме
Время
Субингибирую
щий эффект
Слайд 20Предиктор эффективности
терапии АБ
это период времени, в течение которого концентрация антибиотика
в плазме крови превышает МПК.
Применение низких или субоптимальных доз антибиотиков
может быть одной из основных причин селекции мультирезистентных штаммов бактерий. Слайд 23Механизмы действия антибактериальных препаратов
Целостность
цитоплазматической
мембраны
Синтез
клеточной
стенки
Транскрипция
РНК
Биосинтез
нуклеотидов
Синтез
белка
Топо
изомераза
Полипептид
Репликация ДНК
иРНК
Пептидные антибиотики
-
Аминогликозиды
Макролиды
Тетрациклины
Хлорамфеникол
Фузидиевая
к-та
Срептограмины
Оксазолидиноны
Бета-лактамы
Гликопептиды
Фосфомицин
Бацитрацин
Изониазид
Циклосерин
Этамбутол
Этионамид
-
Хинолоны
Нитрофураны
Нитроимидазолы
Рифамицины
Сульфаниламиды
Триметоприм
Слайд 24
Резистентность
Природная
генетически обусловленное отсутствие чувствительности микроорганизма к АБ.
Приобретенная
первичная - имеет место до начала лечения АБ
вторичная - возникает или возрастает в процессе лечения АБ.Приобретенная:
хромосомная
плазмидная (экстрахромосомная)
Слайд 25Гипотеза «резервуара»
Swartz, M.N., 1997
Levy, S.B., 1998
Heinemann A.J., 2000
Частота резистентности
Время
Внедрение
АБ
Появление
клинических
R
штаммов
Снижение
потребления АБ
Увеличение
потребления
Слайд 26Причины появления и распространения резистентности
Избыточной применение АБ при легких или
вирусных инфекциях.
Неправильное использование АБ из-за отсутствия возможности приобрести наиболее
эффективные АБ.Недостаточные дозы и длительный прием АБ
Слайд 29Механизмы развития приобретенной резистентности
Изменение места (мишени) действия АБ в микробной
клетке : Streptococcus– к Макролидам, Линкозамидам.
Продукция ферментов, гидролизующих и инактивирующих
АБ: бета-лактамазы E. coli, Klebsiella – к Пеницил, Цеф.
Активное выведение АБ из микробной клетки (эффлюкс): Р. Aerugenosa –
к Карбапенемам.
Слайд 30Механизмы развития приобретенной резистентности
Изменение проницаемости клеточной стенки бактерий для АБ:
резистентность одновременно к нескольким антибиотикам - полирезистентность.
Формирование метаболических шунтов:
появление фермента дигидрофолат-редуктазы, не чувствительной к ингибированию триметопримом (Ко-тримоксазол), препятствует блоку синтеза фолиевой к-ты – резистентность к Ко-тримоксазолу.Слайд 31Предотвращение распространения резистентности
Знание механизмов формирования и распространения
Разработка и реализация мероприятий
по сдерживанию
Слайд 32РЕЗИСТЕНТНОСТЬ К АНТИБИОТИКАМ БАКТЕРИАЛЬНЫХ ВОЗБУДИТЕЛЕЙ НОЗОКОМИАЛЬНЫХ ИНФЕКЦИЙ В РОССИИ
РЕВАНШ 2006-07:
36 стационаров 26 городов
Слайд 34Основные группы антибактериальных препаратов
Бета-лактамы
Аминогликозиды
Фторхинолоны
Макролиды
Гликопептиды
Оксазолидиноны
Тетрациклины
Сульфаниламиды
Рифампин
Хлорамфеникол
Фосфомицин
Фузидиевая кислота
Полипептиды (полимиксин)
Слайд 36Механизм действия бета-лактамных антибиотиков
O
N
R
Цитоплазматическая
мембрана
Пенициллинсвязывающие белки - ПСБ
Бета-лактамное кольцо
Пептидогликановый каркас микробной
клетки
Замыкание поперечных сшивок между параллельными цепями
Блокада
ПСБ
Слайд 37Устойчивость к бета-лактамным антибиотикам
Цитоплазматическая
мембрана
ПСБ
Бета-лактамаза
O
Антибиотик
О
Образование
комплекса и разрушение антибиотика
Активный
фермент
N
N
N
O
Разрушенный антибиотик
Модифицированный
ПСБ со
сниженной аффинностью к антибиотикам
Слайд 38
Цитоплазматическая
мембрана
ПСБ
Бета-лактамаза
O
Ингибитор
О
N
N
Ингибиция бета-лактамаз
Образование стабильного комплекса
фермент-ингибитор
«Суицидная» ингибиция
бета-лактамазы
Слайд 39Классификация бета-лактамных антибиотиков
I. Пенициллины
I. Пенициллины
1.Природные
Бензилпенициллин (K, Na,
новокаиновая соли)
Бензатин бензилпенициллин (Бициллин-1),
Комбинированные пенициллины - Бициллин-3, Бициллин-5
Феноксиметилпенициллин,
бензатин феноксиметилпенициллин2.Полусинтетические
1.Пенициллиназостабильные
Метициллин - исторический интерес
Оксациллин
Клоксациллин, диклоксациллин
2.Аминопенициллины 3.Карбоксипенициллины 4.Уреидопенициллины
Ампициллин Карбенициллин Азлоциллин
Амоксициллин Тикарциллин Мезлоциллин
Пиперациллин
Слайд 40Классификация бета-лактамных антибиотиков Цефалоспорины
I поколение II поколение III поколение IV
поколение
Парентеральные Парентеральные Парентеральные Парентеральные
Цефалотин Цефуроксим Цефотаксим
Цефазолин Цефамандол Цефтриаксон Цефепим
Цефокситин*
Цефоперазон** ЦефтобипролЦефотетан* Цефпирамид**
Цефметазол* Цефтазидим**
Оральные Оральные Оральные
Цефалексин Цефаклор Цефиксим
Цефадроксил Цефуроксим-ак Цефподоксим
Цефтибутен
* выраженная атианаэробная активность (цефамицины)
** выраженная активность в отношении P. aeruginosa и неферментирущих
Слайд 41Классификация бета-лактамных антибиотиков
III. Карбапенемы IV. Монобактамы
Имипенем Азтреонам
Меропенем
Эртапенем
Дорипенем
V. Комбинированные (защищенные) препараты
Ампициллин/сульбактам
Амоксициллин/клавуланат
Тикарциллин/клавуланат
Пиперациллин/тазобактам
Цефоперазон/сульбактам
Ампициллин/оксациллин
Слайд 42Спектр активности бета-лактамов
Природные → уреидопенициллины
Значительное расширение грам (-) активности
Некоторое снижение
грам (+)
Цефалоспорины I → III поколение
Значительное расширение грам (-) активности
Некоторое
снижение грам (+)Цефалоспорины IV поколения
Повышение грам (+) активности
Карбапенемы
Активны практически в отношении всех бактерий
Слайд 43Устойчивость к бета-лактамным антибиотикам
Ферментативная инактивация
Бета-лактамазы
Модификация мишеней действия
Появление низко-аффинных пенициллинсвязывающих белков
Активное
выведение
Эффлюксные системы семейства RND (resistance nodulation division)
Слайд 44Основные классы бета-лактамаз
Сериновые бета-лактамазы
Классы А, С и D
Металло-бета-лактамазы
Класс В
Слайд 45Характеристика бета-лактамаз
Ферменты
1.Стафилококковые, плазмидные, класс А
2.Плазмидные грам (-) бактерий широкого спектра,
класс А
3.Плазмидные грам (-) бактерий расширенного спектра, класс А
4. Хромосомные
грам (-) бактерий, класса А5.Хромосомные грам (-) бактерий, класс С
6.Хромосомные грам (-) бактерий, класс В
Характеристика
Гидролизуют природные и полусинтетические пенициллины кроме метициллина и оксациллина. Чувствительны к ингибиторам
Гидролизуют природные и полусинтетические пенициллины, цефалоспорины I поколения Чувствительны к ингибиторам
Гидролизуют природные и полусинтетические пенициллины, цефалоспорины I -IV поколений Чувствительны к ингибиторам
Гидролизуют природные и полусинтетические пенициллины цефалоспорины I - II поколений Чувствительны к ингибиторам
Гидролизуют природные и полусинтетические пенициллины цефалоспорины I - III поколений Не чувствительны к ингибиторам
Эффективно гидролизуют практически все беталактамы, включая карбапенемы.Не чувствительны к ингибиторам
Слайд 48Природные пенициллины
Преимущества:
Мощное бактерицидное действие:
Г (+) кокки: стрептококки, особенно БГСА
Г (-) кокки: менингококки
Г (+) палочки: возбудители сибирской язвы
Спирохеты: бледная
трепонема, лептоспиры, боррелииАнаэробы: спорообразующие - Клостридии
неспорообразуюшие – пептококк, пептострептококк
актиномицеты.
Низкая токсичность.
Низкая стоимость.
Слайд 50Природные пенициллины
Недостатки:
Приобретённая резистентность:
Г (+) кокки: стафилококки, пневмококки (β-лактамазы)
Г (-) кокки:
гонококк
Анаэробы: бактероид – фузобактерии (основной
представитель неспорообразующих анаэробов кишечника B. Fragilis)
Высокая аллергенность, перекрёстная со всеми пенициллинами
Слайд 51Природные пенициллины
Показания:
Инфекции БГСА: тонзиллит, фарингит, рожа, скарлатина, острая ревматическая
лихорадка.
Внебольничная пневмококковая пневмония.
Менингит у взрослых и детей > 2 лет.
Инфекционный
эндокардит.Сифилис.
Боррелиоз. (болезнь Лайма).
Сибирская язва
Анаэробные: газовая гангрена столбняк.
Актиномикоз.
Слайд 52Полусинтетические пенициллины
Оксациллин - Антистафилококковый пенициллин
Активен в отношении
МSSA (OSSA) -
метициллин (оксациллин) –чувствительных
S.
aureus, т.к. устойчив к действию пенициллиназы (из группы β-лактамаз), которую продуцируют 80-90% штаммов S. aureus.Показан для лечения стафилококковой инфекции, вызванной МSSA (OSSA).
Следует учитывать: в стационарах (ОРИТ) распространены штаммы S. Aureus резистентные к метициллину (оксациллину) – MRSA.
Слайд 53Появление метициллинрезистентности
Метициллин: полусинтетический пенициллин, устойчивый к действию стафилококковых бета-лактамаз
Устойчивость к
метициллину, не связанная с гидролизом антибиотика
Barber. M., J. Clin. Pathol.
1961Jevons M.P., BMJ. 1961
Rolinson J.N., BMJ. 1961
Acar J.R., Courvalin P., Chabert Y.A. Methicillin-resistant staphylococcemia: bacterilogical failure of treatment with cephalosporins. Antimicrob. Agents Chemother. 1970, 10, 280 - 285.
Слайд 54Механизм устойчивости
Sens. Rez
ПСБ1
ПСБ2
ПСБ2а
ПСБ3
ПСБ4
Дополнительный пенициллинсвязывающий белок
Kuhl S.A., 1978
Brown D.F.J., 1980
Низкая аффинность ко
всем β-лактамам
Клиническая неэффективность всех β-лактамов
Слайд 56Staphylococcal cassette chromosome mec (SSCmec) [Chongtrakool P., 2006]
mecA – комплекс
ccr
– комплекс
(рекомбиназа)
Слайд 57Эпидемиология ORSA
Параллельные процессы
Клональное распространение штаммов и эволюция основного генома
Горизонтальный перенос
и эволюция подвижного генетического элемента SSCmec хромосомной локализации
Приобретение SSCmec редкое
явлениеПоявление устойчивости в процессе терапии практически не реально
Слайд 58Типирование MRSA
Типирование основного генома
MLST – multilocus sequence typing
Spa –
staphylococcal protein A
Типирование подвижного элемента SSCmec
mecA – комплекс
ccr -
комплексСлайд 61Клональность MRSA в Москве Афанасьев М.А., Ильина Е.Н., Сидоренко С.В., и
соавт.
Клональный комплекс СС8/239
82.0% ST8
11.3% ST239
Клональный комплекс CC5
1.6% ST641
Клональный комплекс СС1
4.8% ST1
Слайд 62Методы оценки чувствительности стафилококков
Серийных разведений
Диско-диффузионный
Скрининг на агаре
Серологическая детекция ПСБ2а
ПЦР детекция
mecA гена
Слайд 63Критерии чувствительности стафилококков
методом серийных разведений
Критерии чувствительности к оксациллину
S. aureus и S. epidermidis различны
S. aureus S.
epidermidisS ≤2 ≤0,25
I - -
R ≥4 ≥0,5
Слайд 64CLSI - 2006
Использование дисков с цефокситином предпочтительнее
Выдача ответа
Оксациллинчувствительный
Оксациллинустойчивый
При оценке
S. lugdunensis
Только цефокситин
Слайд 65Оценка чувствительности к оксациллину - цефокситину
CLSI – 2006
Res Susc
S.
aureus ≤19 ≥20
S. lugdunensis ≤19 ≥20
CoNS ≤24 ≥25
Слайд 67Происхождение метициллинрезистентности
Ген mecA
Дополнительный ПСБ – ПСБ2а
Происхождение неизвестно
Наибольшая гомология c ПСБ
Staph. sciuri
Микроорганизм чувствителен
Входит в состав уникального подвижного генетического элемента «островка
резистентности» - “Staphylococcal cassette chromosome mec” 21 – 67 kb
Слайд 68Устойчивость S. aureus к метициллину (оксациллину) – MRSA
Все бета-лактамные антибиотики
не эффективны
Первое сообщение – 1961 г.
2000 – 2001 гг.
В отдельных
географических регионах до 30 – 40% штаммов S. aureus, циркулирующих в реанимации – MRSAДля преодоления устойчивости синтезированы
Гликопептиды - ванкомицин
Стрептограмины - синерцид
Оксазолидиноны - линезолид
Липопептиды – даптомицин
Глицилциклины – GAR-936
Слайд 69Внебольничные ORSA
Штаммы генетически связанные с госпитальными
Штаммы генетически не связанные
с госпитальными
Относятся к IV SCCmec типу
Чувствительны к антибактериальным препаратам (кроме
бета-лактамов)Продуцируют лейкоцидин Пантона-Валентайна
Тяжелые инфекции кожи и мягких тканей
Некротизирующая пневмония
Слайд 71Распространение ORSA в России при нозокомиальных инфекциях
1995 – 1996 2000
– 2001 2003
[С.В. Сидоренко] [А.В. Дехнич] [С.В.Сидоренко]
Диапазон 0 – 40% 0 – 89.5% -
В среднем 9.5% 33.5% 64.9%
Наибольшая
частотаОРИТ
Ожоговые
Травматология
Неонаталогия
Слайд 72Динамика распространение устойчивости среди ORSA к антибактериальным препаратам разных групп
Слайд 73Аминопенициллины
Ампициллин
Более расширенный спектр антимикробной активности:
- Г (-)
бактерии: E. Coli, сальмонеллы, H. influenzae.
- более активен в
отношении энтерококков E. Fаecalis.Амоксициллин
Производное ампициллина с улучшенной кинетикой при приёме внутрь. Ведущий пероральный антибиотик.
Лучше действует на S. pneumoniae, H. pylori.
Не активны против Г (-) возбудителей нозокомиальных инфекций: синегнойная палочка – P. aeruginosa, Klebsiella, PRSA – разрушаются β-лактамазами.
Слайд 74Аминопенициллины
Показания:
Инфекции ВДП: острый средний отит, синусит.
Инфекции НДП: внебольничная
пневмония.
Эрадикация H. pylori. (Амо)
Инфекции желчевыводящих путей (АМП)
Сальмонеллёз (АМП)
Бактериальный менингит (АМП)
Бактериальный
эндокардит (АМП).Нежелательные реакции:
Диспепсические расстройства.
Ампициллиновая сыпь – 5-10%.
Нарушения кишечной микрофлоры.
Слайд 75Антисинегнойные пенициллины
Карбоксипенициллины: карбенициллин, тикарциллин.
Уреидопенициллины: азлоциллин, пиперациллин.
Достоинства:
Антисинегнойная
активность (P. Aeruginosa) :
Пиперациллин > Тикарциллин =
Азлоциллин > Карбенициллин.Обязательно в комбинации с аминогликозидами II – III поколения или Ципрофлоксацином.
Слайд 76Ингибиторозащищённые пенициллины
Соединения, инактивирующие β-лактамазы: клавулоновая кислота (клавуланат),
сульбактам, тазобактам.
Механизм резистентности значимый для S. aureus, H. influezae, M.
catarrhalis, E. coli, Klebsiella pneumoniae.Апициллин/сульбактам имеет преимущество над Амоксициллином/клавуланатом при инфекциях, вызванных ацинетобактером.
Ампициллин/сульбактам – + инфекции костей и суставов.
Слайд 77Ингибиторозащищённые пенициллины
Показания к лечению бактериальных инфекций:
ВДП: о. и хр. синусит,
о. отит, эпиглоттит.
НДП: обострение ХОБЛ, внебольничные и госпитальные пневмонии.
ЖВП: о.
холецистит, холангит.МВП: пиелонефрит, цистит.
Интраамбдоминальные и тазовые инфекции.
Кожи и мягких тканей.
Сепсис.
Периоперационная профилактика.
Слайд 78Частота вероятной продукции AmpC
Исследование «MICROMAX», Сидоренко и соавт. 1999
Учреждение Enterobacter -
Serratia
Москва
ГКБ им. Боткина 5
ГКБ 7 22
ГКБ 15 9
ИХ им. Вишневского 0
НЦХ 10
МЦ Президента 6
Смоленская мед. Академия 23
ГБ
Екатеринбурга 13Слайд 79Частота (%) вероятной продукции бета-лактамаз расширенного спектра в ОИТР (Исследование
«MICROMAX», Сидоренко и соавт. 1999)
Учреждение E. coli Kl. spp
Москва
ГКБ им. Боткина 40 93
ГКБ 7 16 92
ГКБ
15 48 58ИХ им. Вишневского 16 61
НЦХ 32 42
МЦ Президента 8 0
Смоленская мед. Академия 8 75
ГБ Екатеринбурга 43 88
Слайд 80Распространение CTX-M бета-лактамаз в России [Edelstein M., et al, AAC,
2003]
E. coli – 494 штаммов
ESBL фенотип – 15.8%
CTX-M – 35.9%
(n=28)CTX-M-1 группа – 20 изолятов
CTX-M-2 группа– 8 изолятов
K. pneumoniae – 410 штаммов
ESBL фенотип – 60.8%
CTX-M – 34.9% (n=87)
All CTX-M-1 группа (CTX-M-1, CTX-M-15)
Слайд 81CTX-M происхождение
Первичные хозяева – хромосомная локализация
CTX-M-2 группа Kluyvera ascorbata
CTX-M-8
группа Kluyvera georgiana
CTX-M-1 группа – не известны
CTX-M-9 группа – не
известныCTX-M-25 группа – не известны
Вторичные хозяева – плазмидная локализация
Salmonella spp.
E. coli
Klebsiella spp.
Enterobacter spp.
Proteus spp.
Citrobacter
Слайд 82БЛРС в России
1996 г. - Первое сообщение (Сидоренко и соавт.)
БЛРС группы CTX-M S. typhimurium
1999 г. – Исследование MICROMAX (Сидоренко
и соавт.)Учреждение E. coli Kl. spp
Москва
ГКБ им. Боткина 40 93
ГКБ 7 16 92
ГКБ 15 48 58
ИХ им. Вишневского 16 61
НЦХ 32 42
МЦ Президента 8 0
Смоленская мед. Академия 8 75
ГБ Екатеринбурга 43 88
Появление БЛРС в стационарах России прошло незамеченным
Продуценты БЛРС стали эндемичными в ОРИТ
Слайд 83Практически важные свойства AmpC бета-лактамаз
Распространение
Хромосомы большинства грам (-) бактерий
(кроме Klebsiella spp.)
Описана мобилизация на плазмиды
Характер продукции
Индуцибельный
Enterobacter, Serratia, Morganella, Citrobacter
Конститутивно
низкий Escherichia, Proteus, Shigella
Переключение на конститутивно высокую продукцию в результате мутаций
Большинство грам (-) бактерий
Слайд 84Klebsiella spp. продуценты бета-лактамаз класса С (АмрС)
212 штаммов со сниженной
чувствительностью к цеф. III
34 демонстрировали AmpC фенотип
MOX-2 8.8%,
CMY-1 0.3%
CMY-2
23.5%DHA-1 32.4%
LAT-1 0.3%
MIR-1 14.7%
Нет 14.75%
Дополнительно
TEM 79.4%
SHV 67.6%
CTX 14.7%
OXA 17.6%
В среднем 2.6 бета-лактамазы на штамм
Слайд 86Цефалоспорины
Общие свойства:
Бактерицидное действие
Широкий терапевтический диапазон
Перекрёстная аллергия у
5-10% больных с аллергией на пенициллин
Не действуют на MRSA, энтерококки,
листерииРазрушаются БЛРС
Синергизм с аминогликозидами
Слайд 87Цефалоспорины
Цефалоспорины I → III поколение
Значительное расширение грам
(-) активности
Некоторое снижение грам (+)
Цефалоспорины IV поколения
Повышение грам (+) активности
Слайд 88Показания для применения цефалоспоринов I поколения
Парентеральные - цефазолин
Периоперационная профилактика в
хирургии
Подтвержденные стафилококковые инфекции
Оральные - цефалексин, цефадроксил
Стрептококковый тонзиллофарингит;
Внебольничные инфекции кожи и
мягких тканей легкой и среднетяжелой степени.Слайд 89Показания для применения цефалоспоринов II поколения
Парентеральные - цефуроксим натрия
внебольничная пневмония,
требующая госпитализации;
внебольничные инфекции кожи и мягких тканей;
Инфекции МВП (пиелонефрит средней
степени тяжести и тяжелый);периоперационная профилактика в хирургии.
Оральные - цефуроксим-аксетил, цефаклор
Инфекции ВДП и НДП (отит, синусит, обострение хронического бронхита, внебольничная пневмония);
Инфекции МВП (пиелонефрит легкой и средней степеней тяжести);
внебольничные инфекции кожи и мягких тканей легкой и средней степеней тяжести.
Слайд 90Показания для применения парентеральных цефалоспоринов III поколения - цефотаксим, цефтриаксон
Внебольничные
инфекции:
острая гонорея;
острый средний отит (цефтриаксон).
Тяжелые внебольничные инфекции:
инфекции НДП (пневмония, абсцесс
легкого, эмпиема); тяжелые формы инфекций МВП;
тяжелые формы инфекций кожи, мягких тканей, костей, суставов;
интраабдоминальные инфекции;
инфекции органов малого таза;
генерализованный сальмонеллез;
менингит;
сепсис.
Слайд 91Показания для применения парентеральных цефалоспоринов III поколения - цефтазидим, цефоперазон
Тяжелые
внебольничные и нозокомиальные инфекции различной локализации при подтвержденной или вероятной
этиологической роли P.aeruginosa и других неферментирующих микроорганизмов.Инфекции на фоне нейтропении и иммунодефицита (в том числе фебрильная нейтропения)
Слайд 92Показания для применения оральных цефалоспоринов III поколения
Цефиксим, цефтибутен
Инфекции МВП: пиелонефрит
легкой и средней степени тяжести, пиелонефрит у беременных и кормящих,
острый цистит и пиелонефрит у детей.Ступенчатая терапия различных тяжелых внебольничных и нозокомиальных инфекций после достижения стойкого эффекта от применения парентеральных препаратов.
Инфекции дыхательных путей (не рекомендуется применять цефтибутен при возможной пневмококковой этиологии).
Слайд 93Показания для применения цефалоспоринов IV поколения
Тяжелые, преимущественно нозокомиальные инфекции, вызванные
полирезистентной микрофлорой:
инфекции НДП (пневмония, абсцесс легкого, эмпиема);
осложненные инфекции МВП;
инфекции кожи, мягких тканей, костей, суставов;
интраабдоминальные инфекции;
сепсис.
Инфекции на фоне нейтропении и других иммунодефицитных состояний
Слайд 94Эволюция бета-лактамаз класса А
Выделение стафилококковой беталактамазы - 1944 г. (Сан-Франциско)
- класс А
Выделение беталактамазы широкого спектра E.coli - 1963 г.
(Афины) - класс АТЕМ-1, ТЕМ-2, SHV-1
Выделение беталактамаз расширенного спектра K.pneumoniae - 1985 г. (Франция) - класс А
TEM-тип
SHV-тип
CTX-тип
Слайд 95Клиническое значение AmpC бета-лактамаз
Селекция гиперпродуцентов возможна в процессе лечения тяжелых
инфекций цефалоспоринами III поколения(на фоне высокой обсемененности очагов инфекции)
Госпитальная пневмония
Бактериемия
При
лечении легких и среднетяжелых инфекций селекции обычно не происходитИнфекции мочевыводящих путей
Слайд 97MYSTIC, Россия Устойчивость энтеробактерий к цефалоспоринам III обусловленная продукцией БЛРС
и AmpC
Слайд 99Карбапенемы – антибактериальная активность
Наиболее широкий спектр антимикробной активности
Грам(+)
Грам(-)
Анаэробы
Наиболее высокая и
стабильная активность in vitro против Грам(-) микроорганизмов
Enterobacteriaceae
Pseudomonas aeruginosa
Acinetobacter spp.
Не активны:
MRSA, Г (-): B. cepacia, S. Maltophilia.Слайд 100Различия в антимикробной активности меропенема и имипенема
Грамположительные бактерии
Имипенем более активен
против энтерококков и пневмококков
Клинического значения не имеет
Грамотрицательные бактерии
Меропенем более
активен Клинически значимое преимущество при инфекциях, вызванных P.aeruginosa и Burkholderia cepacia
Анаэробные бактерии
Активность и эффективность одинаковая (>клиндамицина и метронидазола)
Слайд 101Карбапенемы
Структурное сходство с другими β-лактамными АБ.
Показания: тяжёлые инфекции, в т.ч.
госпитальные (полирезистентные микроорганизмы, смешанная микрофлора)
Слайд 102Карбапенемы
Имипенем/Циластатин 1:1(Тиенам)
- Циластатин – ингибитор дегидропетидазы I, образующейся в
почках. Без циластатина Имипенем разрушается этим ферментом и не создаются
терапевтические концентрации ЛС в моче.- Нейротоксичность (судороги) – нельзя при менингите. Можно при менингите – Меро
Аллергические реакции (редко – перекрёстная с пенициллинами) – Имип, Меро
- Синегнойная палочка способна быстро вырабатывать устойчивость к имипенему.
Слайд 103Активность бета-лактамов в отношении P. aeruginosa
Препараты в порядке убывания активности
Дорипенем
> меропенем > имипенем > цефалоспорины IV поколения = цефтазидим
> цефоперазон = цефпирамид = уреидопенициллины > карбоксипенициллиныМеханизмы устойчивости
гиперпродукция хромосомных бета-лактамаз
снижение проницаемости
активное выведение
возможны многочисленные фенотипы
Продукция металло-бета-лактамаз
Слайд 104Структура эффлюксного насоса
Внешняя
мембрана
Периплазматическое
пространство
Цитоплазматическая
мембрана
Антибиотик
Белки внешней
Мембраны
OprJ, M, N
Линкерные протеины
MexA, C, E,
X
Экспортирующие протеины
MexB, C, F, Y
Слайд 105Карбапенемазы
Класс А – NMC, IMI, SME, KPC, GES, SHV
Преимущественно Enterobacteriaceae,
различной локализации, некоторые не гидролизуют цефалоспорины III поколения
Класс D –
ОХА-23, 27Преимущественно Acinetobacter spp.
Класс В – металлоэнзимы (IMP-1-9, VIM-1-3, SPM)
Преимущественно Pseudomonas spp., Acinetobacter spp., различной локализации, не гидролизуют азтреонам
Слайд 108Металло-бета-лактамазы в России
VIM-тип, IMP-тип
Санкт-Петербург
Москва
Ярославль
Саратов
Казань
Магнитогорск
Екатеринбург
Омск
Томск
Иркутск
Слайд 109Предпосылки для быстрого распространения
Локализация генов в составе подвижных генетических элементов
– интегронов
Обеспечивают перемещение генетической информации между молекулами ДНК (плазмида –
хромосома)Локализованы в составе подвижных элементов более высокого уровня (плазмид, транспозонов)
Слайд 111Детекция металло-бета-лактамаз
Фенотипические методы
Основаны на ингибиции MBL
Диско-диффузионные
Серийных разведений
Гидролиз карбапенемов
Генотипические методы
ПЦР
Гибридизация
Клонирование
и секвенирование
Слайд 113Перекрестная устойчивость P. aeruginosa к бета-лактамным антибиотикам
Тик S r/R R S
Тик+клав S/r r/R R S/r
Пипер S r/R r/R S
Пипер+таз S r/R r/R S
Цефтаз S r/R r/R S
Цефепим S S/r R S
Ими S S S R
Меро S S r r
AmpC Эффл OprD(-)
Слайд 114Различия в антимикробной активности меропенема и имипенема
Грамположительные бактерии
Имипенем более активен
против энтерококков и пневмококков
Клинического значения не имеет
Грамотрицательные бактерии
Меропенем более
активен Клинически значимое преимущество при инфекциях, вызванных P.aeruginosa и Burkholderia cepacia
Анаэробные бактерии
Активность и эффективность одинаковая (>клиндамицина и метронидазола)
Слайд 115Больничный формуляр антибиотиков - карбапенемы
Имипенем
Госпитальные инфекции
Меропенем
Госпитальные инфекции
Особые показания:
Менингит
P.aeruginosa
Слайд 116Макролиды, кетолиды, линкозамиды и стрептограмины Объединены в одну группу общим механизмом
действия
Слайд 119Линкозамиды и стрептограмины
Линкозамиды
Линкомицин
Клиндамицин
Стрептограмины
Стрептограмин А и В
Слайд 120Эритромицин vs. современные макролиды
Параметр Азитро Кларитро 16-ти чл.
Спектр акт. ≈ Эри ≈ Эри
≈ Эри
Уровень акт. ≈ Эри ≈ Эри ≈ Эри
ЭритроR штаммы R R S -
RСтабильность > Эри > Эри > Эри
Биодоступность > Эри > Эри > Эри
Дозирование 1 кр. 2 кр. 2 - 3 кр.
Безопасность > Эри > Эри > Эри
Слайд 121Механизм действия
Несмотря на различия в химической структуре макролидные и линкозамидные
антибиотики обладают одинаковым механизмом действия
Слайд 122Структура бактериальной рибосомы
50S субъединица
Рибонуклеиновые кислоты
23S рРНК
5S рРНК
Рибосомальные белки
30S субъединица
Рибонуклеиновые кислоты
5S
рРНК
Рибосомальные белки
30 S
50 S
Пептидил трасферазный центр
Слайд 123Механизм действия макролидов
5S рРНК
Домен V
Домен II
Пептидил трансферазный центр
5S рРНК
5S рРНК
2058
752
V
II
V
II
Эритромицин
Телитромицин
2058
752
30S
50S
O
O
O
-cladinose
Слайд 125Макролиды: общие свойства
Преимущественно бактериостатическое действие.
Высокие концентрации в тканях (в 5-10-100
раз выше плазменных).
Низкая токсичность (особенно 16-членные – можно у детей
и беременных).Нет перекрёстной аллергии с β-лактамными АБ.
Диспептические явления (прокинетическое действие у 20-30%).
Пилоростеноз у новорождённых (можно - 16-членные – спирамицин, мидекамицин)
Слайд 126Спектр антимикробной активности макролидов
Грам (+)
Streptococcus spp.
S.pneumoniae
Staphylococcus spp
C. diphtheriae
Микобактерии
Атипичные
Mycoplasma
Кроме M.
hominis
Chlamydia
Ureaplasma
Грам (-)
M.catarrhalis
Legionella spp.
H. pylori
Campylobacter spp.
N.gonorrhoeae
N.meningitidis
B. pertussis
Слайд 130Механизмы устойчивости к макролидам
Модификация мишени
Метилирование (erm -гены)
Мутации в генах рРНК
Мутации
в генах рибосомальных белков L4, L22
Активное выведение (mef - гены)
(эффлюкс)
Ферментативная
модификацияВстречается у грамотрицательных бактерий
СН3
Слайд 133Клиническое применение макролидов
Основные показания
Внебольничная пневмония
Урогенитальный хламидиоз и микоплазмоз
Легионеллез
Эрадикация H.pylori (Клар)
Токсоплазмоз
(Спир, Клар, Рокс, Азитро)
Ородентальные инфекции: Периодонтит (Спирамицин – Ровамицин, Азитро,
Клар)Профилактика эндокардита
Дифтерия, коклюш
Слайд 134ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ВЫБОР МАКРОЛИДОВ ПРИ РЕСПИРАТОРНЫХ ИНФЕКЦИЯХ
Микробиологическая активность
-
16-членные макролиды сохраняют активность
в отношении ряда эритромицинорезистентных
штаммов стрептококков
Частота
НЛР со стороны ЖКТ (диарея и др.)
- эритромицин, кларитромицин - наиболее выраженное мотилиноподобное действиеРиск лекарственных взаимодействий - эритромицин > кларитромицин=азитромицин > джозамицин
Кратность приема, длительность курса терапии
Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С. Страчунского и соавт, Смоленск: МАКМАХ, 2007 г.
Слайд 135Линкозамиды: Линкомицин, Клиндамицин
Бактериостатическое действие.
Активность: Г(+) кокки, неспорообразующие анаэробы (Альтернативный
препарат).
Перекрёстная устойчивость к обоим ЛС.
Высокие Сmax в костях и суставах
(остеомиелит).Плохо проникают через ГЭБ.
Частое развитие антибиотико-ассоциированной диарреи (C. difficile – ассоцированной – псевдомембранозный колит).
Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С. Страчунского и соавт, Смоленск: МАКМАХ, 2007 г.
Слайд 137Общая структура хинолонов
N
1
4
6
7
О
COOH
F
X
R
R
R
R
Налидиксовая кислота - 1962 1967
Норфлоксацин - 1978 1986
Слайд 138Хлорохин
Хинолоны Нафтуридоны
Налидиксовая к-та
Норфлоксацин Эноксацин
Тосуфлоксацин
Тровафлоксацин
Гемифлоксацин
Офлоксацин Ципрофлоксацин
Левофлоксацин
Грепафлоксацин
Спарфлоксацин
Клинафлоксацин
Моксифлоксацин
Гатифлоксацин
«Родословное дерево» хинолонов
Слайд 139Хинолоны в России
Нефторированные
Налидиксовая к-та
Пипемидиевая к-та
Оксолиниевая к-та
Фторированные
Норфлоксацин
Пефлоксацин
Ципрофлоксацин
Офлоксацин
Ломефлоксацин
Левофлоксацин
Спарфлоксацин
Моксифлоксацин
Гемифлоксацин
Слайд 141Организация бактериальной хромосомы и механизм действия хинолонов
Бактерия 2 – 5
мкм
Хромосома 1 500 мкм
Суперспирализация
ДНК - гираза
?
Бинарное деление клетки
Репликация хромосомы
Топоизомераза IV
Слайд 142Мишени действия хинолонов –
ДНК-гиразы и топоизомеразы IV
Суперспирали
Катенаны
Узлы
Топо IV
Гираза
Гираза
Топо IV
Топо IV
Топо IV
Слайд 143Механизм действия хинолонов
Для изменения суперспирализации необходимо внести разрыв в одну
нить ДНК и провести через разрыв другую. После чего восстановить
целостностьХинолоны блокируют процесс на стадии разрыва, что приводит к летальному эффекту
ДНК
ДНК
Гираза
Хинолон
Слайд 144Чувствительность мишеней к различным хинолонам (IC50, мкг/мл)
E. coli –Ранние хинолоны
более активны в отношении ДНК-гиразы
(первичная мишень)
S. pn. –Ранние хинолоны более
активны в отношении Топо IV (первичная мишень)
-Новые хинолоны практически одинаково активны в отношении
обеих мишеней (двойное действие)
Слайд 145Сравнительная активность в отношении Грам (-) флоры
Нор Ципро*, Пефло, Офло,
Лево,
Мокс, Спар
-----------------------------------------------------Neisseria spp, Haemophilus + ++
E.coli, Salmonella ++ ++
Shigella, P.vulgaris
Klebsiella, Enterobacter + ++
P.mirabilis, Morganella
Providencia, Serratia
P.aeruginosa., Acinetobacter - +*/-
S.maltophilia
B.cepacia - +*/-
Слайд 146Сравнительная активность в отношении Грам (+) флоры и других микроорганизмов
Нор Ципро
Лево Мокс,
Пефло Спар
Офло Геми
----------------------------------------------------------------------------Staph. spp +/- + + ++
Streptococcus spp. - +/- + ++
Enterococus spp. - +/- + ++
Chlamydia - +* + +
Mycoplasma - +* + ++
Анаэробы - - - -/+
Слайд 147Распределение МПК фторхинолонов в отношении «дикой» популяции S. pneumoniae -
EUCAST
Ципрофлоксацин
Левофлоксацин
Офлоксацин
Моксифлоксацин
Слайд 148Устойчивость к хинолонам
Детерминанты локализованные на хромосоме
Модификация мишеней - мутации в
генах ДНК-гиразы и топоизомеразы IV
Активация механизмов активного выведения
Детерминанты локализованные на
плазмидахГены qnr – кодируют белки осуществляющие защиту мишени
Гены aac(6’)-Ib – кодируют аминогликозид ацетилтрансферазу – ацетилирование норфлоксацина и ципрофлоксацина
Многочисленные устойчивые штаммы без известных детерминант
Слайд 149Механизмы устойчивости к хинолонам
[Heddle.J. AAC, 2002]
Мутации в «области детерминирующей устойчивость
к хинолонам» - «quinolone-resistance–determining region» ДНК-гиразы и топоизомеразы IV
Слайд 150Фенотипы устойчивости к хинолонам грам (+)
Нал. к-та - - - -
Нор - - - -
Ципро, Офло, S R R R
Пефло, Ломе
Лево S S R R
Спар, Мокси
S S S R
Слайд 151Фенотипы устойчивости к хинолонам грам (-)
Нал. к-та S R R R
Нор S S R R
Ципро, Офло, S S S R
Пефло, Ломе,
Лево S S S R
Спар, Мокси
S S S R
Слайд 152Динамика устойчивости S. pneumoniae к фторхинолонам в Канаде
Canadian Bacterial Surveillance
Network, March 2006
Слайд 153Неудачи лечения пневмонии фторхинолонами
Зафиксированы на фоне применения ципро- и левофлоксацина
Зафиксированы
случаи развития резистентности в процессе терапии ципро- и левофлоксацином
Fuller J.D,
CID, 2005Слайд 154Клиническое значение - фторхинолоны средства выбора
Нор Ципро*, Офло Лево Мокс
Пефло Спар
---------------------------------------------------
Инфекции МВП
- цистит + + -
- пиелонефрит +/- + +*
--------------------------------------------------------------------------------------
Длительность терапии
- цистит 3 3 -
- пиелонефрит 14 14 14
-возможна ступенчатая терапия
Слайд 155Клиническое значение - фторхинолоны средства выбора
Нор Ципро*, Офло Лево Мокс
Пефло Спар
----------------------------------------------------------------------------------
Инфекции ЖКТ
Shigella (3 дозы) + + ?
Salmonella (3-7 дней) + + ?
C.jejuni (5 дней) + + ?
* - наибольшее количество данных
Слайд 156Клиническое значение - фторхинолоны средства выбора
Нор Ципро*, Офло Лево Мокс
Пефло Спар
---------------------------------------------------------------------------------
Пневмония
внебольничная - - +
госпитальная - +/- +
Обострение хр. бронхита - +/- +
Тонзиллофарингит - - ?
Отиты, синуситы - - ?
Слайд 157Нежелательные реакции фторхинолонов
Торможение развития хрящевой ткани – противопоказаны беременным, кормящим
матерям, детям.
Тендиниты , разрыв ахилловых сухожилий.
Удлинение интервала QT на
ЭКГ.Фотодерматиты.
Слайд 158Аминогликозиды
I поколение
Стрептомицин - 1944 Применяются по узким
Неомицин
- 1949 показаниям
Канамицин - 1957
II
поколение60-е годы
Гентамицин
Тобрамицин
80-е годы
Амикацин
Нетилмицин
Слайд 159Механизм действия аминогликозидов
Ингибиция биосинтеза белка
Связывание с 30S субъединицей бактериальной рибосомы
Для
транспорта через цитоплазматическую мембрану бактерий необходим аэробный метаболизм
Возможны другие механизмы
действия - Обнаружена способность аминогликозидов связываться с ДНК
Слайд 160Аминогликозиды - спектр активности
Активны, Активны Не активны
Эффективны только in vitro
------------------------------------------------------------------------------------
Энтеробактерии Микоплазмы Стрептококки
P. aeruginosa Haemophilus spp. Энтерококки
Стафилококки Легионеллы Анаэробы
Микобактерии Сальмонеллы Псевдомонады
Шигеллы (кроме P.
aeruginosa)
Слайд 161Аминогликозиды - активность
(МПК, мкг/мл)
Гент Амик
Тобр
Нетил
-----------------------------------------------------------------------------------------
Enterobacteriaceae 0.5 - 6.2 0.5 - 12.5
P. aeruginosa 0.1
- 6.1 3.1 - 12.5
Staphylococcus spp. 0.1-1.6 0.8 - 6.2
----------------------------------------------------------------------------------------
Тобрамицин
Наиболее активен в
отношении P. aeruginosaНетилмицин
Наиболее активен в отношении Staphylococcus
Слайд 162Аминогликозиды - характер бактерицидного действия
I - бактериостатики макролиды
II - выраженность
бактерицидного действия мало зависит от концентрации - бета-лактамы
III- выраженность бактерицидного
действия прямо пропорциональна концентрации - аминогликозидыКОЕ
0 1 2 3 4МПК
I
II
III
Слайд 163Устойчивость к аминогликозидам
I. Ферментативная инактивация молекулы антибиотиков в результате:
Ацетилирования
Фосфорилирования
Аденилирования
Гены ферментов
локализованы на плазмидах
II. Модификация участка связывания
III. Активное выведение
Слайд 164Аминогликозидмодифицирующие энзимы
Субстратная специфичность основных ферментов грам – микроорганизмов
ANT (2”) Кана, Гента,
Тобра
AAC (2’) Ген, Тоб, Сиз, Нтл
AAC (3)-V Гент, Тоб, Нтл
AAC (3)-I Ген, Сиз
AAC
(6”)-I Тоб, Нл, Амк, СизAPH (3’-I Кан, Нео, Мон
APH (3’)-II Кан, Нео, Мон, Ген
APH (3’)-V Кан, Амк, Изп
Слайд 165Устойчивость к аминогликозидам
Частота устойчивости снижается в ряду:
Гентамицин >нетилмицин > амикацин
Уровень
устойчивости грам (-) бактерий к гентамицину на территории РФ один
из самых высоких в миреМеханический перенос рекомендаций по использованию гентамицина не целесообразен
Слайд 166Синергизм аминогликозидов и бета-лактамов в отношении энтерококков
Бета-лактамы – бактериостатики
Аминогликозиды не
активны
При комбинации проявляется бактерицидный эффект – улучшение транспорта внутрь бактериальной
клеткиПри наличии аминогликозидмодифицирующих ферментов – уровень устойчивости к аминогликозидам повышается в еще большей степени – высокий уровень
Синергизм не проявляется
Детекция
Диски:
Стрептомицин – 300 мкг
Гентамицин – 120 мкг
Слайд 167Фармакокинетика аминогликозидов
C max T 1/2 AUC
мкг/мл час
Гентамицин 1мг/кг 4.0 1.8 62.0
Тобрамицин 1 мг/кг 5.0 1.9 54.0
Нетилмицин 1 мг/кг 6.2 1.8 44.8
Амикацин
0.5 г 26.3 1.5 109.3
Слайд 168Аминогликозиды - терапевтическая широта
Терапевтическая широта определяется разницей между эффективными (Э)
и токсическими (Т) концентрациями
Гента, тобра, нетил = 6 - 10
Амика
= 16 - 20Все аминогликозиды = 0.1 - 4.0
Концентрации, мкг/мл
Т
Э
Слайд 169Ото- и вестибулотоксичность аминогликозидов (3% - 15%)
Гентамицин - преобладание вестибулярных
расстройств
Канамицин, амикацин, тобрамицин - слуховые расстройства
Предрасполагающие факторы
Концентрация гента, тобра,
нетил > 6 - 10 мкг/мл, амика > 16 - 20 мкг/млДлительное применение
Наличие ХПН
Слайд 170Нефротоксичность аминогликозидов (12% - 15%)
Ранние проявления
Энзимурия (аланинаминотрасфераза - АЛТ)
Глюкозурия
Фосфолипидурия
Поздние проявления
Повышение
мочевины и креатинина крови
В редких случаях ОПН
Предрасполагающие факторы
Превышение безопасных
концентрацийДлительное применение (более 7 - 10 дней)
Дегидратация, гиповолемия, возраст
ХПН
Слайд 171Аминогликозиды - нейромышечная блокада
Частота усиливается при одновременном применении с анестетиками
и миорелаксантами, большим количеством цитратной крови
Усиливают проявления паркинсонизма, миастении
При интравентрикулярном
введении - вентрикулитСлайд 172Ото- и нефротоксичность амикацина
Частота побочных реакций
Ото- Нефро-
----------------------------------------------------------------
Однократно
(15 мг/кг) 4.5% 2.3%
Двукратно
(по 7.5 мг/кг) 8.8% 3.3%
Слайд 173Особенности аминогликозидов
Ограниченная терапевтическая широта
Мало предсказуемая индивидуальная фармакокинетика
Значимая ото- и нефротоксичность
Необходимость
контроля функции почек и слуха на фоне лечения
Желательность индивидуального мониторинга
уровня в кровиПоказана возможность однократного введения в сутки
Слайд 174Место аминогликозидов в клинике
Как средства монотерапии значение утратили
Кроме зоонозных инфекций
Компоненты
комбинированной терапии при
туберкулезе
эндокардитах
инфекциях, вызванные псевдомонадами
инфекциях при нейтропенических состояниях
Слайд 175Показания для применения аминогликозидов
При амбулаторных инфекциях не показаны
Госпитальные инфекции различной
локализации, вызванные энтеробактериями или псевдомонадами в комбинации с бета-лактамами, антианаэробными
препаратами или фторхинолонамиДыхательных путей
Мочевыводящих путей
Интраабдоминальные
Слайд 176Аминогликозиды
Стратегия выбора препарата
Гентамицин
Базовый препарат в отделениях общего профиля
Амикацин
Отделения интенсивной терапии
Высокий
уровень резистентности к гентамицину
Нетилмицин
Высокий уровень резистентности к гентамицину
ХПН или слуховые
расстройстваТобрамицин
Высокий уровень резистентности P. aeruginosa
Слайд 178Спектр активности
Бактериостатическая активность
Staphylococcus spp. – в т.ч. MRSA
Streptococcus spp.
Enterococcus spp.
Clostridium
spp.
Слайд 179Механизм действия гликопептидных антибиотиков
Ингибиция синтеза пептидогликана в результате пространственного блока
боковой пептидной цепи и предотвращения образования поперечных сшивок
Ванкомицин
D-Ala-D-Ala
Полисахаридная
цепь
Боковая
пептидная цепь
Слайд 180Механизмы устойчивости к гликопептидам - энтерококки
S R
Формирование нового метаболического пути синтеза
модифицированного предшественника пептидогликана
Вероятные причины
Северная Америка
Избыточное потребление в ОИТ ванкомицина
Европа
Применение авопарцина
в сельском хозяйствеРоссия
D-ala
D-ala
D-ala
D-lac
Слайд 181Устойчивость энтерококков к гликопептидам
Природно низкая чувствительность
E. casseliflavus, E. flavescens, E.
gallinarum
Фенотип VanC (МПК ванкомицина = 8 - 16 мкг/мл)
Приобретенная устойчивость
E.
faecium, существенно реже E. faecalisАссоциированная устойчивость к
Пенициллинам
Аминогликозидам (высокий уровень)
Ципрофлоксацину
Слайд 184Распространение VRE
Северная Америка
NNIS – 2003 - 27.5%
Россия [Клясова и соавт.]
2003
Первый штамм - пациент из онкогематологии - E. gallinarum
Обнаружены гены
vanB, vanCЦеленаправленный скрининг
Более 150 штаммов E. faecium, E. faecalis – vanA, vanB
К настоящему времени E. faecium vanA
Москва, Онкологический научный центр
Москва, ГКБ N 7
Москва, Республиканская детская клиническая больница
Слайд 188Устойчивость стафилококков к гликопептидам
Ванкомицин внедрен в 1958 г
В течение первых
20 лет сообщений об устойчивости не было
1979 – 1983 сообщения
об устойчивости у коагулазоотрицательных стафилококков Преимущественно S. haemolyticus
Недостаточное внимание в силу малой вирулентности
Механизм до сих пор не изучен
Рекомендации по лечению не разработаны
Слайд 189Терминология
VRSA – Vancomycin Resistant Staphylococcus aureus
VISA – Vancomycin Intermediate
Staphylococcus aureus
hVISA – hetero- Vancomycin Intermediate Staphylococcus aureus
Слайд 190Промежуточный уровень устойчивости S. aureus к ванкомицину – Vancomycin Intermediate
Staphylococcus Aureus - VISA
Формируются на фоне длительного лечения ванкомицином
МПК ≥
8 мкг/мл [K. Hiramatsu, JAC, 1997]Сниженная скорость роста
Избыточное образование предшественников пептидогликана
Утолщение клеточной стенки
Нестабильность свойств
Клинические неудачи
Ассоциированная устойчивость к тейкопланину
Референтный штамм Mu50
Слайд 191hetero-Vancomycin-
Intermediate S. aureus (hVISA).
Штаммы S. aureus с МПК ванкомицина ниже
пограничной концентрации (4.0 мкг/мл)
Содержат субпопуляцию бактерий, сохраняющую жизнеспособность при МПК
> 4.0 мкг/млРеферентный штамм Mu3
Выделен незадолго до Mu50, от которого генетически неотличим
При длительных пассажах на средах с ванкомицином приобретает свойства Mu50
Предполагается, что представляют собой промежуточную стадию формирования VISA
Слайд 192Механизм устойчивости стафилококков к гликопептидам
Sieradzki, K., Pinho M. G.,
Tomasz
A. 1999.
Слайд 193Механизм устойчивости стафилококков к гликопептидам
Sakoulas J., et al, 2005
Утрата функции
системы вспомогательного гена регулятора (accessory gene regulator - agr).
Полиморфизм в
системе agrСнижение аутолиза in vitro
Слайд 194Методы детекции
Популяционный анализ
Трудоемкий, требует спирального инокулятора
Упрощенный популяционный анализ
Посев на сердечно-мозговой
агар с 4 мкг/мл ванкомицина
Е-тест с посевной дозой 2 по
McFarlandВсе методы недостаточно стандартизованы
Слайд 195Критерии чувствительности к ванкомицину (изменены в 2006)
чувствительные
< 2 мкг/мл
промежуточные 4-8 мкг/мл
устойчивые
> 16 мкг/млСлайд 196Распространение hVISA
[Liu C., Chambers H.F, AAC, 2003]
Распространение среди 6052
штаммов ORSA 2.16% (0-73.6%)
Япония, Корея, Гонконг, Таиланд, Франция, Испания, Греция,
Германия, Италия, ВеликобританияНе выявляются диско-диффузионным методом
Необходим целенаправленный скрининг
Классический и упрощенный варианты популяционного анализа – метод не стандартизован
Слайд 197Клиническое значение снижения чувствительности к ванкомицину
Moise-Broder PA, et al. CID
2004
Слайд 198Высокий уровень устойчивости S. aureus к ванкомицину – VRSA
In vitro
показана возможность передачи детерминанты устойчивости от энтерококков стафилококкам
Выделение клинических штаммов
с высоким уровнем устойчивости МПК ≥ 32 мкг/мл – передача детерминант устойчивости от стаф энтерококков стафилококкам в клиникеМичиган – 2002
Пенсильвания – 2002
Нью-Йорк – 2004
Мичиган – 2005
Мичиган – 2005
Лечение
Не отработано
In vitro - линезолид
Слайд 199Формирование штаммов VRSA в клинике
Хронические инфекции, вызванные ORSA
Колонизация кишечника и
других локусов VRE
Передача от VRE плазмиды с генами устойчивости к
ванкомицинуПроцессы рекомбинации между стафилококковыми и энтерококковыми плазмидами
Формирование штамма VRSA
Слайд 200Показания к применению
Подтвержденные генерализованные инфекции, вызванные метициллинрезистентными Staphylococcus aureus
- MRSA, Staphylocccus spp.
Подтвержденные генерализованные инфекции, вызванные Enterococcus spp. устойчивыми
к пенициллину, аминогликозидам (высокий уровень) и ципрофлоксацину Предполагаемые инфекции, вызванные перечисленными выше микроорганизмами
Дозы
Взрослые 1.0 каждые 12 ч, или 0.5 каждые 6 ч
Дети 0-1 мес. - 15мг/кг + 10 мг/кг каждые 8 ч
>1 мес. - 40 мг/кг/сут через 6 ч.
Слайд 201Побочные эффекты
Red-neck/red-man syndrome (синдром красной шеи )
Гипотония
Анафилаксия
Псевдомембранозный колит
Кожные реакции (от
незначительной сыпи до синдрома Стивена-Джонса)
Лекарственная лихорадка
Флебиты
Нефротоксичность
Ототоксичность
Слайд 202Предосторожности
Внутривенная инфузия более 1 ч
Безопасные сывороточные концентрации
пик: 20 -
50 мкг/мл
конечные: 5 - 10 мкг/кг
Корректировка при почечной недостаточности
Желателен мониторинг
уровня в сывороткеДлительность терапии стафилококковой бактериемии 2 - 3 недели
Слайд 203Новые антибактериальные препараты последних лет
Оксазолидиноны – новый класс
Грам+
Гликопептиды – гликолиподепсипептиды
Грам+
Липопептиды
Грам+
Макролиды/кетолиды
Грам+
Фторхинолоны
Грам+
респираторные патогены/грам-
Глицилциклины (тетрациклины)
Грам+/грам-
Бета-лактамы
Грам+/грам-
Линезолид
Оксазолидиноны описаны в конце 1970 гг
Обнаружены в результате
традиционного скринингаИнгибируют включение fMet-tRNA в комплекс инициации трансляции
Активны только в отношении Грам (+), наиболее значимо MRSA и VRE
Устойчивость Грам (-) связана с активным выведением
Описано формирование устойчивости у S. aureus, Enterococcus spp.
Оритаванцин
Далбаванцин
Телаванцин
Ориеномицин
Рамнопланин
Внедрение не определено
Полусинтетический липогликопептид, бактерицидное действие
МПК в отношении vanA: 1 – 4 мкг/мл
Однократно в сутки 200 мг
Завершена III фаза
Полусинтетическое производное тейкопланина
МПК в отношении vanA: 0.5 – 128 мкг/мл
Один раз в неделю
Полусинтетическое производное ванкомицина
МПК в отношении vanA: 0.12 – 8 мкг/мл, активен в отношении VRSA
Высоко эффективен при экспериментальном эндокардите и в отношении биопленок
Хорошая переносимость
Astellas
Отечественный антибиотик
Улучшенная фармакокинетика и переносимость
Планируются клинические испытания
Циклический липогликопептид
Активен в отношении VRE
Токсичен при системном применении
Прием внутрь для санации носителей VRE
Даптомицин
Липофильный фрагмент взаимодействует к цитоплазматической мембраной
Выраженная бактерицидная активность в отношении всех проблемных Грам (+) патогенов
Инактивация в присутствии легочного сурфактнанта
Производные макролидов
Телитромицин, цетромицин
По механизму действия и спектру сходны с макролидами
Активны в отношении штаммов с основными механизмами устойчивости
Клинафлоксацин, ситафлоксацин, гареноксацин, ряд экспериментальных соединений
Повышение активности в отношении Грам (+) и анаэробов, незначительное повышение активности в отношении Грам (-)
Принципиального прогресса нет
Тайгециклин
Производное миноциклина, широкий спектр активности, преимущественно бактериостатическое или умеренно бактерицидное действие, время-зависимый киллинг
Преодолевает большинство механизмов резистентности
Является естественным субстратом эффлюксных помп у P. aeruginosa, Proteus, Providencia, Morganella – сниженная активность, формирование устойчивости
Цефтобипрол
Цефалоспорин с повышенной аффинностью к ПСБ 2а – активен в отношении MRSA, но не энтерококков
Активность в отношении Грам (-) и P. aeruginosa сопоставима с цефепимом или несколько ниже
Чувствительность к бета-лактамазам аналогична цефалоспоринам III - IV
Пенемы Карбапенемы
Фаропенем Этрапенем
Дорипенем
Слайд 205Оксазолидиноны - общая характеристика
Линезолид – первый за 20 лет препарат
с принципиально новым механизмом действия
Ингибирует биосинтез белка на наиболее ранних
стадияхОтсутствует перекрестная резистентность с актибиотиками других групп
Слайд 206Спектр активности линезолида
Основное значение
Staphylococcus spp.
Включая оксациллин- и ванкомицинрезистентные штаммы
Enterococcus spp.
Включая
ванкомицинрезистентные штаммы
Другие бактерии
Streptococcus pneumoniae
Bacillus spp
Corynebacterium spp
Listeria monocytogenes
Mycobacterium
tuberculosisHaemophilus influenzae
Moraxella catarrhalis
Legionella spp.
Bordetella pertussis
Neisseria gonorrhoeae
Анаэробы
Слайд 207Характеристика антибактериального действия
In vitro – бактериостатик
In vivo – бактерицидное действие
Подавление
продукции бактериями факторов вирулентности
Слайд 208Фармакокинетика и дозирование
Максимальные концентрации в сыворотке
12 – 13 мкг/мл
Период полувыведения
4.5
– 5.5 ч
Биодоступность
100%
Эффективно проникает в ткани
Рекомендуемые дозы
600 мг (в/в или
внутрь)Интревал 12 ч
Слайд 209Показания к клиническому применению
Осложненные и неосложненные инфекции кожи и мягких
тканей, вызванные S. aureus (метициллинчувствительными и устойчивыми штаммами), Streptococcus pyogenes,
Streptococcus agalactiae.Нозокомиальные пневмонии, вызванные метициллинчувствительными и метициллинрезистентными штаммами Staphylococcus aureus. При доказанной или вероятной смешанной инфекции (грамположительные и грамотрицательные микроорганизмы) необходима комбинированная терапия.
Инфекции, вызванные ванкомицинустойчивыми энтерококками, включая случаи сопровождающиеся бактериемией.
Слайд 210Ванкомицин или ленезолид?
Ванкомицин
При инфекциях вызванных чувствительными штаммами уступает по эффективности
бета-лактамам
Линезолид
Равноэффективен при инфекциях, вызванных как чувствительными, так и устойчивыми штаммами
Обладает
лучшей фармакокинетикой и переносимостью Доступен для приема внутрь
Слайд 212Даптомицин
Нарушает функции цитоплазматической мембраны
Бактерицидная активность
Резистентность встречается редко мало изучена
Не
применяется при пневмонии из низких легочных концентраций (связывается сурфактантом
Возможна миопатия
Слайд 214Устойчивость MRSA VR E. faecium к даптомицину и другим антибиотикам
Samra,
Shmuely. Eur J Clin Microbiol Infect Dis 2007;26:363–365
Слайд 216Даптомицин клиника
Клинические неудачи при дозе 2 мг/кг/день вероятно связана с
высоким связываением с белками
Garrison et al. Southern Med J 1989;82:1414–1415
Vance-Bryan
et al. Antimicrob Agents Chemother 1992;36:2334–2337Не уступает по эффективности ванкомицину
4 мг/кг/день: инфекции кожи и мягких тканей
6 мг/кг/день: бактериемия
Hair. Drugs 2007;67:1483–1512
Эндокардиты: утверждены показания для правостороннего, но данные ограничены
Falagas et al. J Antimicrob Chemother, 2007;60:7–19
Слайд 217Тигициклин S. aureus активность
Wootton et al. Antimicrob Agents Chemother 2006;50:4195–4197
Слайд 218Тигициклин
Низкие МПК в отношении грам (+)
Резистентность редка
Разрешен для инфекций кожи
и интраабдоминальных
Данные по тяжелым инфекциям отсутствуют
Возможная роль
Нетяжелые, полимикробные, при подозрении
на вовлечение MRSAДля грам (-) сывороточные концентрации сопоставимы с МПК
Слайд 219Цефтобипрол
Цефалоспорин с анти-MRSA активностью
Связывается с PBP2′
Предварительные клинические данные
По эффективности равен
ванкомицину
(Note: Clin Microbiol Infect 2007;13 Suppl 2:25–29)
Широкий спектр
Грам отрицательные
бактерии Кроме P. aeruginosa, Proteus,
Слайд 221Факторы, определяющие природную чувствительность/устойчивость бактерий
Аффинность мишеней к препаратам
pbp5 энтерококков отличается
низкой аффинностью к бета-лактамам
Проницаемость внешних структур бактерий
Активное выведение
МПК ампициллина
S.
pneumoniae – 0.015 – 0.06 мкг/млE. faecalis – 2 – 4 мкг/мл
Грам (+) бактерии эволюционно более древние
Одним из факторов формирования Грам (-) бактерий
вероятно был прессинг антибиотиков
Грам (-) бактерии обладают дополнительной внешней
мембраной, затрудняющей проникновение гидрофильных
веществ внутрь клетки, транспорт осуществляется через
пориновые каналы
Наиболее выраженные различия в чувствительности касаются
высокомолекулярных антибиотиков
Гликопептиды
Рифамицины
Макролиды
Существует 5 семейств транспортных систем (эффлюксных
помп)
Гены соответствующих белков могут локализоваться как
на хромосомах так и на плазмидах, либо в составе подвижных
генетических элементов
Природная устойчивость опосредуется генами,
локализованными на хромосомах, встречается в основном
у Грам (-) бактерий
Устойчивость H. influenzae к макролидам
Устойчивость Грам (-) бактерий к линезолиду
Низкая чувствительность P. mirabilis и P. aeruginosa
к тайгециклину
Первичная функция эффлюксных помп вероятно
не связана с устойчивостью к антибиотикам
Наиболее вероятно – участие в защите от
неблагоприятных факторов внешней среды
Устойчивость энтеробактерий к желчи
Слайд 222Приобретенная резистентность
Модификация собственного генома
Мутации в генах топоизомераз – устойчивость
к хинолонам
Мутации в генах РНК-полимеразы – устойчивость к рифампину
Приобретение нового
«экзогенного» генетического материалаГены бета-лактамаз – устойчивость к бета-лактамам
mecA – устойчивость к бета-лактамам
mef гены – устойчивость к макролидам
van гены – устойчивость к гликопептидам
Генетические механизмы формирования приобретенной резистентности
Слайд 223Биохимические механизмы резистентности
Ферментативная инактивация препарата
Модификация мишени действия
Защита мишени
Активное выведение
Ограничение транспорта
к чувствительной мишени
Энзим
A
P
Разрушение
Модификация
А
Мишень
Модифицированная мишень
А
Устойчивость к тетрациклинам Ribosomal Protection Protein,
гены
tet(O), tet(M), tet(P), tet(Q), и др. плазмидной локализацииБелки сходные с фактором элонгации вытесняют
тетрациклины из участка связывания с рибосомами
Низкий уровень устойчивости к хинолонам, белки Qnr
связывающиеся с субъединицами ДНК-гиразы и тормозящие
образование комплекса ДНК-ДНК-гираза,
Гены входят в состав интегронов плазмидной
локализации
Гомология с белками, защищающими бактерии
от собственных микроцинов
Гиперэкспрессия имеющихся эффлюксных помп
P. aeruginosa
MexAB-OprM
MexCD-OprJ
MexEF-OprN
MexXY-OprM
Приобретение генов с подвижными
генетическими элементами
mef (A)
mef (E)
mef (I)
многие другие
Снижение экспрессии или утрата пориновых каналов,
множественная устойчивость
Enterobacteriaceae
P. aeruginosa
Утрата белка OprD – избирательная
устойчивость к имипенему
Слайд 224Критерии чувствительности Enterobacteriaceae к бета-лактамам
CLSI EUCAST
≤S/R> ≤S/R>
Меропенем 4/16 2/8
Дорипенем
Цефоперазон/сульбактам нет нет
Цефепим 8/32 1/8
Цефтазидим 8/32 1/8
Цефотаксим 8/64 1/2
Цефоперазон 16/64 нет
Слайд 228Распределение МПК в фторхинолонов в отношении «дикой» популяции S. pneumoniae
- EUCAST
Ципрофлоксацин
Левофлоксацин
Офлоксацин
Моксифлоксацин
Слайд 229Метилирование
Ферменты – метилазы, гены ermA – ermY входят в
состав транспозонов, локализуются на хромосомах или плазмидах
Ди- или монометилирование аденина
23S рРНК в положении 2058Характер экспрессии
Конститутивный
Проявляется независимо от контакта с антибиотиками
Высокий уровень устойчивости к макролидам, линкозамидам и стрептограминам В (MLSB – фенотип)
Индуцибельный
Проявляется после контакта с антибиотиками
Вариабельный уровень устойчивости к отдельным макролидам
При длительном воздействии может трансформироваться в конститутивный фенотип
Слайд 230Активное выведение (эффлюкс)
Близкородственные гены mefA, и mefE, по современной номенклатуре
объединены в одну группу mefA.
Штаммы, обладающие геном mefA проявляют
более высокий уровень устойчивостиКодируют белки вторичных транспортеров семейства «основных помощников»
Выводят 14-ти и 15-членные макролиды
16-членные макролиды и линкозамиды не выводятся
Слайд 231Наиболее распространенные фенотипы S. pneumoniae
14-15-ч 16-ч Кли
Коститутивное
метилирование R R R
Индуцибельное
метилирование R-I R-s R-s
Эффлюкс R-I S S
Фенотипическая
дифференцировка эффлюкса и индуцибельного метилирования в ряде случаев невозможна
Слайд 232Клиническая проблема
При устойчивости связанной с эффлюксом можно назначать 16-членные макролиды
или линкозамиды
При устойчивости, связанной с индуцибельным метилированием назначение 16-членных макролидов
и линкозамидов сопряжено с риском неудачи леченияДля дифференцировки двух механизмов необходимо ставить тест на индукцию (антагонизм эритромицина и клиндамицина)
Слайд 234Фенотипы и генотипы устойчивости к макролидам Staphylococcus spp
Вид Ген Фенотип
Маркер 14-15 16-Сli
Метилирование erm MLSB, инд. R S
erm MLSB, конст R R
Эффлюкс msrA MSB R S
Слайд 235Редкие механизмы устойчивости
Мутации в генах 23S рРНК
Мутации в рибосомальных белках
L4, L22
Проявляются различными фенотипами
Слайд 236
Клональность штаммов S. pneumoniae с двумя генами устойчивости к макролидам
ST
– тип по мулитилокусному секвенированию
СС – клональный комплекс
Клональный комплекс
распространенный в Южной Африке, Южной Корее и ЯпонииКлональный комплекс, распространенный повсеместно
Слайд 237ЧАСТОТА ВЫЯВЛЕНИЯ РЕЗИСТЕНТНЫХ
ШТАММОВ S.PYOGENES В РОССИИ К РАЗНЫМ МАКРОЛИДАМ
С.В. Сидоренко и соавт., Клиническая фармакология и терапия, 2008; 17
(2)Эритромицин*
Джозамицин
* Маркер резистентности к другим 14-членным макролидам (кларитромицин, рокситромицин)
и азитромицину
Москва
Ярославль
Томск
Иркутск
Слайд 239Клиническое применение макролидов
Дополнительные показания (резервные средства)
Тонзиллофарингит, острый средний отит
Угревая сыпь
Гонорея
(Азитро), сифилис (Эритро)
Лайм-боррелиоз
Профилактика менингококкового менингита (Спир)
Оппортунистические инфекции у больных СПИДом
(Азитро, Спир, Клар)Слайд 240МАКРОЛИДЫ ПРИ НЕТЯЖЕЛЫХ РЕСПИРАТОРНЫХ ИНФЕКЦИЯХ
Как правило, альтернатива пенициллинам:
- непереносимость
-
“атипичная” этиология
По клинической и микробиологической эффективности при нетяжелой ВП сопоставимы
с пенициллинами и респираторными хинолонамиПри обострении ХОБЛ по бактериологической эффективности уступают амоксициллину/ клавуланату и респираторным хинолонам
1 Чучалин А.Г. и соавт. Практические рекомендации по лечению, диагностике и профилактике ВП у взрослых, 2006 г.
Синопальников А.И., и соавт. Российский медицинский вестник 2006; № 12: 4-18
N.Maimon, e.a. Eur Respir J 2008; 31: 1068-76.
Beghi, e.a. J Chemother 1995; 7: 146-52
Дворецкий Л.И., и др. Справочник поликлинического врача 2007; 5: №2
Слайд 241Область, определяющая устойчивость к хинолонам ~ 40 аминокислот в каждой
субъединице
Аминокислотные замены Кратность повышения
gyrA parC МПК ципро.
--------------------------------------------------------------------------
E.coli 81 - 8
83 - 32
83 + 87 80
>4 000---------------------------------------------------------------------------------
S.pn. - 137 2
- 84 8
87 79 64
Слайд 242Ступенчатое формирования устойчивости к фторхинолонам
Устойчивость
parC gyrA
parC gyrA
parC gyrA
1-я ступень
селекции
2-я
ступень
селекции
CiproR
LevoR
Слайд 243Формирование устойчивости к фторхинолонам с «двойным действием»
Устойчивость
parC gyrA
parC gyrA
parC
gyrA
C
parC gyrA
-
-
+
Гибель, селекции не происходит
Гибель, селекции не происходит
Селекция устойчивого мутанта
Вероятность
формирования двойных мутантов крайне низкаяMPC
Слайд 246Концентрации антибиотиков предотвращающие селекцию мутаций (MPC - mutation prevention concentration)
[Drlica K]
МПК
МРС
Окно селекции
мутаций
Концентрация
препаратов
Lg кое
Слайд 248
r 2 0,9
1
10
100 10004
3
2
1
0
MIC72/ MIC0
AUC24/MIC
Чувствительность S. aureus к хинолонам
в зависимости от AUC24/MIC
66
220
420
Фирсов А.А., AAC, 2003
Слайд 249Вероятность селекции устойчивости S. pneumoniae в процессе терапии моксифлоксацином
Доза 400
мг
AUC24/MIC 270
Zinner S. et al., JAC, 2003
Слайд 250Парадокс фторхинолонов в Испании
Garcia-Rey C. et al. CMI, 2006
Общее потребление
фторхинолонов
Динамика устойчивости
S . pneumoniae к ципрофлоксацину
Обратная корреляция потребления
и
устойчивости в провинцияхВозможные причины
Преимущественное увеличение потребления респираторных фторхинолонов
Применение не фторхинолоновых препаратов
Преимущественное распространение отдельных клонов в различные временные периоды





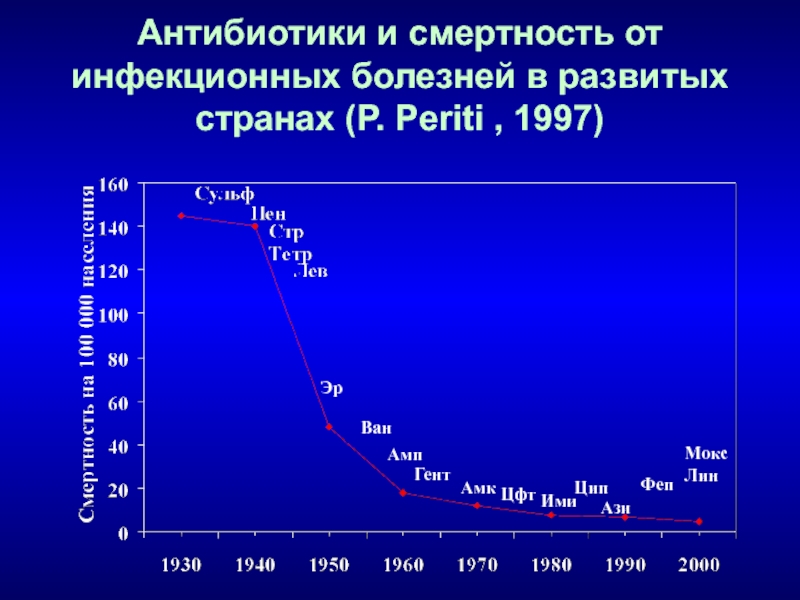






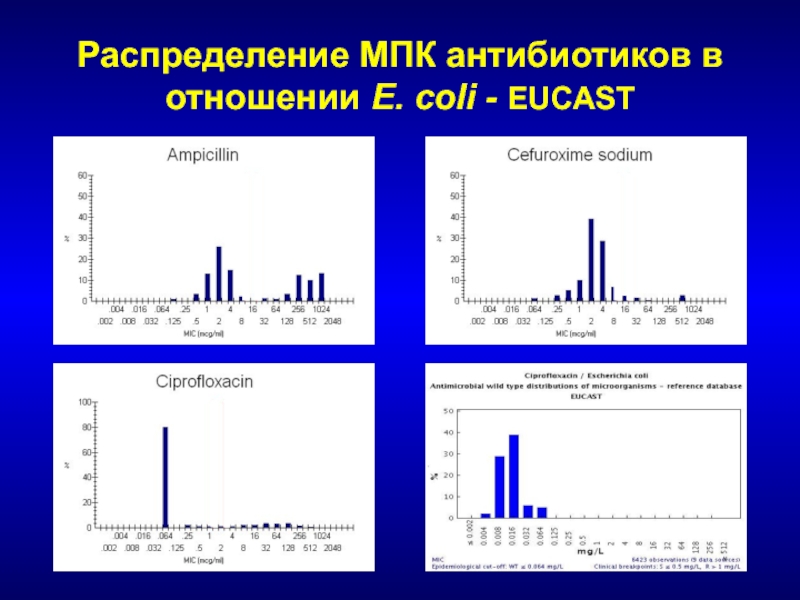

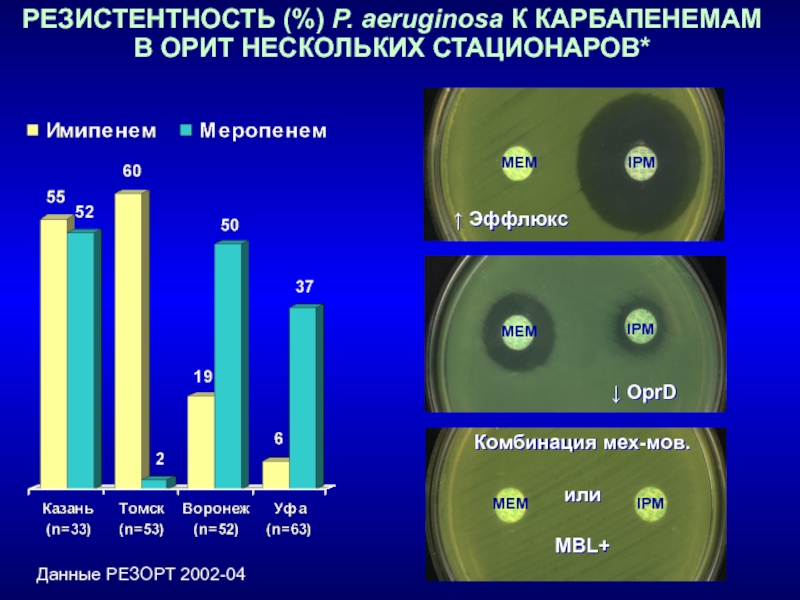


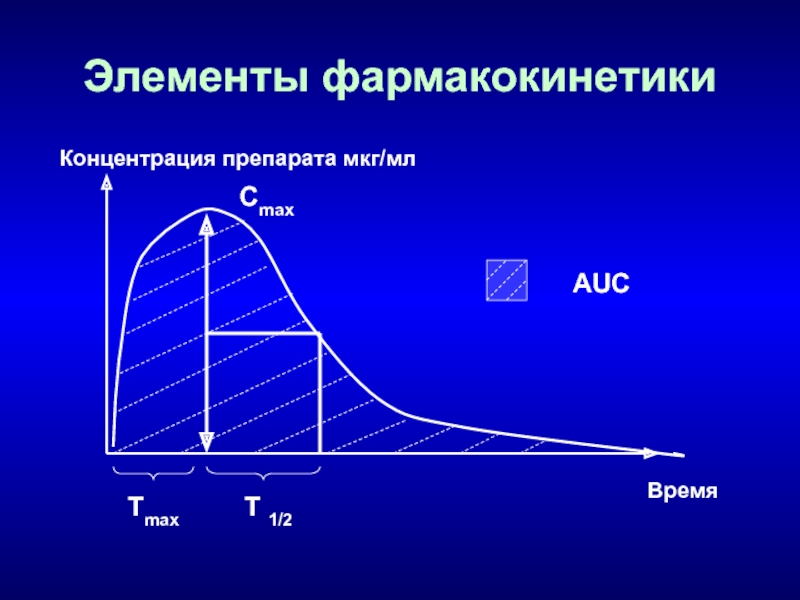
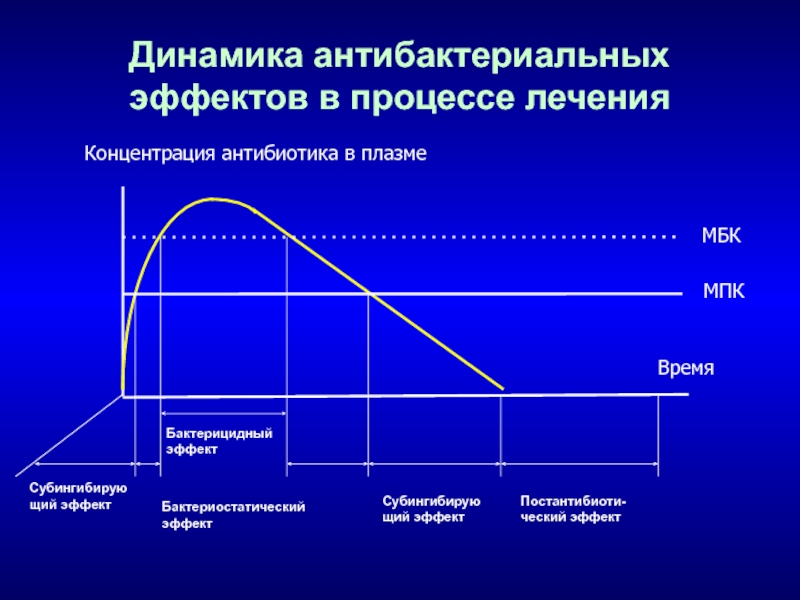



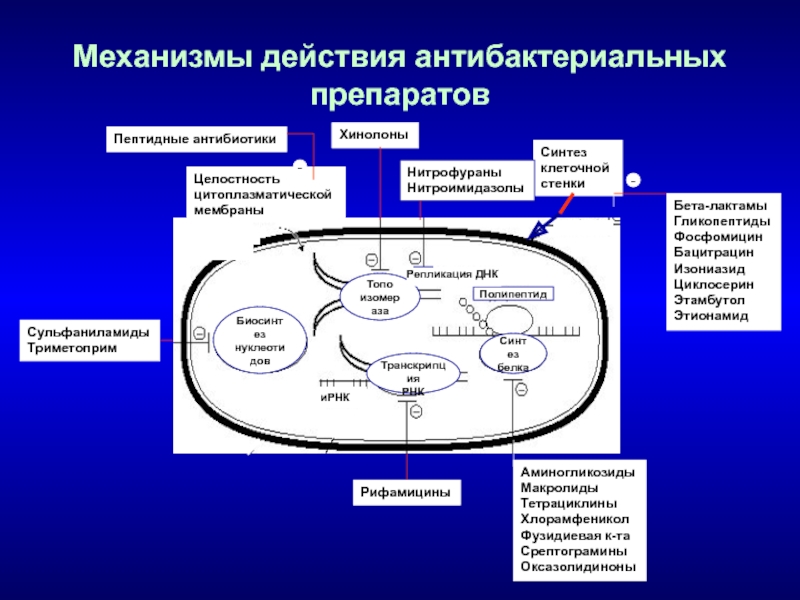

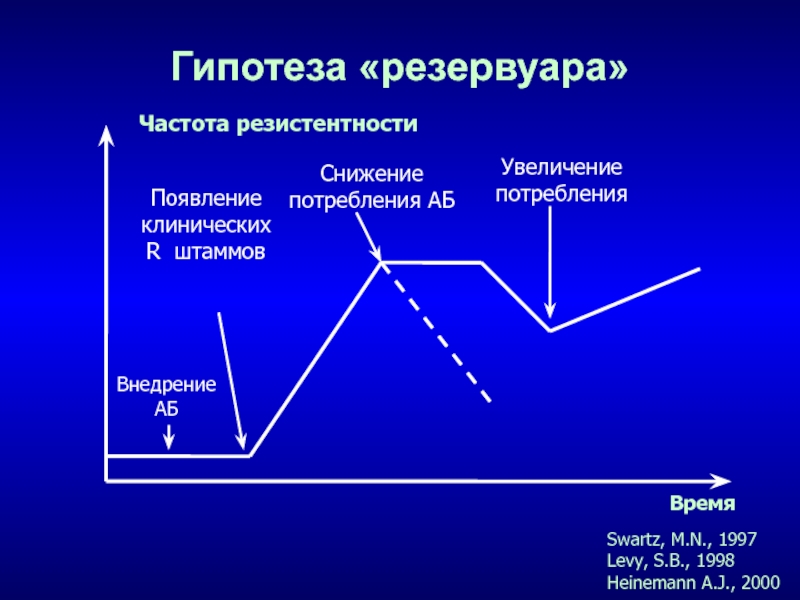




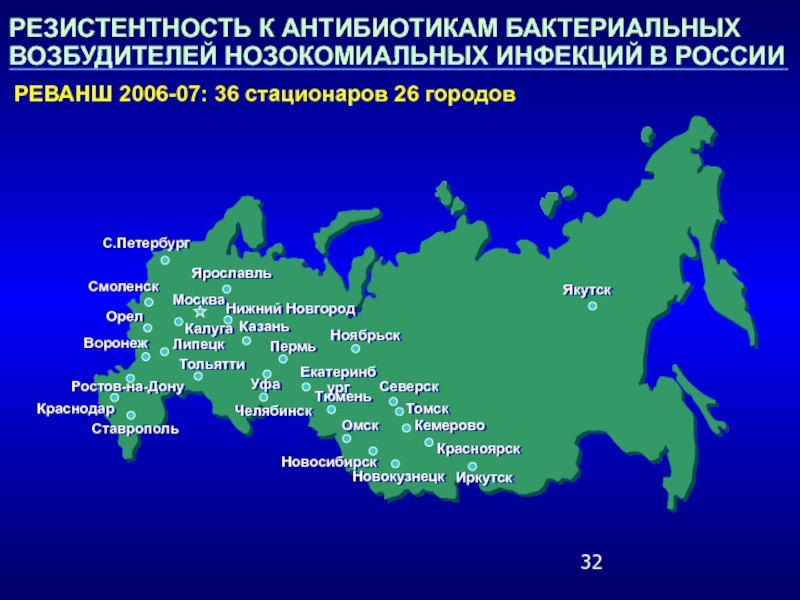



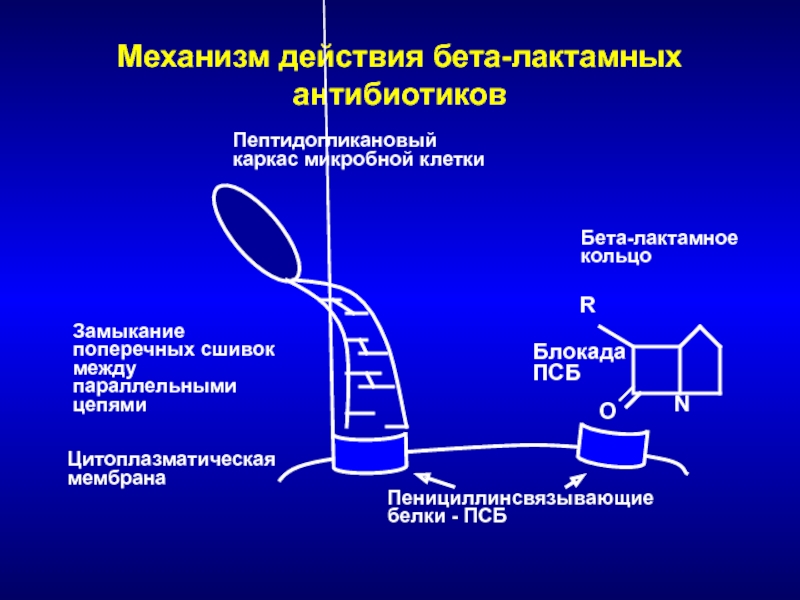
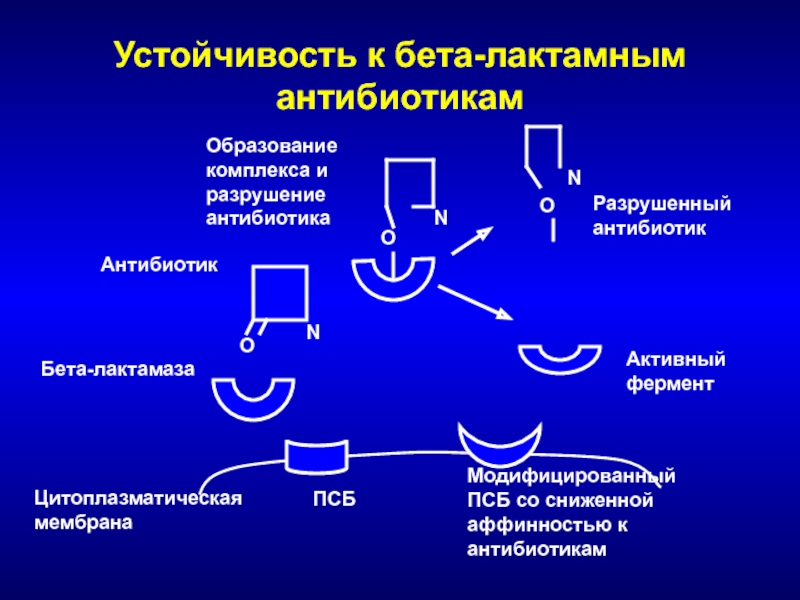
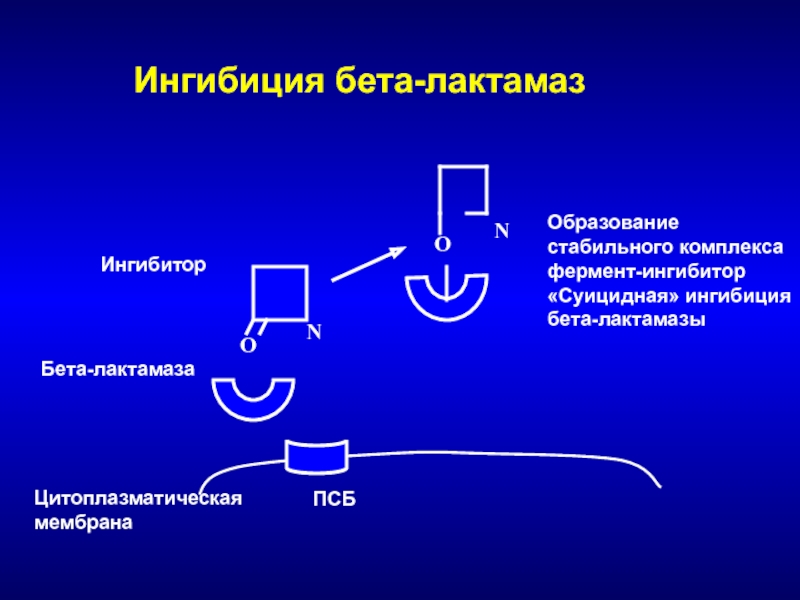








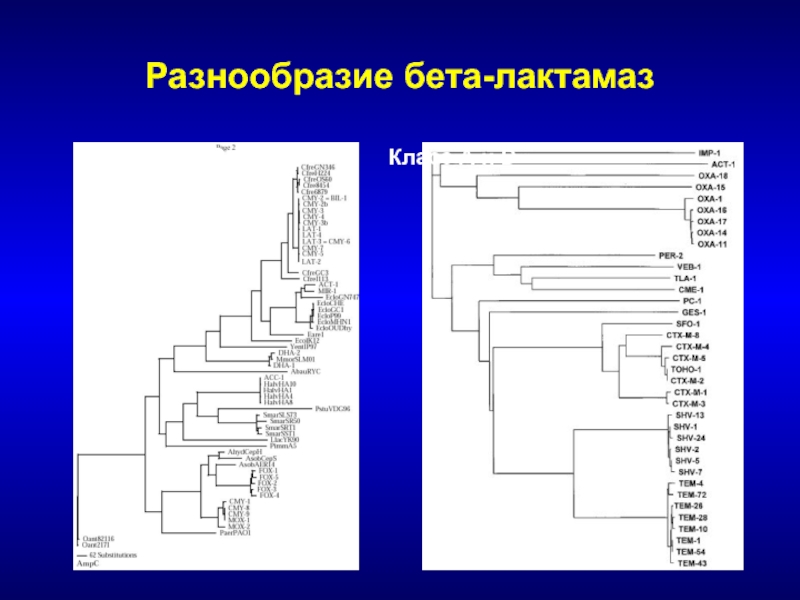

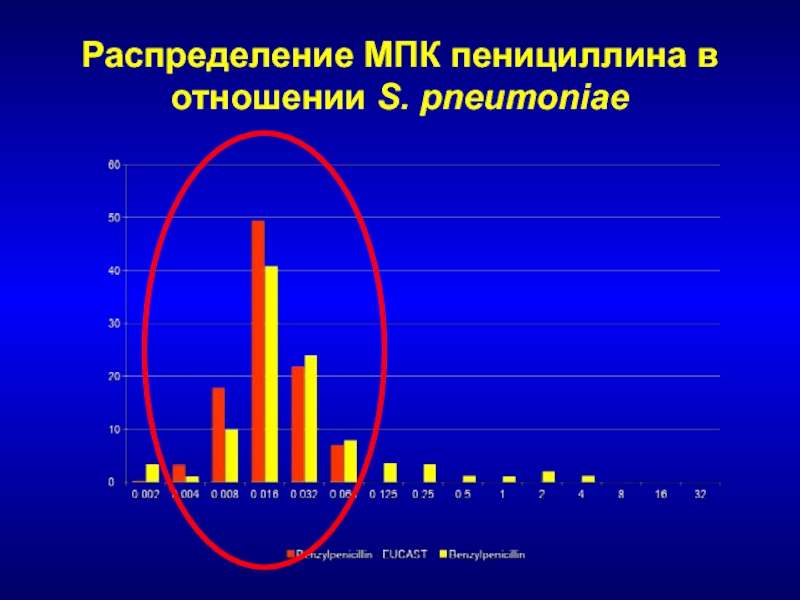





![Антибиотики Staphylococcal cassette chromosome mec (SSCmec) [Hiramatsu 2001] Staphylococcal cassette chromosome mec (SSCmec) [Hiramatsu 2001]](/img/thumbs/38a6890ba726be3074528ff04617f37e-800x.jpg)
![Антибиотики Staphylococcal cassette chromosome mec (SSCmec) [Chongtrakool P., 2006]mecA – комплексccr – комплекс (рекомбиназа) Staphylococcal cassette chromosome mec (SSCmec) [Chongtrakool P., 2006]mecA – комплексccr – комплекс (рекомбиназа)](/img/thumbs/1e16274e6691e766d006a08b02810160-800x.jpg)
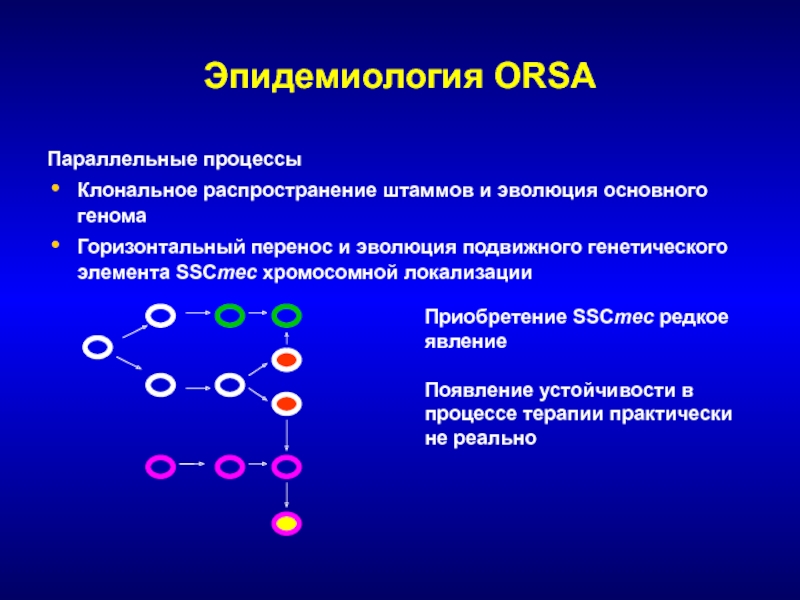

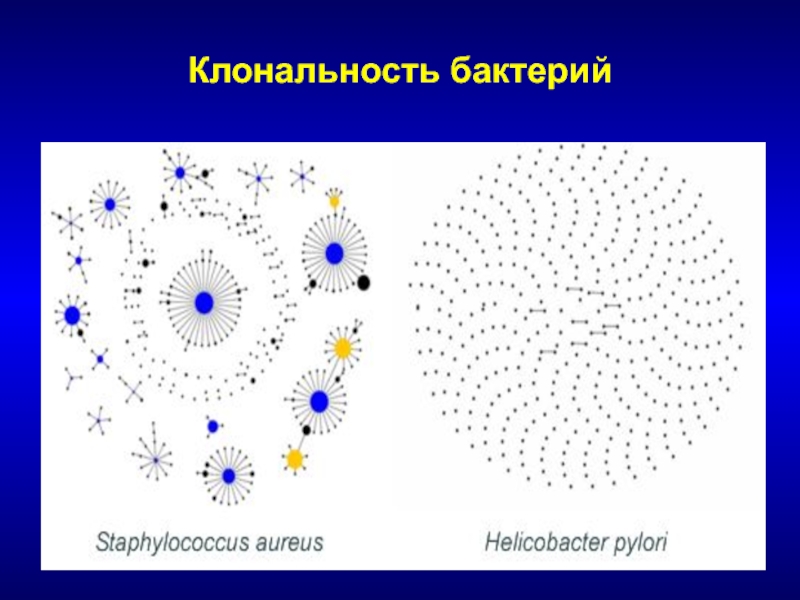
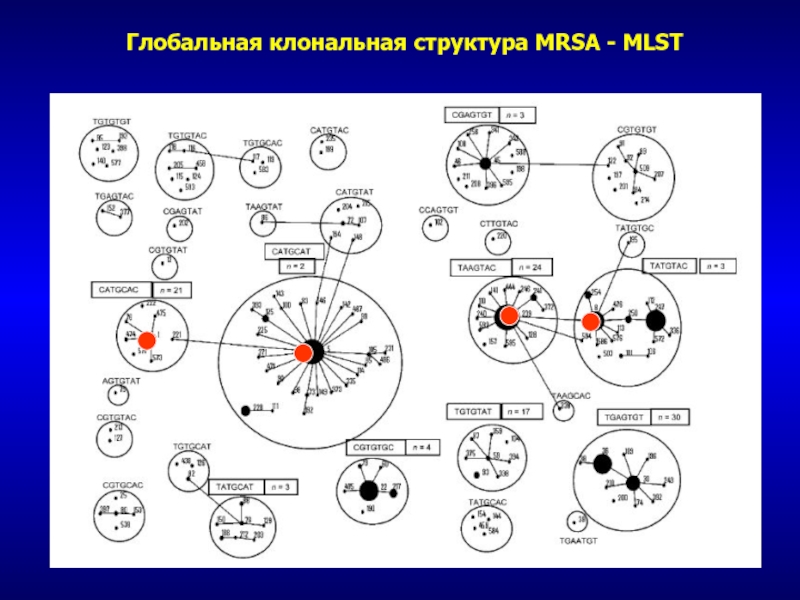
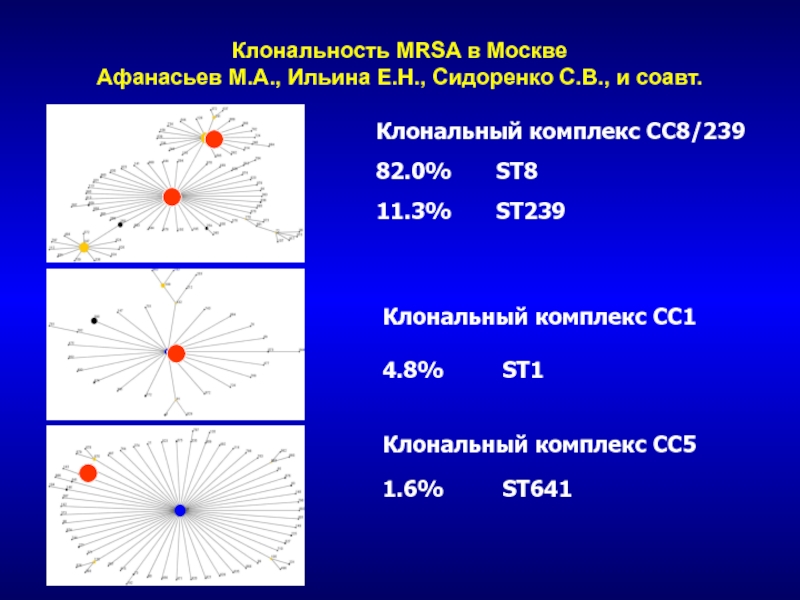




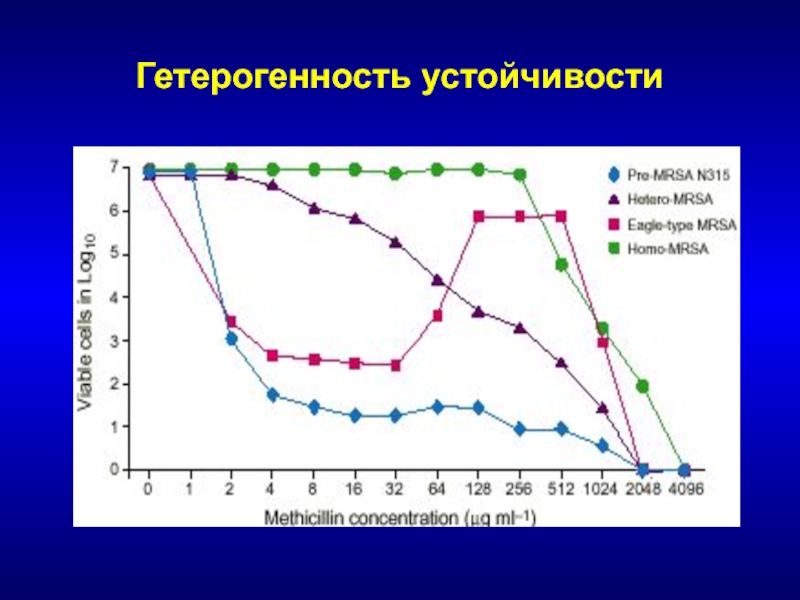




![Антибиотики Распространение ORSA в России при нозокомиальных инфекциях 1995 – 1996 2000 – Распространение ORSA в России при нозокомиальных инфекциях 1995 – 1996 2000 – 2001 2003 [С.В. Сидоренко] [А.В. Дехнич] [С.В.Сидоренко]Диапазон 0 – 40% 0](/img/thumbs/82ba84d74824502ccf540a4f62df59bc-800x.jpg)
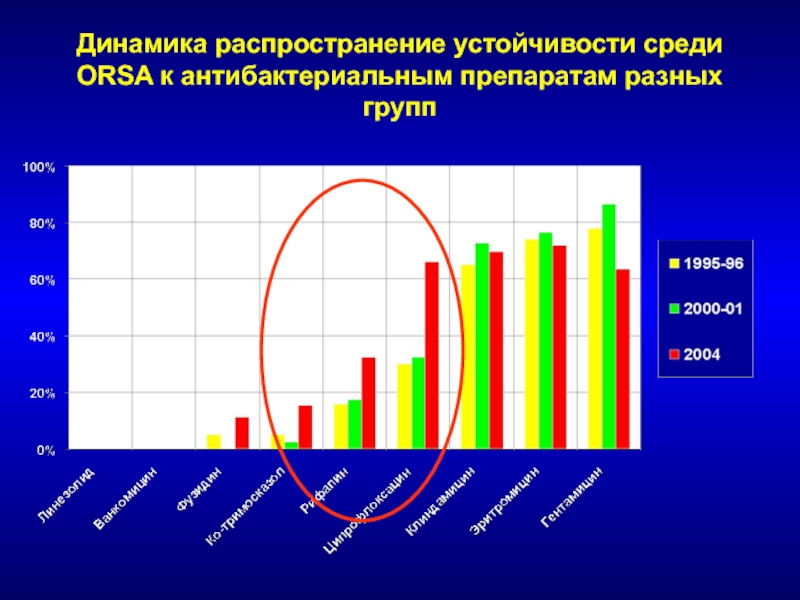







![Антибиотики Распространение CTX-M бета-лактамаз в России [Edelstein M., et al, AAC, 2003]E. Распространение CTX-M бета-лактамаз в России [Edelstein M., et al, AAC, 2003]E. coli – 494 штаммовESBL фенотип –](/img/thumbs/963e05a34daa1be7dcabeeb97b37dfe8-800x.jpg)















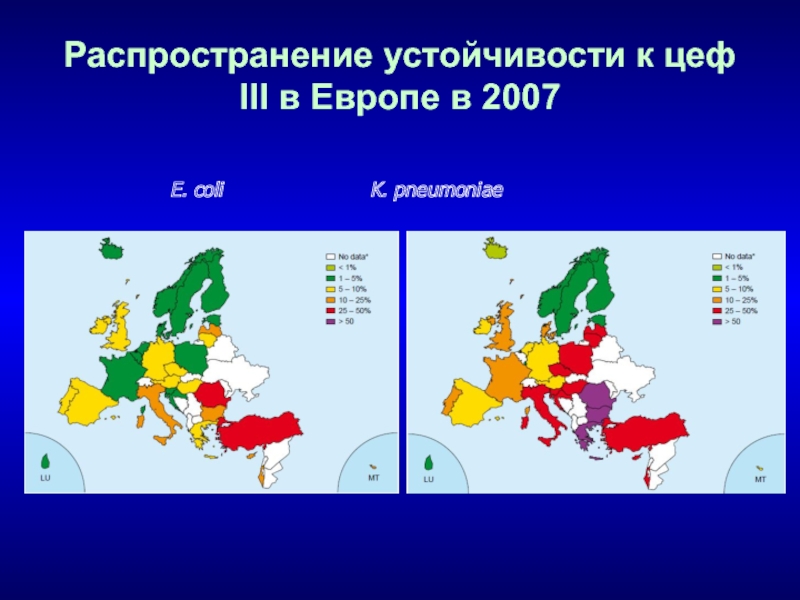
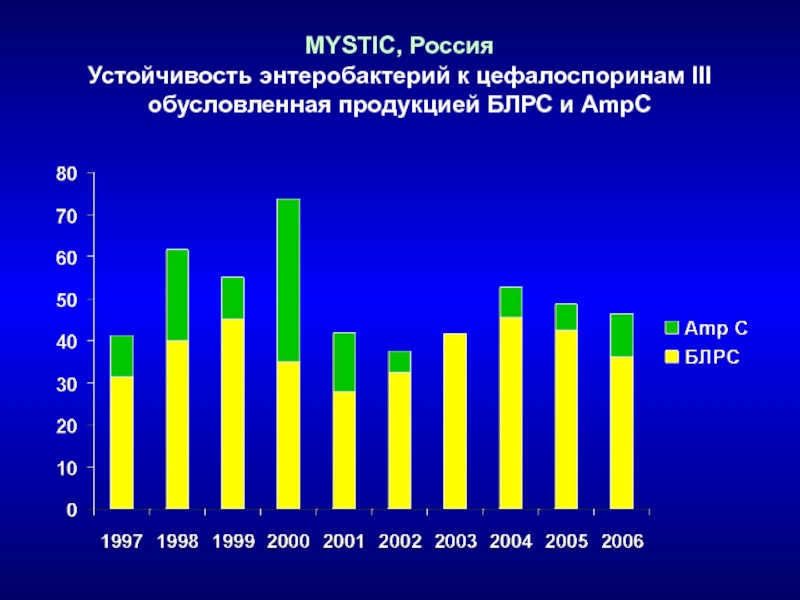






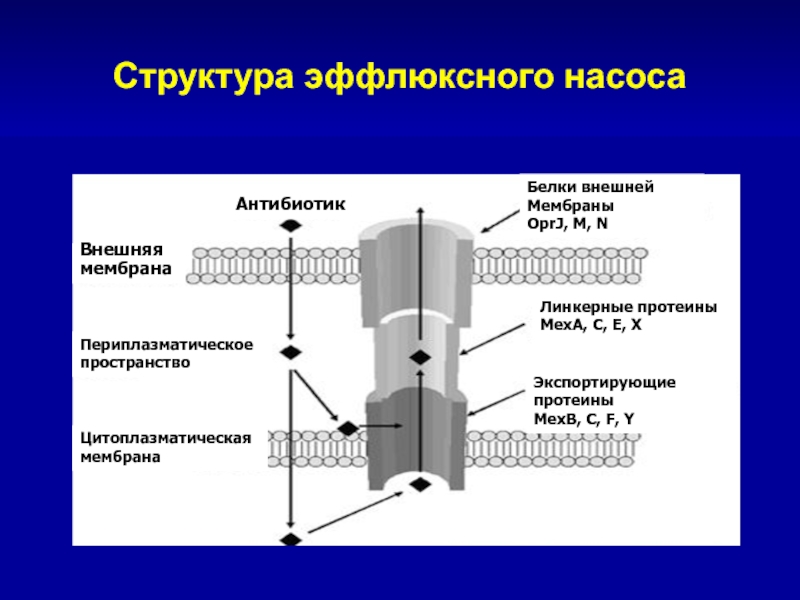

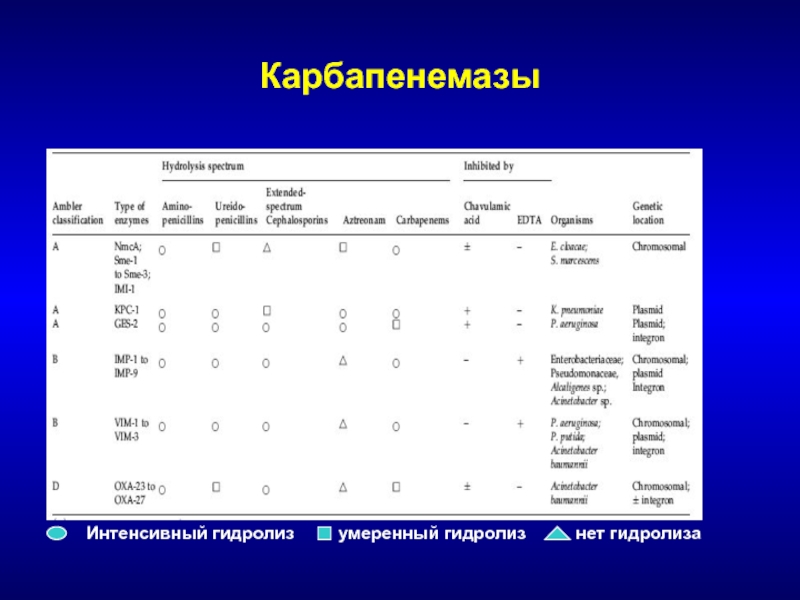



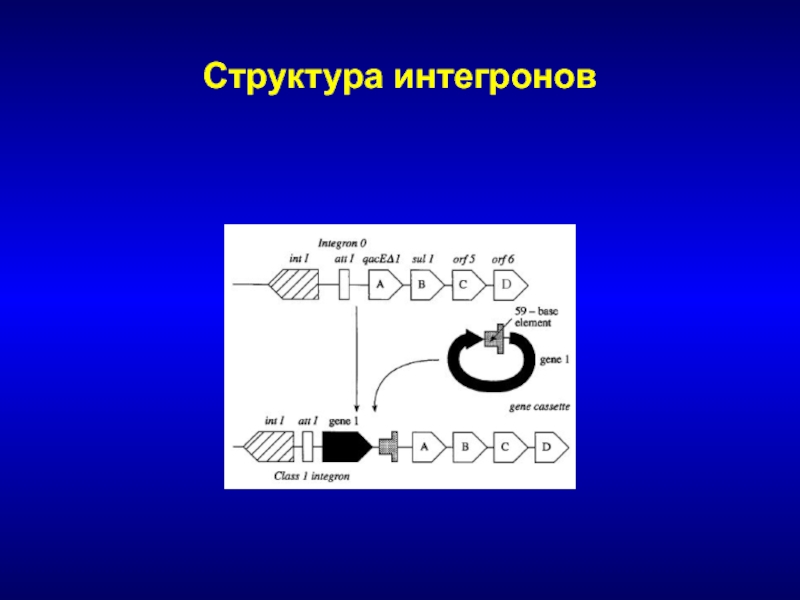





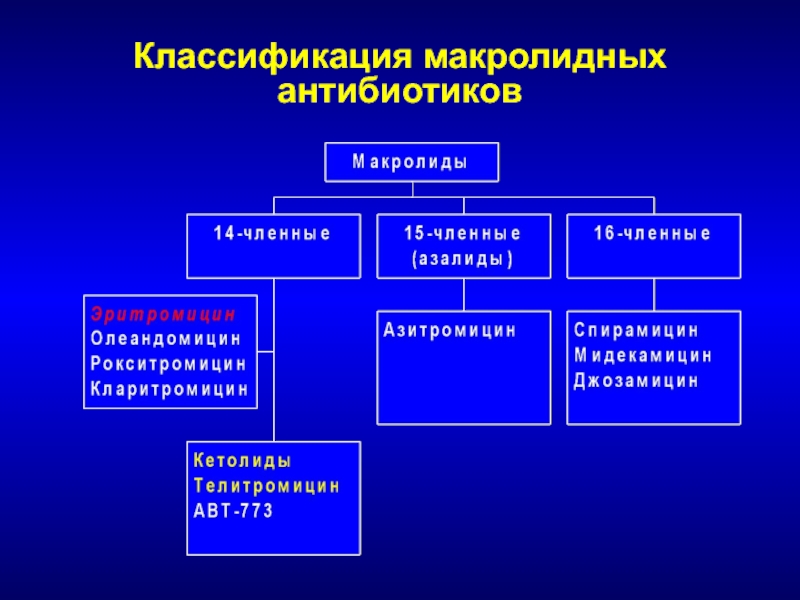




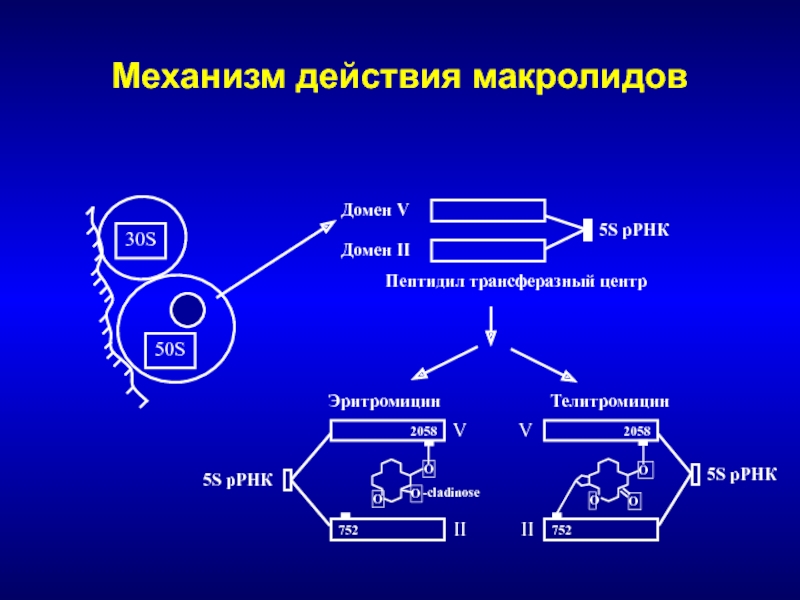
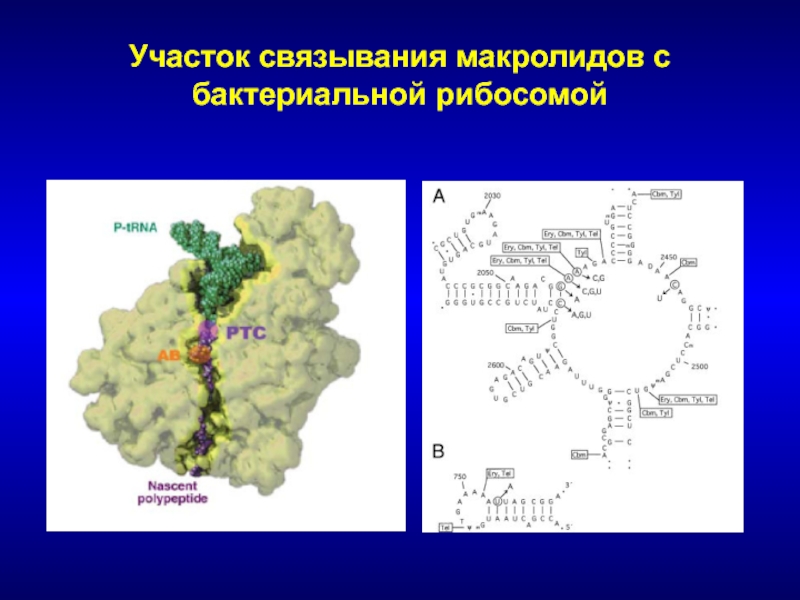


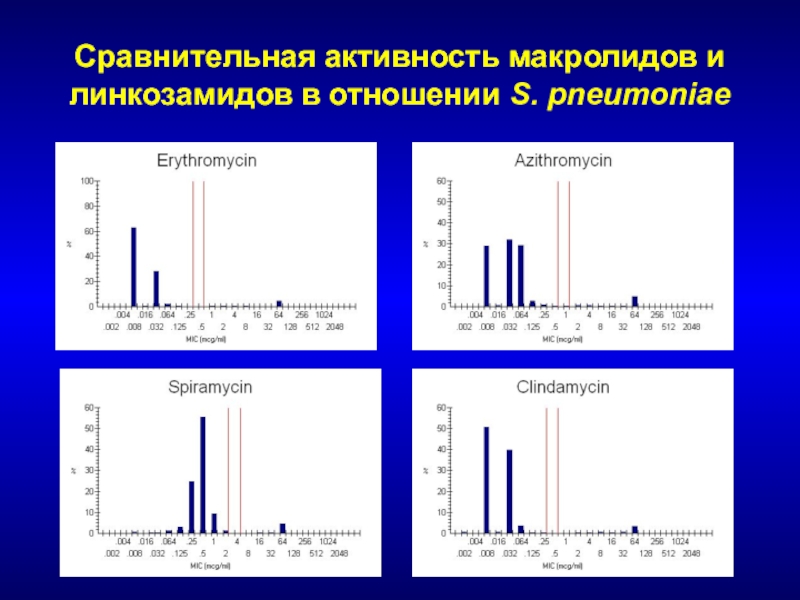
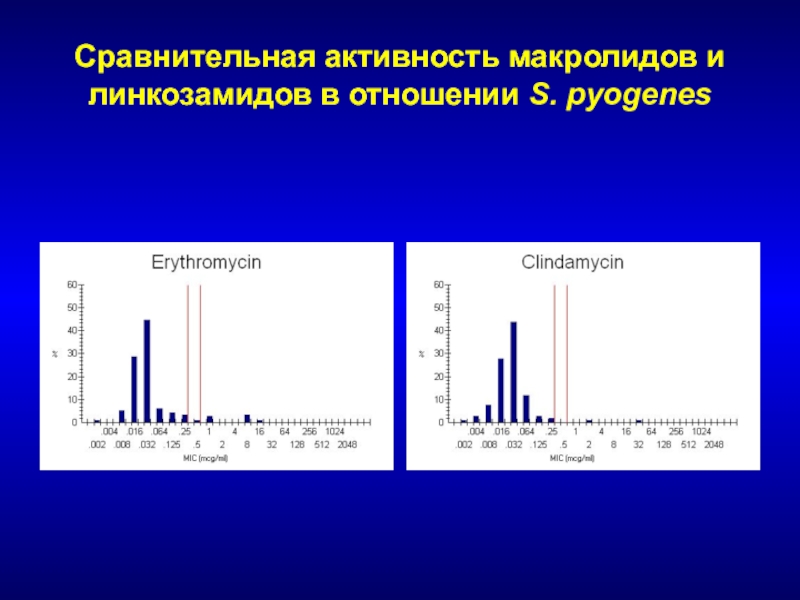
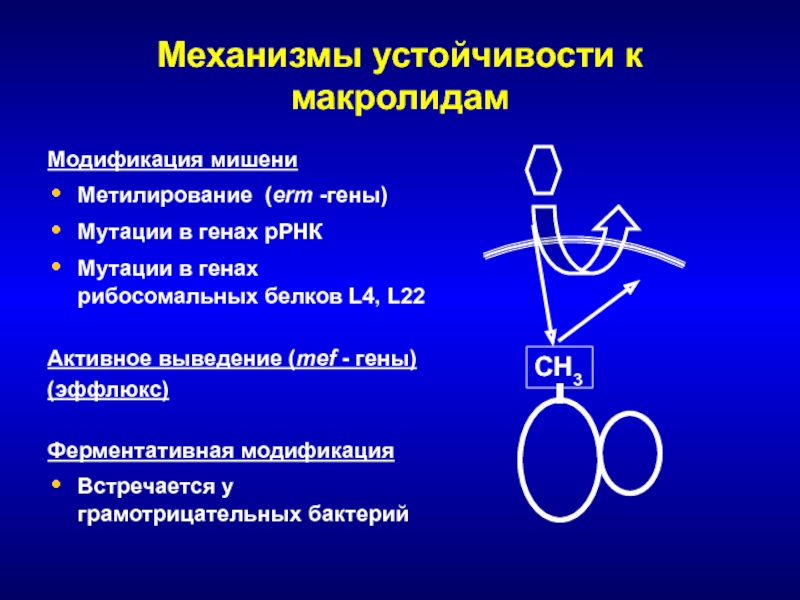
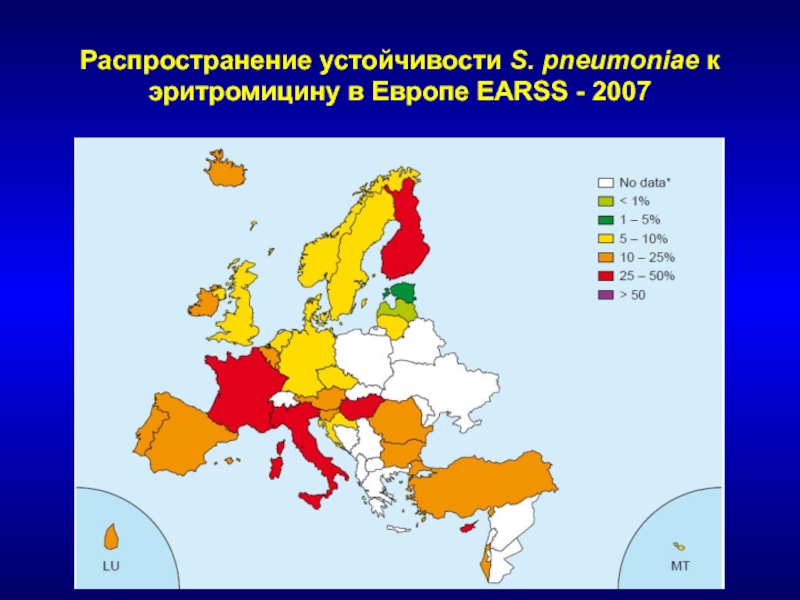
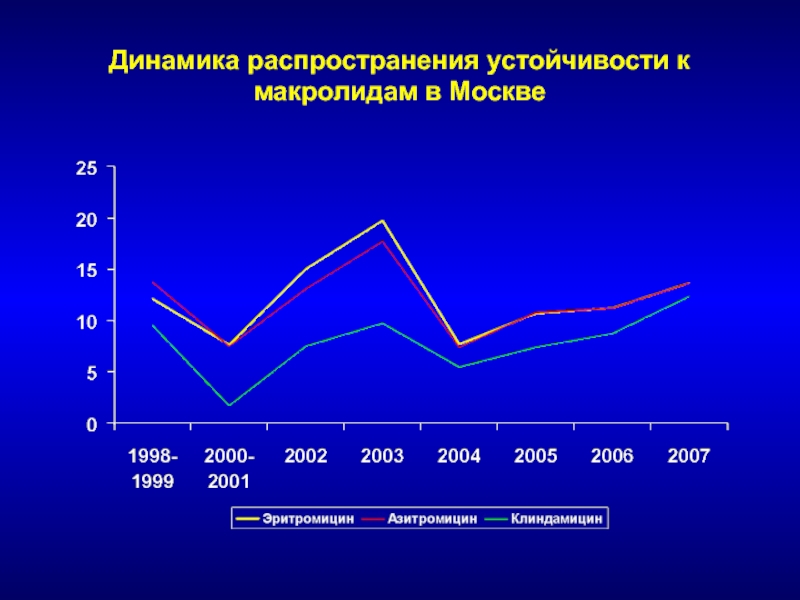




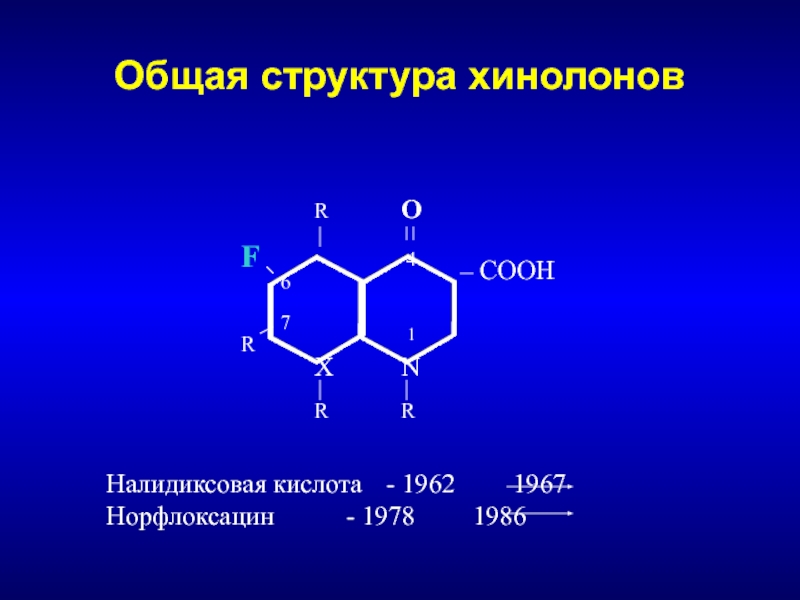
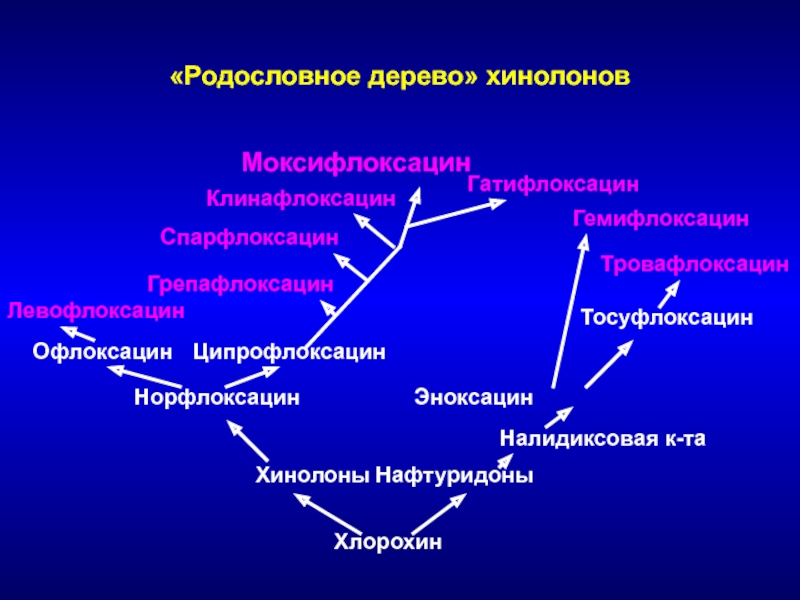


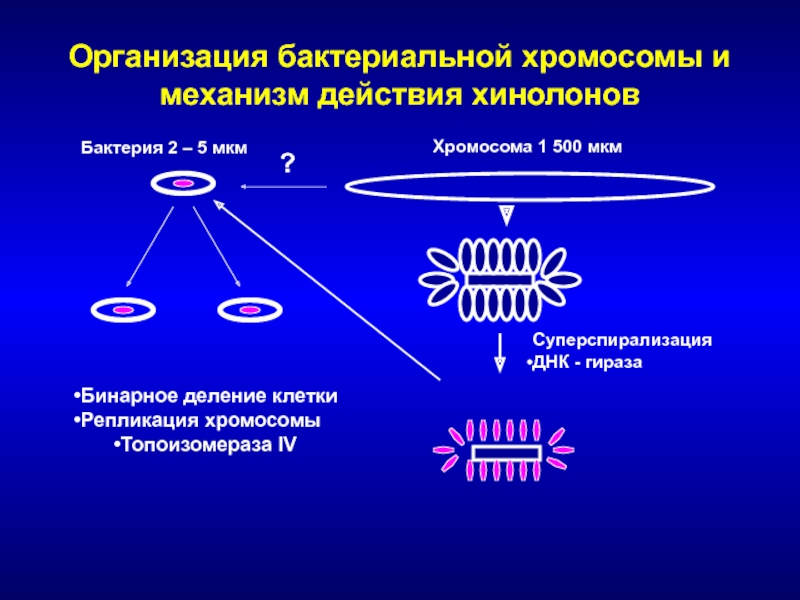
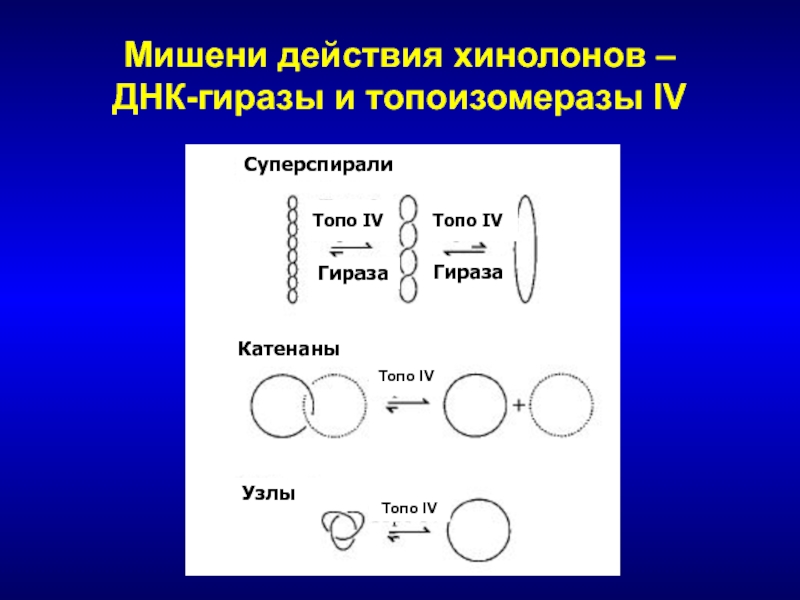
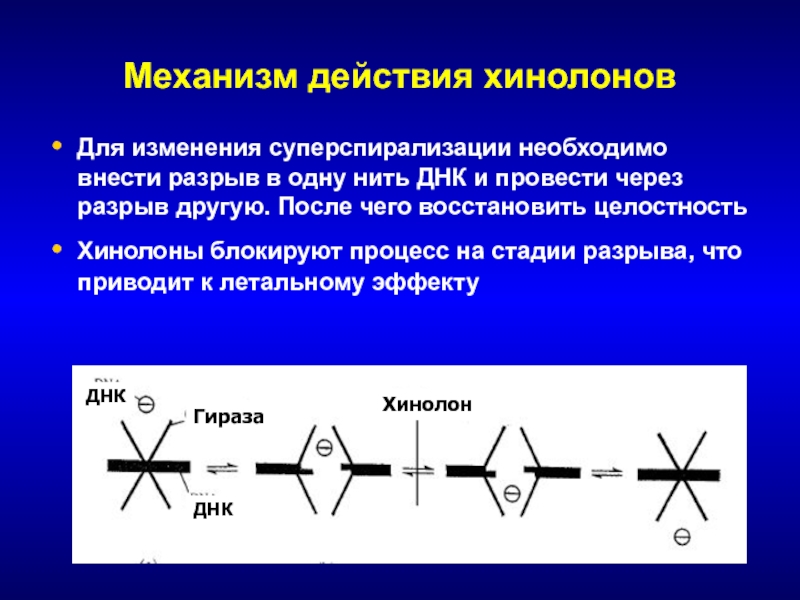
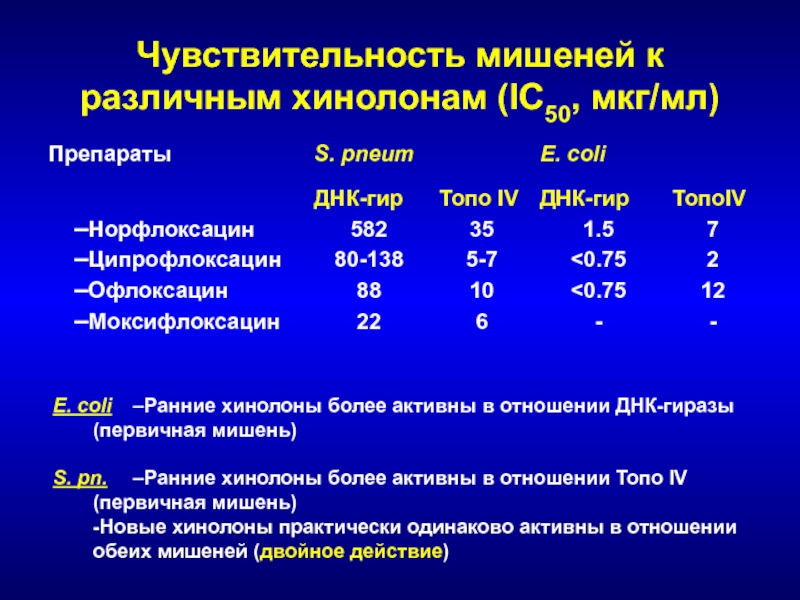


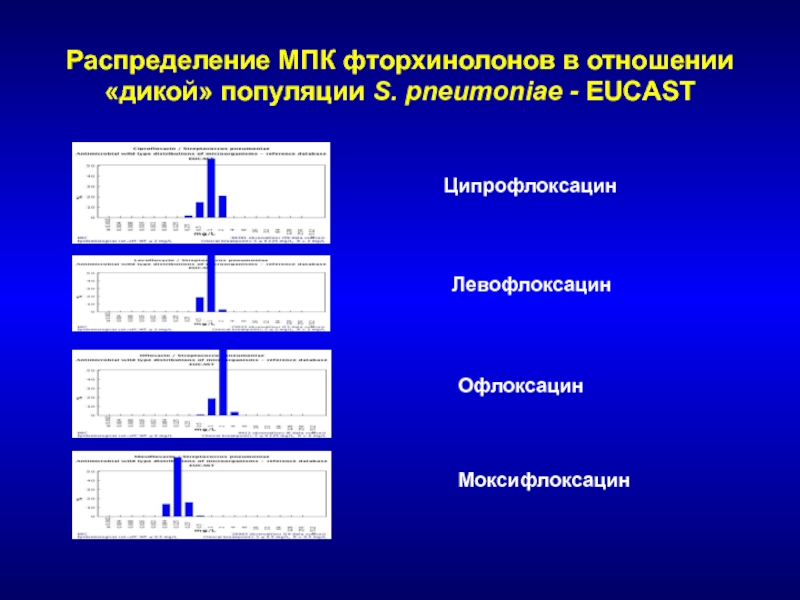

![Антибиотики Механизмы устойчивости к хинолонам [Heddle.J. AAC, 2002]Мутации в «области детерминирующей устойчивость Механизмы устойчивости к хинолонам [Heddle.J. AAC, 2002]Мутации в «области детерминирующей устойчивость к хинолонам» - «quinolone-resistance–determining region» ДНК-гиразы](/img/thumbs/10b5db4263d207adfe2becee2fd84fd4-800x.jpg)


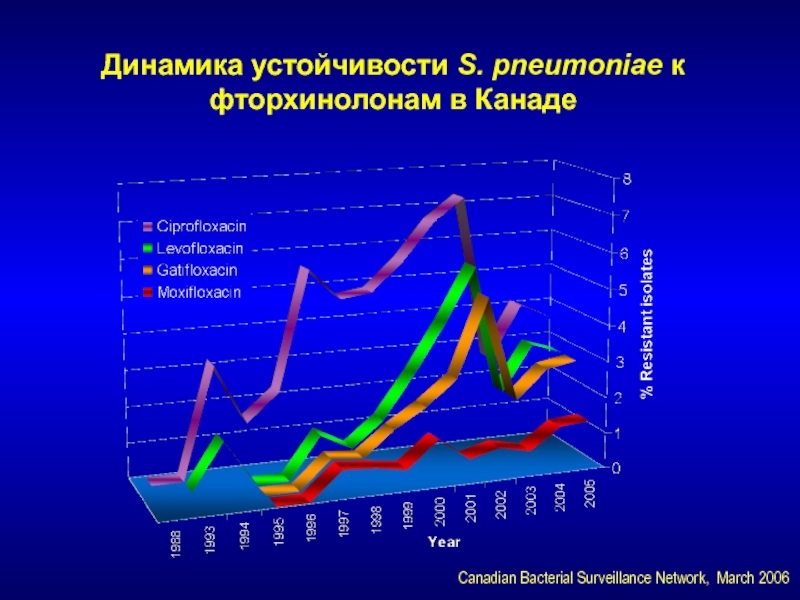









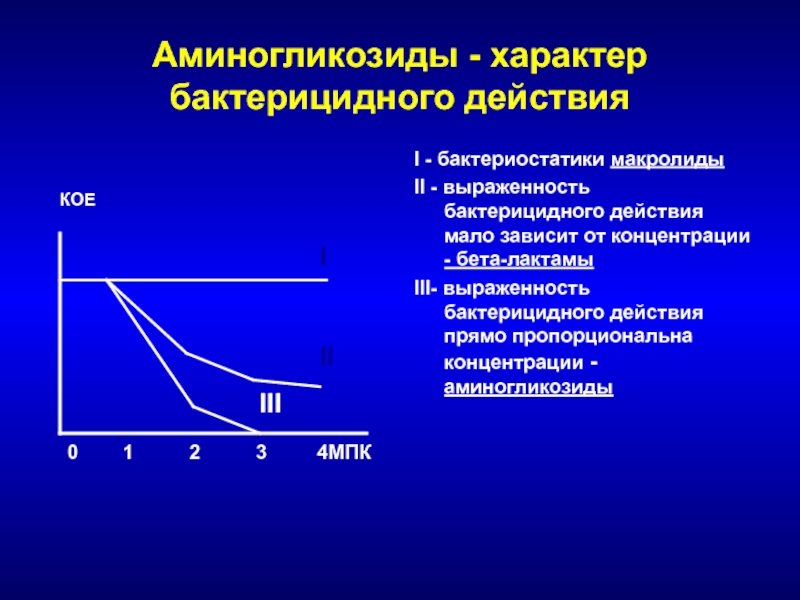




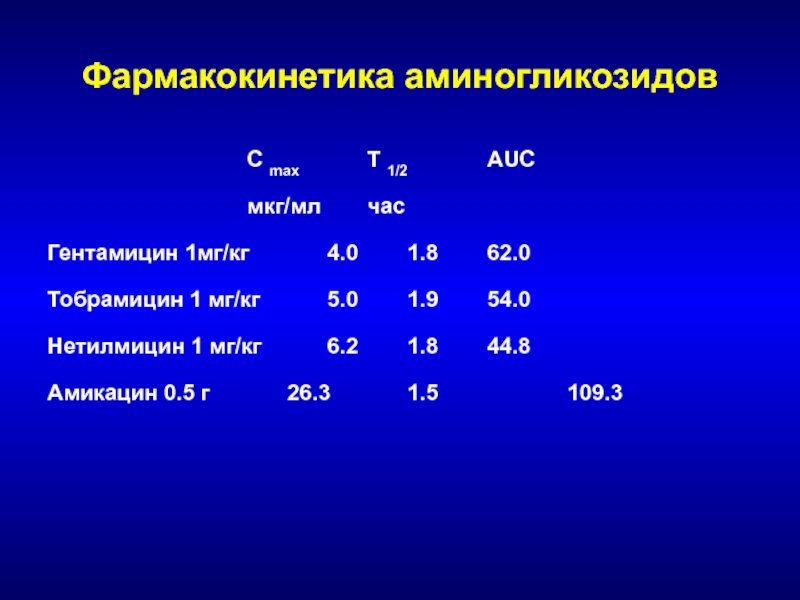
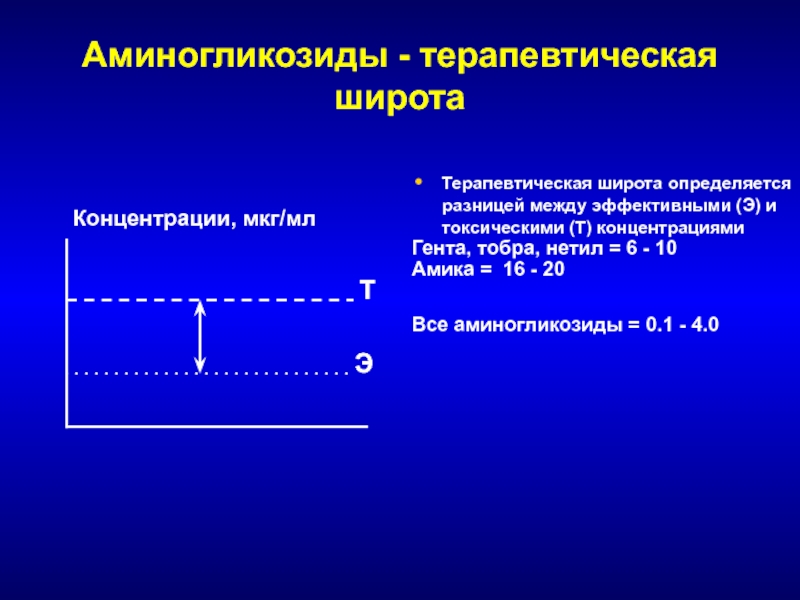













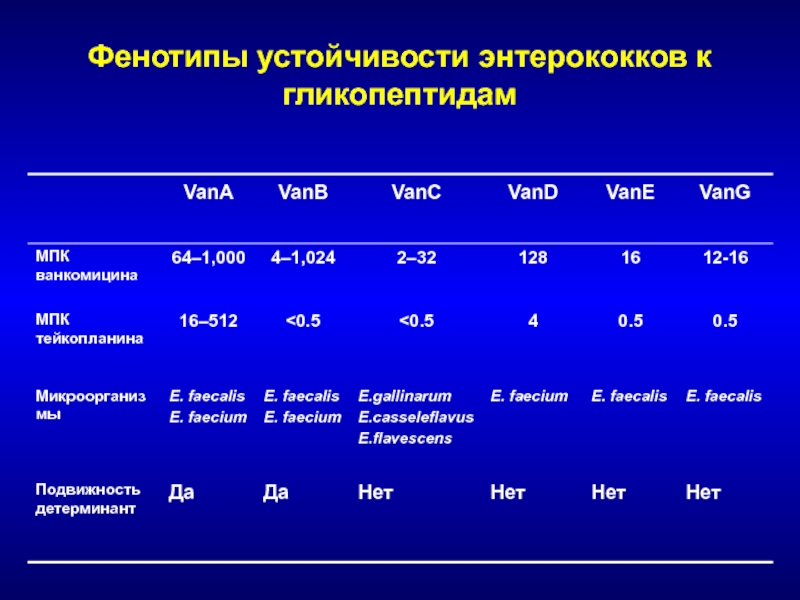
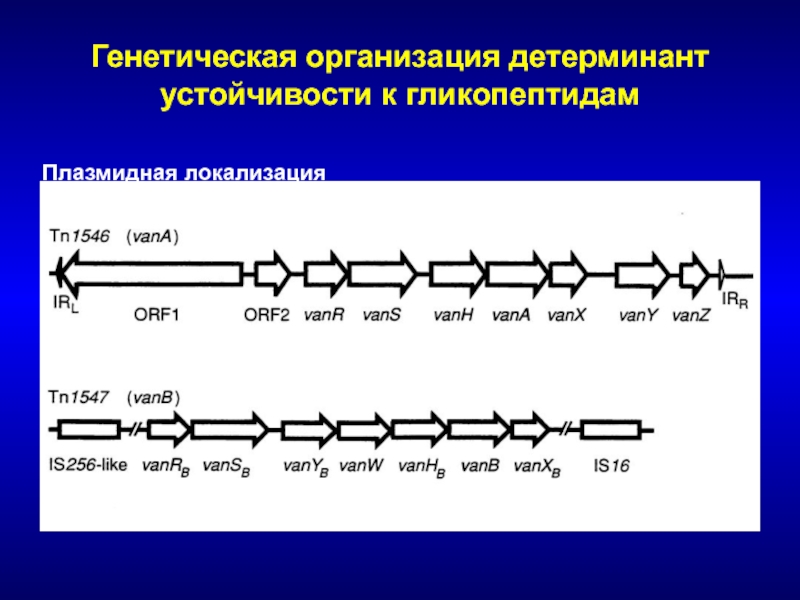
![Антибиотики Распространение VREСеверная АмерикаNNIS – 2003 - 27.5%Россия [Клясова и соавт.]2003 Первый Распространение VREСеверная АмерикаNNIS – 2003 - 27.5%Россия [Клясова и соавт.]2003 Первый штамм - пациент из онкогематологии -](/img/thumbs/91412f3ee2af7cab73ffe19455496fbb-800x.jpg)

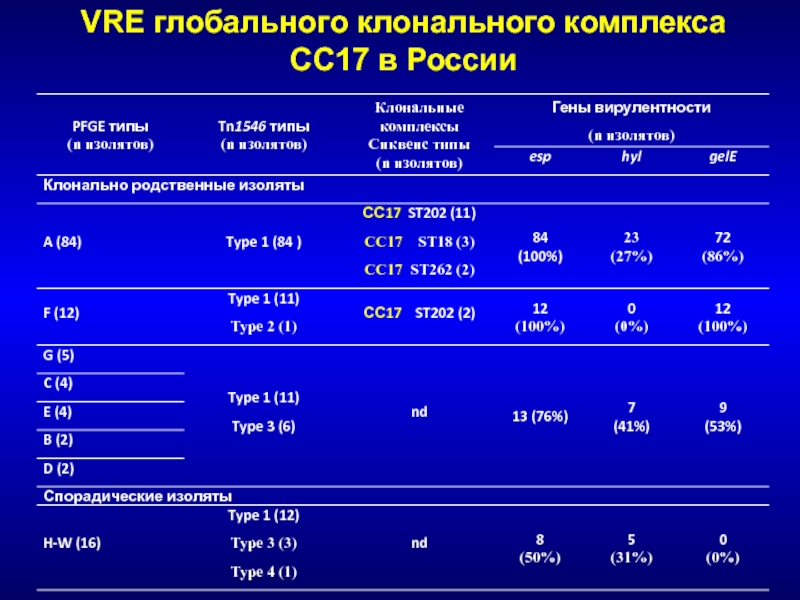
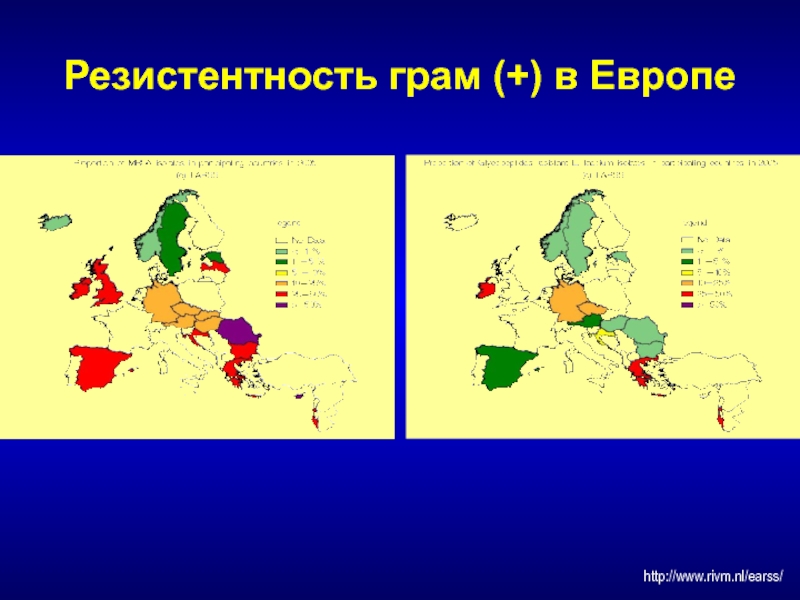




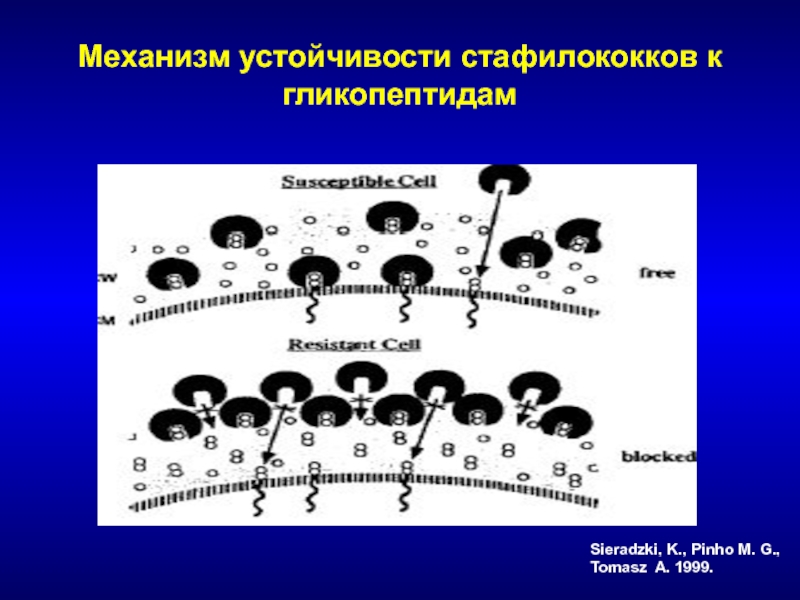



![Антибиотики Распространение hVISA [Liu C., Chambers H.F, AAC, 2003]Распространение среди 6052 штаммов Распространение hVISA [Liu C., Chambers H.F, AAC, 2003]Распространение среди 6052 штаммов ORSA 2.16% (0-73.6%)Япония, Корея, Гонконг,](/img/thumbs/3b08374bcee2825c5753353d7fdf5993-800x.jpg)
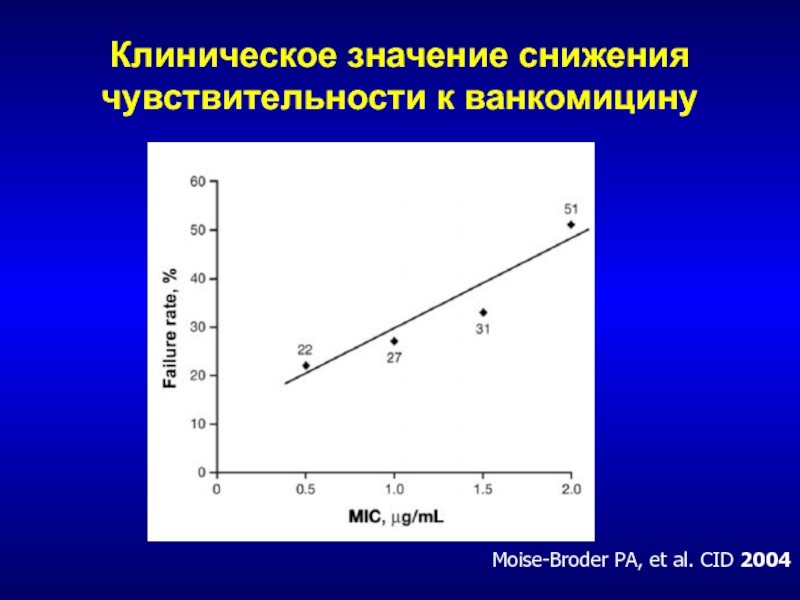





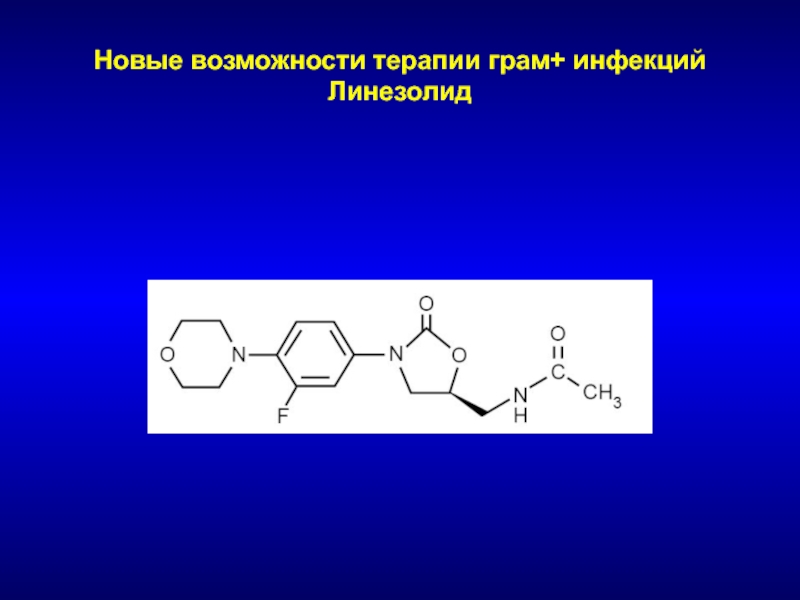








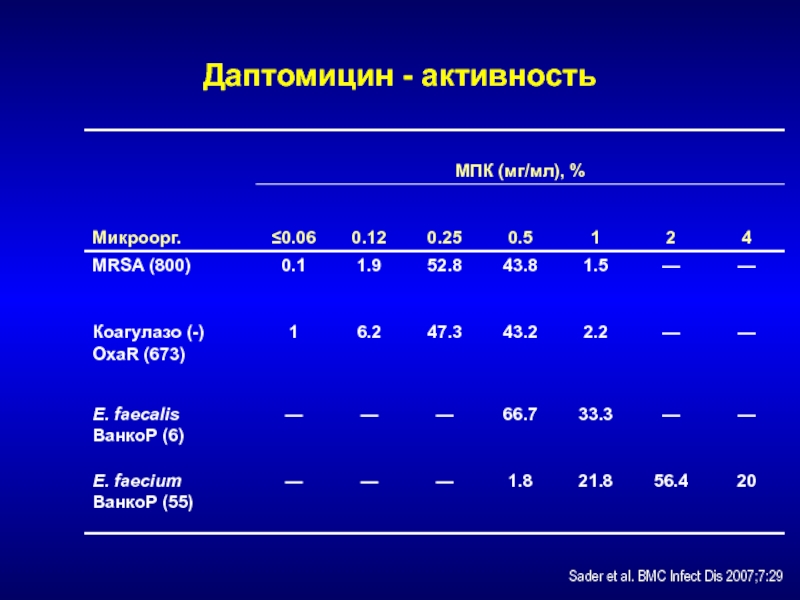
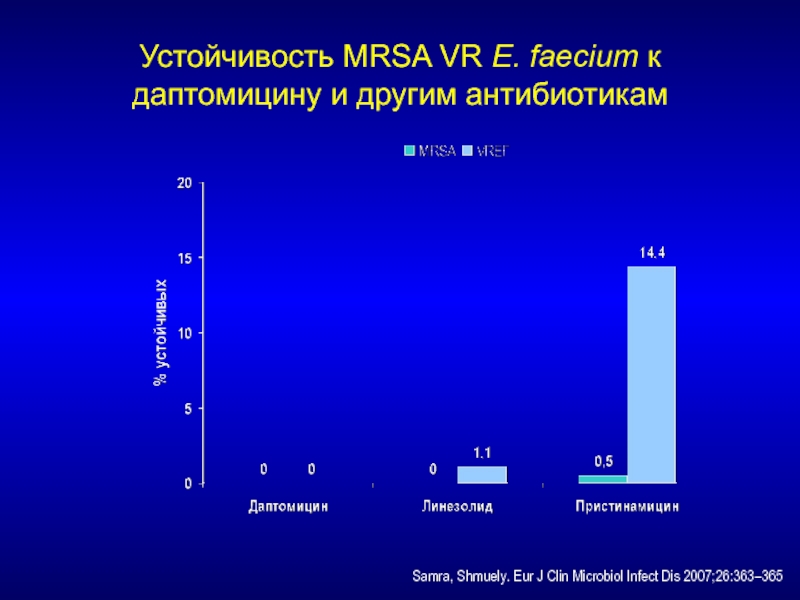
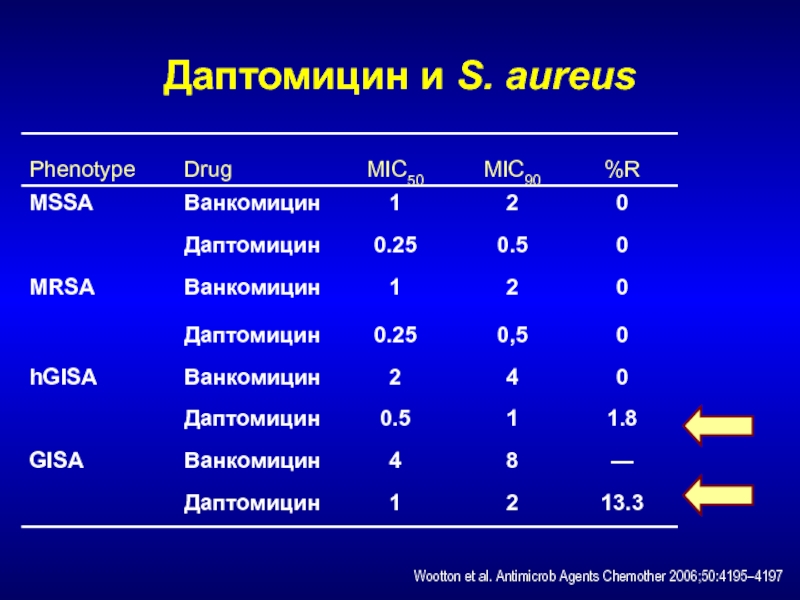

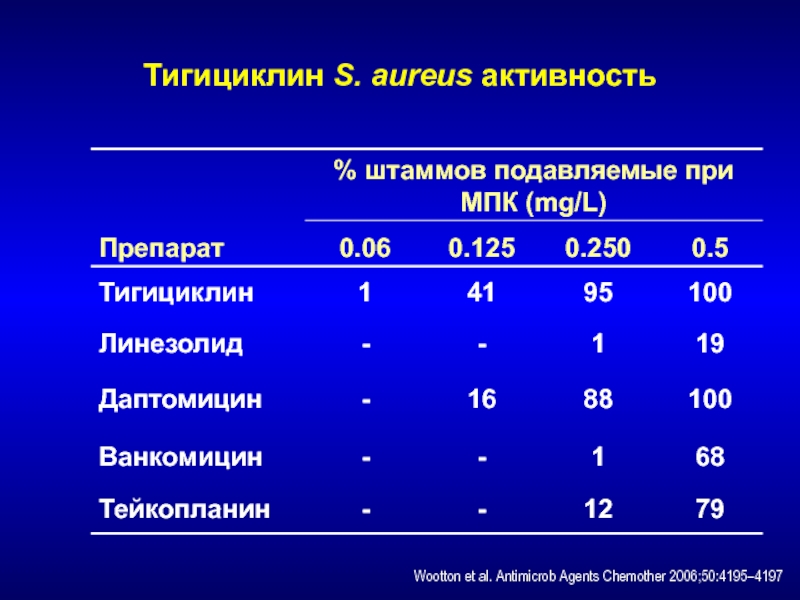


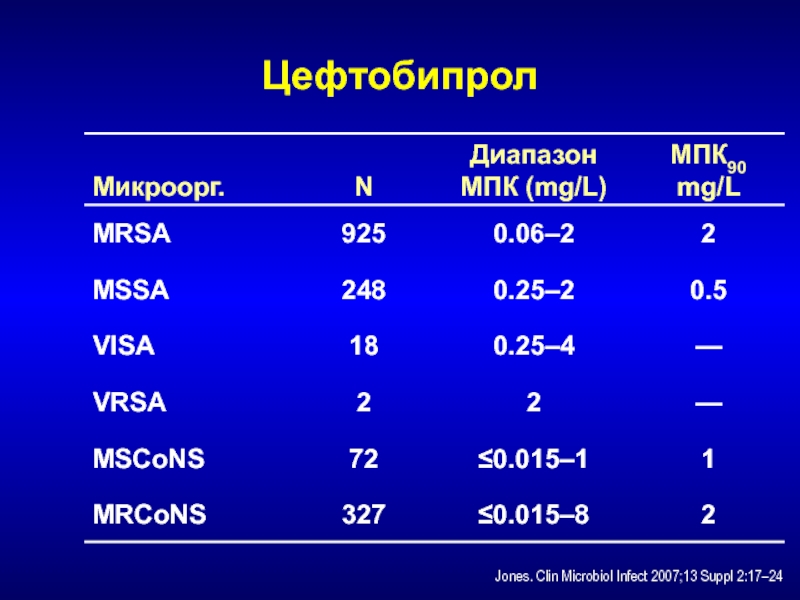



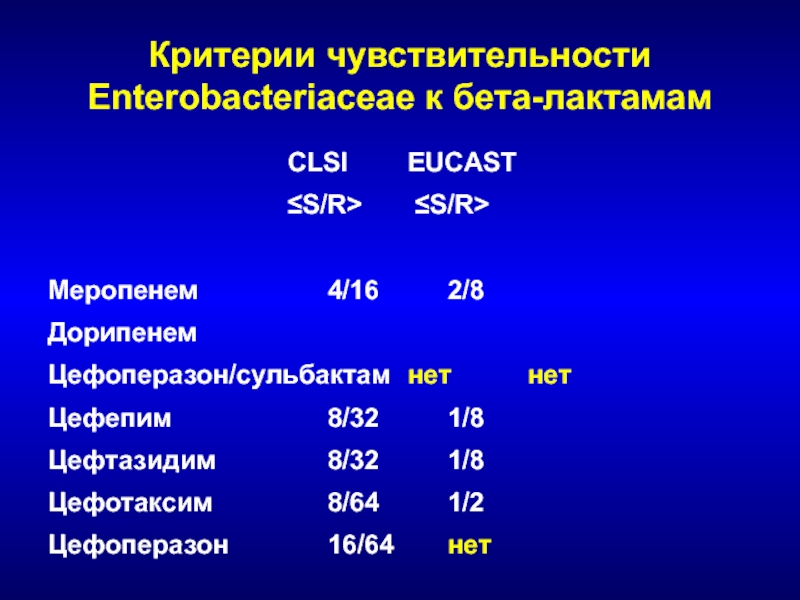
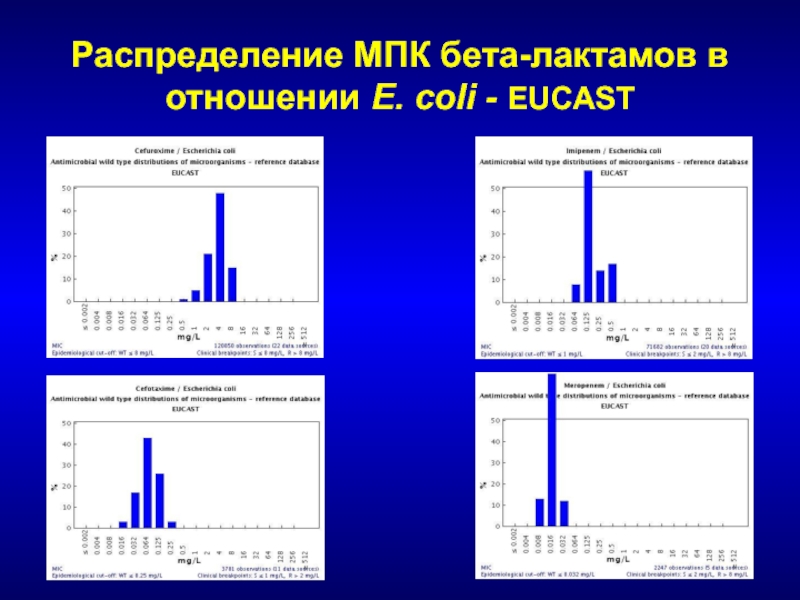
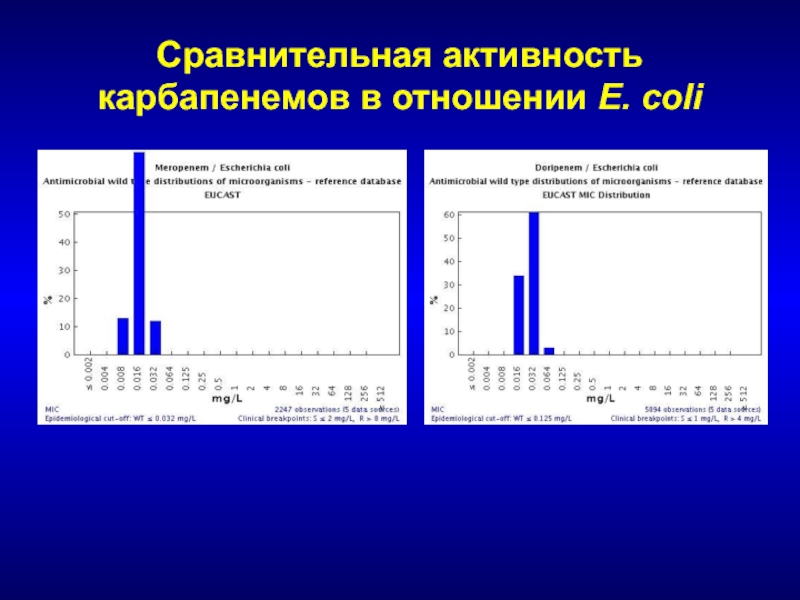
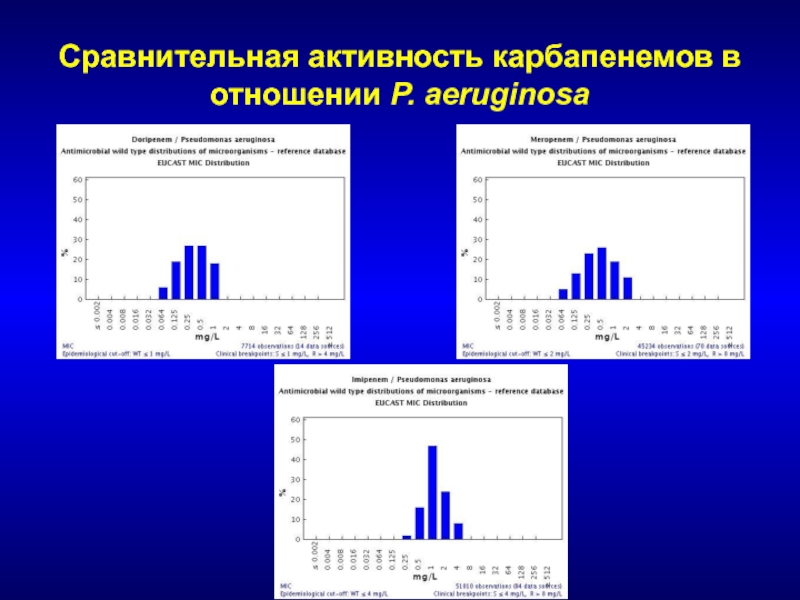
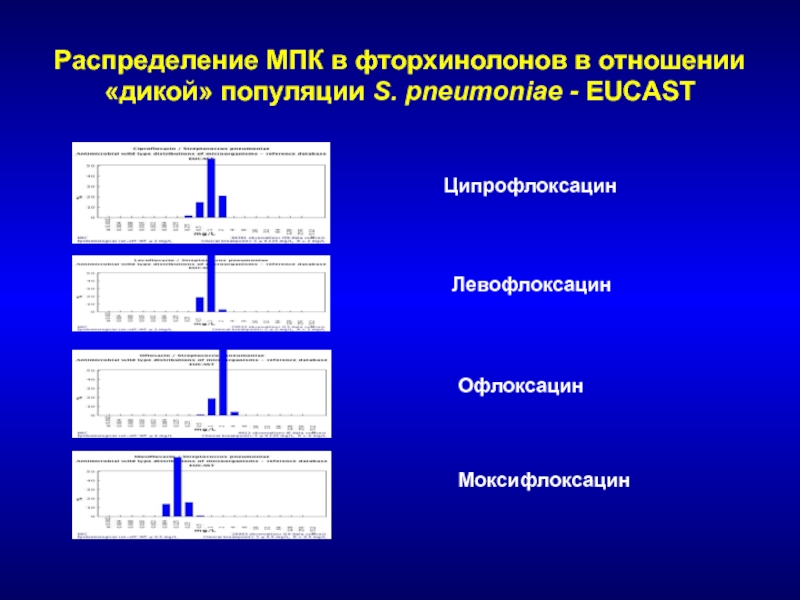




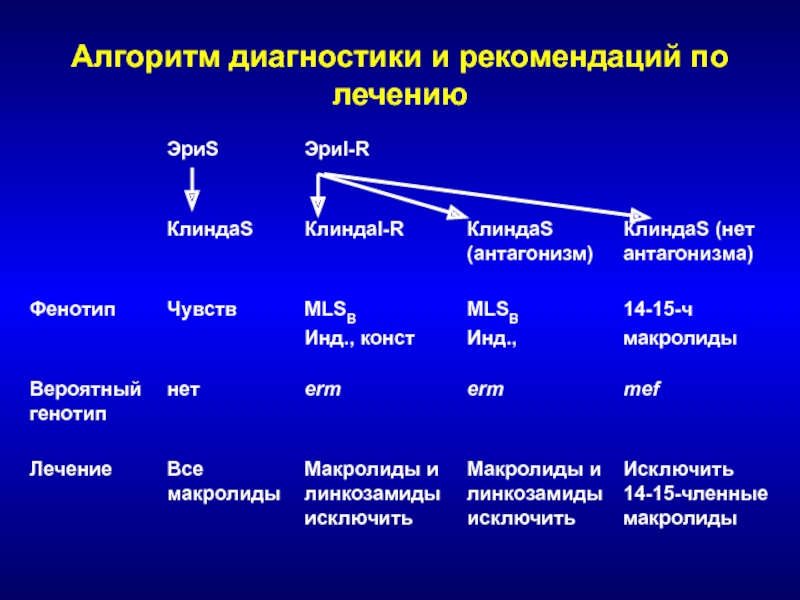



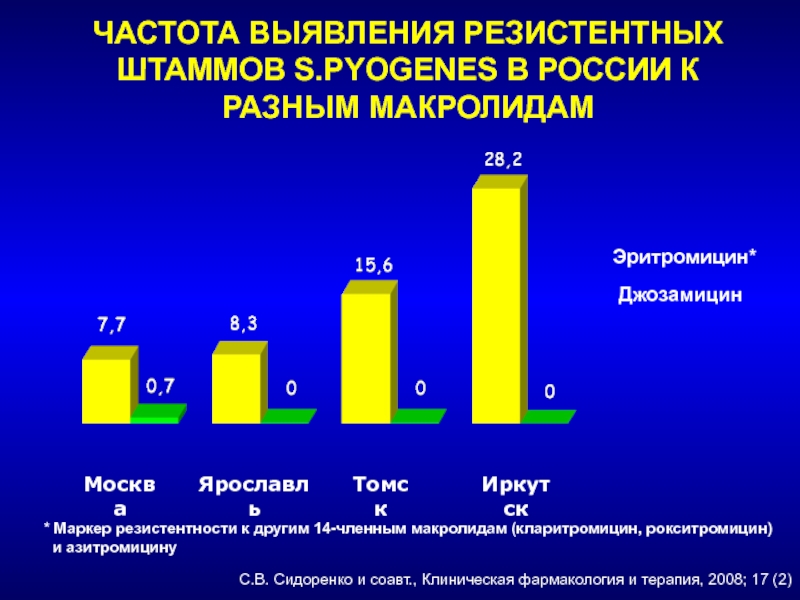




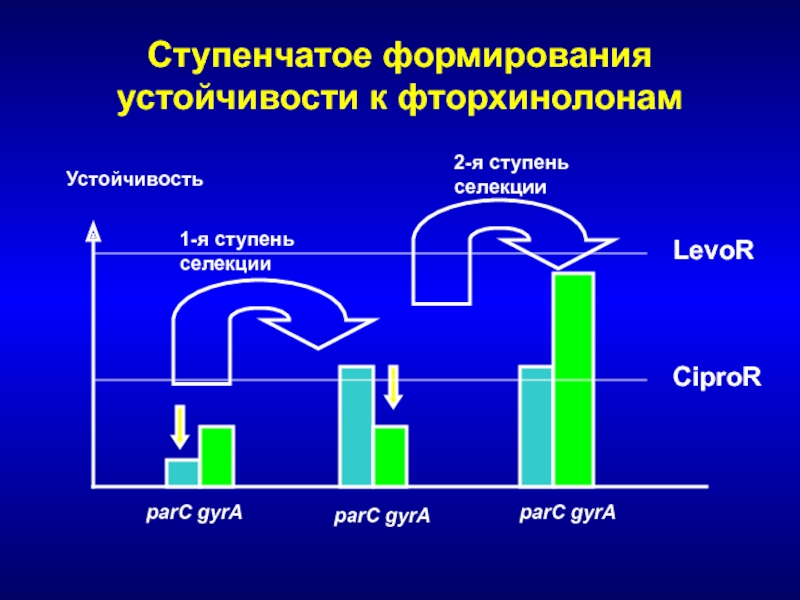
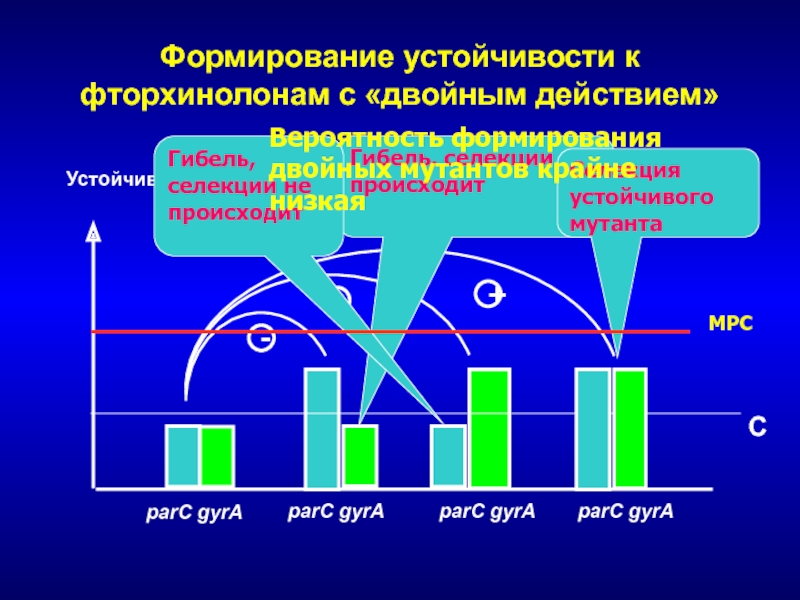

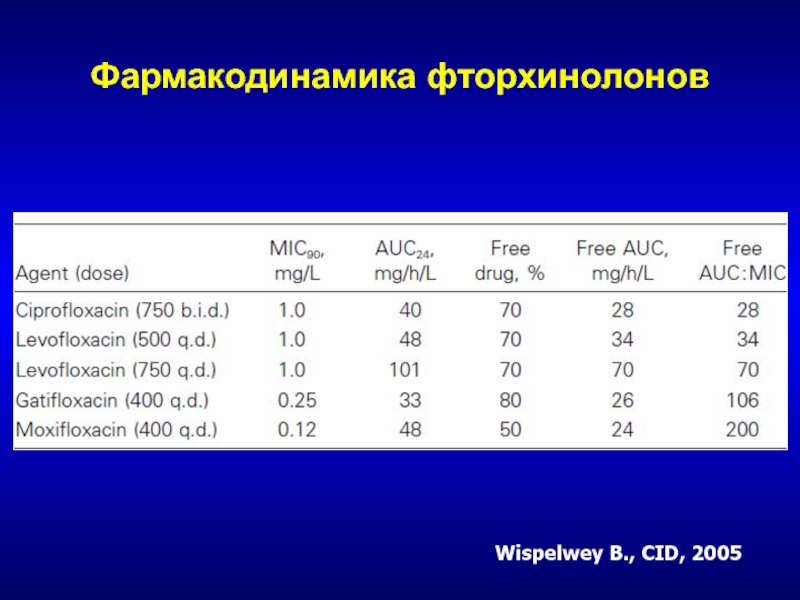
![Антибиотики Концентрации антибиотиков предотвращающие селекцию мутаций (MPC - mutation prevention concentration) [Drlica K]МПКМРСОкно селекции мутацийКонцентрацияпрепаратовLg кое Концентрации антибиотиков предотвращающие селекцию мутаций (MPC - mutation prevention concentration) [Drlica K]МПКМРСОкно селекции мутацийКонцентрацияпрепаратовLg кое](/img/thumbs/745e20181b6b7f1b2d50da741ba6c269-800x.jpg)