Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Динамические и статистические закономерности в природе
Содержание
- 1. Динамические и статистические закономерности в природе
- 2. *1. Энергия. Становление теории теплоты.«Теория производит тем
- 3. *1. Энергия. Становление теории теплоты.В течении длительного
- 4. *1. Энергия. Становление теории теплоты.Энергия – это
- 5. *
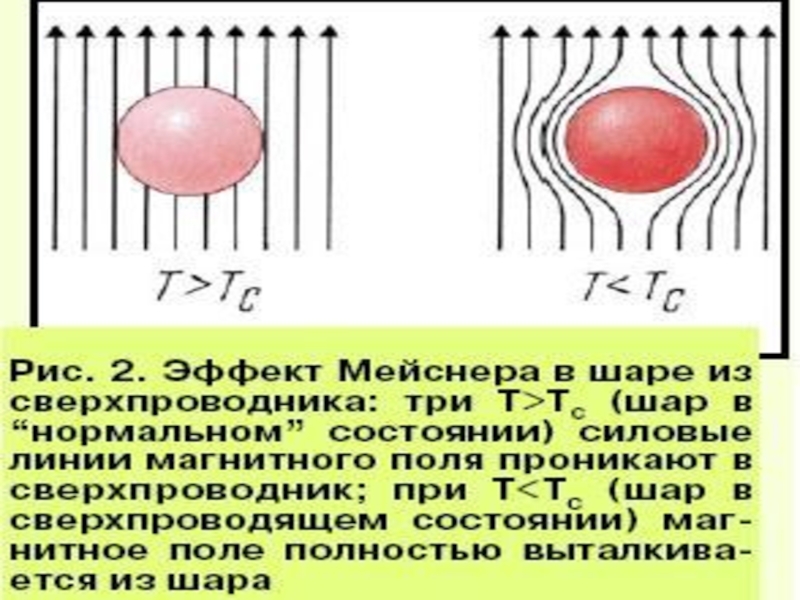
- 6. Сверхпроводимость в морозилке*
- 7. *
- 8. *1. Энергия. Становление теории теплоты.Теплород – вещественная
- 9. *1. Энергия. Становление теории теплоты.Однако господствующей в
- 10. *1. Энергия. Становление теории теплоты.К концу 18
- 11. *1. Энергия. Становление теории теплоты.Установлено, что теплота
- 12. *1. Энергия. Становление теории теплоты.В 18 –
- 13. *1. Энергия. Становление теории теплоты.Первое строгое определение
- 14. *
- 15. *
- 16. *
- 17. *
- 18. *
- 19. 2. Молекулярно-кинетические представленияМолекулярная физика изучает движение больших
- 20. 2. Молекулярно-кинетические представленияИмеется два подхода к изучению
- 21. 2. Молекулярно-кинетические представленияСтатистический подход исходит из микроскопического
- 22. *2. Молекулярно-кинетические представленияВ основе молекулярно-кинетических представлений о
- 23. *
- 24. *3. Хаос и порядок в природе.Энтропия определяет
- 25. *3. Хаос и порядок в природе.Понятие состояния
- 26. *3. Хаос и порядок в природе.В 1845-47
- 27. *3. Хаос и порядок в природе.Ограниченность действия
- 28. *3. Хаос и порядок в природе.В 1878
- 29. *3. Хаос и порядок в природе.Особенность тепловой
- 30. *3. Хаос и порядок в природе.Точка зрения
- 31. *3. Хаос и порядок в природе.С возникновением
- 32. *4. Начала термодинамики.Само название «термодинамика» указывает на
- 33. *4. Начала термодинамики.Нулевое начало термодинамики, сформулированное всего
- 34. *4. Начала термодинамики.Первое начало термодинамики – это
- 35. *4. Начала термодинамики.Первое начало термодинамики - это
- 36. *4. Начала термодинамики.Из I-го начала термодинамики следует
- 37. *4. Начала термодинамики.В современной термодинамике второе начало
- 38. *4. Начала термодинамики.Термодинамическая система - это совокупность
- 39. *4. Начала термодинамики.Равновесное состояние - это такое
- 40. *4. Начала термодинамики.Равновесным термодинамическим процессом называют процесс,
- 41. *Коэффициент полезногодействия теплового движителяК.П.Д. тепловой машины, работающей
- 42. *4. Начала термодинамики.Двигатель, работающий только за счет
- 43. *4. Начала термодинамики.Таким образом, между третьим началом
- 44. *
- 45. *
- 46. *Л.Больцман
- 47. *
- 48. *П.С.Лаплас
- 49. *
- 50. *5. Синергетика.Научному мировоззрению XIX века было присуще
- 51. *Синергетика.Синергетика – новое направление в познании человеком
- 52. *Синергетика.Понятие самоорганизации выражает способность сложных систем к
- 53. Синергетика.Автором термина «Синергетика» является Ричард Бакминстер Фуллер
- 54. Синергетика.Область исследований синергетики чётко не определена и
- 55. Синергетика.Математический аппарат синергетики скомбинирован из разных отраслей
- 56. *
- 57. *
- 58. *
- 59. *Синергетика.И лишь сравнительно недавно стало ясно, что
- 60. *Синергетика.Идеи самоорганизации высказывались еще в традиционной классической
- 61. *Синергетика.Важнейшее свойство самоорганизующихся систем – открытость. Открытые
- 62. *Синергетика.Другое важнейшее свойство самоорганизующихся систем – нелинейность.
- 63. *Синергетика. Механизм самоорганизации по И. Пригожину выглядит
- 64. *а — устойчивый узел;b — неустойчивый узел;
- 65. *Синергетика.В ходе эволюционного этапа развития диссипативная система
- 66. *Синергетика.Та траектория или направление, которое отличается от
- 67. *Синергетика.Различают несколько разновидностей аттрактора, среди которых следует
- 68. Странный аттрактор — это аттрактор, не являющийся
- 69. Синергетика.Это явление также называют эффектом бабочки, подразумевая
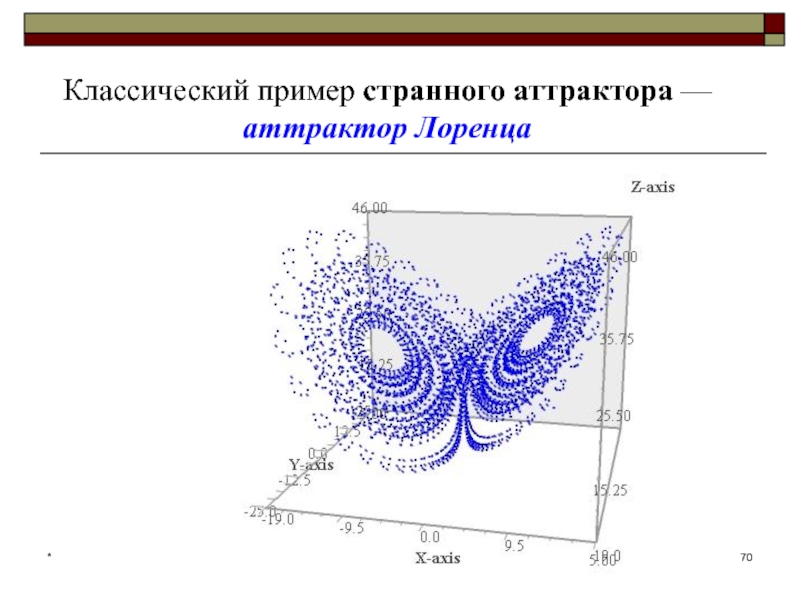
- 70. *Классический пример странного аттрактора — аттрактор Лоренца
- 71. Синергетика.Аттракторы классифицируют по:Формализации понятия стремления: различают максимальный
- 72. *Синергетика.В точке бифуркации система как бы «колеблется»
- 73. *
- 74. *С ростом сложности системы растет и вероятность
- 75. *. В 1927 году бельгийским ученным Ж.
- 76. *Синергетика.Самоорганизующиеся системы должны отвечать требованиям:Быть неравновесными, т.е.
- 77. *Синергетика.Развитие теории самоорганизации идет по нескольким направлениям:
- 78. *Ячейка Бенара – конвективная неустойчивость
- 79. *Ячейка Бенара – конвективная неустойчивость
- 80. Ячейка Бенара – конвективная неустойчивостьЯчейки Бенара или
- 81. *
- 82. *
- 83. Российские физики почти случайно открыли новую форму самоорганизации в гидродинамике. *
- 84. *С мировоззренческой точки зрения синергетику иногда позиционируют,
- 85. *
- 86. *
- 87. *Основное понятие синергетики — определение структуры как
- 88. *Этот феномен трактуется синергетикой как всеобщий механизм
- 89. Реакция Белоусова—Жаботинского — класс химических реакций, протекающих
- 90. *
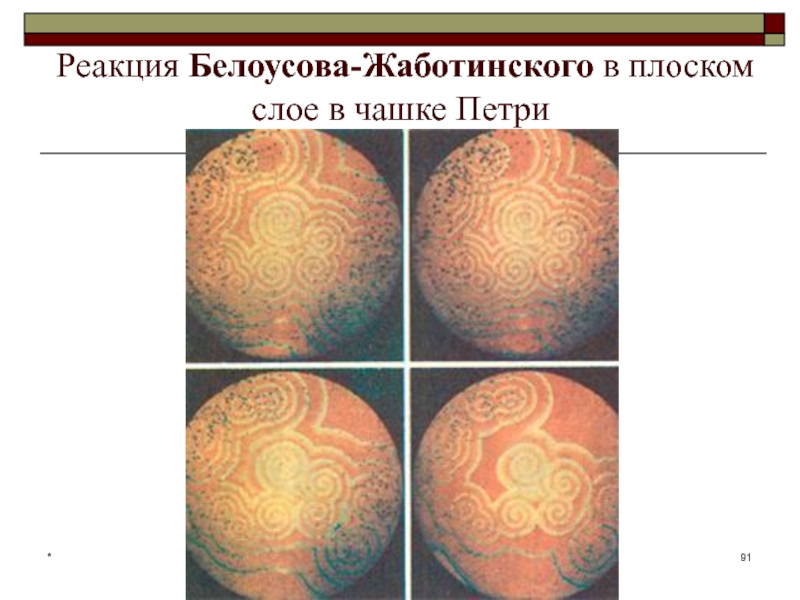
- 91. Реакция Белоусова-Жаботинского в плоском слое в чашке Петри*
- 92. Синергетика.Наблюдаются случаи использования терминологии синергетики для придания
- 93. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1*
Лекция 12-13
Динамические и статистические закономерности в природе
Энергия. Становление теории теплоты.
Молекулярно-кинетические
представления.
Слайд 2*
1. Энергия. Становление теории теплоты.
«Теория производит тем большее впечатление, чем
проще ее посылки, чем различнее явления, между которыми она устанавливает
связь, чем обширнее область ее применения. Отсюда глубокое впечатление, которое произвела на меня термодинамика. Она – единственная физическая теория универсального содержания, относительно которой я убежден, что в пределах применимости ее основных понятий она никогда не будет опровергнута.» А.Эйнштейн.Слайд 3*
1. Энергия. Становление теории теплоты.
В течении длительного времени считалось, что
применение термодинамики ограничивается различными техническими устройствами. Успехи физики низких температур
(сверхпроводимость, сверхтекучесть), открытие явлений магнитного резонанса и когерентного усиления излучения (лазеры и мазеры) послужили мощным стимулом к исследованиям по статистической термодинамике. Особый интерес вызывает понятие энтропии, введенное Р.Клаузисом и развитое Л.Больцманом, которое играет универсальную роль. Энтропия является одним из фундаментальных понятий в одном ряду с энергией.Слайд 4*
1. Энергия. Становление теории теплоты.
Энергия – это универсальная мера любых
форм движения материи. Понятия «огонь», «свет», «теплород» встречались еще в
Древней Греции. В 17в. Пьер Гассенди теплоту и холод трактует как разные виды материи, причем атомы холода являются острыми, а атомы тепла круглыми. Учение о тепловых явлениях начинает развиваться только в середине 18 века. Толчком для этого явилось изобретение термометра (Галилей) и его модернизация (Амонтон, Гук, Фаренгейт, Цельсий, Реомюр, Делиль, Гюйгенс).Все эти исследования не разделяли температуру и теплоту, которые являлись мерой сгущения теплорода.
Слайд 8*
1. Энергия. Становление теории теплоты.
Теплород – вещественная причина жара, тепла
и холода, непостижимо тонкая жидкость, изливающаяся из Солнца и проникающая
во все тела физического мира, невидимая, невесомая и только ощущением ощущаемая.- «Теплородная или вещественная теория тепла». Единица измерения теплоты – «калория» в переводе на русский означает теплород.Существовала и другая точка зрения, которая связывала тепловые явления с движением атомов, из которых состоят тела «кинетическая или корпускулярная теория теплоты». Ее придерживались: Ф.Бекон, И.Ньютон, Р.Декарт, Д.Бернулли, Р.Бойль, М.Ломоносов, Л.Эйлер.
Слайд 9*
1. Энергия. Становление теории теплоты.
Однако господствующей в течении столетия была
субстанциональная (вещественная, теплородная) теория теплоты. Смертельный удар был нанесен опытами
Б.Румфорда. Также, как и теория флогистона была опровергнута А.Лавуазье, так и теория теплорода после опытов по сверлению пушек потерпела первое поражение.Благодаря М.Ломоносову в России было много сторонников кинетической теории теплоты.
После экспериментального подтверждения сохранения теплоты при теплообмене был сделан неверный вывод о сохранении (неуничтожимости) теплорода.
Понятие энергии еще не было введено.
Слайд 10*
1. Энергия. Становление теории теплоты.
К концу 18 в. теплородная теория
теплоты начала сталкиваться с трудностями и к середине 19 в.
потерпела полное поражение так, как:опыты показали, что тепловой жидкости нет;
при совершении работы паровыми машинами пар охлаждается и теплота исчезает;
источник тепла неисчерпаем, поэтому он не может быть материальной субстанцией.
Теплород не существует, а теплота – есть движение.
Нагревание тела связано с увеличением его энергии.
Слайд 11*
1. Энергия. Становление теории теплоты.
Установлено, что теплота – особая и
единственная в определенном смысле форма энергии.
Немецкий ученый Ю.Майер в 1842
г. сформулировал закон эквивалентности работы и теплоты, т.е. закон сохранения энергии.Немецкий ученый, пивовар Д.П.Джоуль опытным путем установил механический эквивалент тепла, равный 427 кГс м /ккал.
Установлено, что механическая и тепловая энергии – две формы энергии из большого числа ее форм.
Значительный вклад в развитие теории тепловых явлений внесли: немецкий физик Р.Клаузиус, английский естествоиспытатель Д.Максвелл, австрийский ученый Л.Больцман и др.
Слайд 12*
1. Энергия. Становление теории теплоты.
В 18 – 19 вв. были
установлены два, как тогда полагали, независимых друг от друга закона
сохранения: закон сохранения массы и закон сохранения энергии, в соответствии с которыми масса и энергия изолированной системы неизменны.Это способствовало развитию двух методов исследования: термодинамического и статистического (молекулярно-кинетического).
Слайд 13*
1. Энергия. Становление теории теплоты.
Первое строгое определение энергии дал в
1853 г. англ.ученый У.Томсон (лорд Кельвин): «Энергия материальной системы в
определенном состоянии есть измеренная в единицах механической работы сумма всех действий, которые производятся вне системы, когда она любым способом переходит из этого состояния в произвольно выбранное нулевое состояние».Более широкое определение дал Ф.Энгельс: «Энергия – это общая скалярная мера различных форм движения материи»
Все виды энергии превращаются в тепло и рассеиваются в ОС. Чем больше рассеивается, деградирует энергия, тем больше растет величина энтропии.
Энтропия – мера рассеяния энергии.
Слайд 192. Молекулярно-кинетические представления
Молекулярная физика изучает движение больших совокупностей атомов и
молекул. Молекулы и атомы находятся в непрерывном движении, которое впервые
обнаружил в 1827 г. ботаник Р.Броун. Природа броуновского движения была понята в 1905-1906 годах ( А.Эйнштейн и М.Смолуховский – молекулярно-статистическая теория броуновского движения). Их теоретические предсказания были проверены Ж.Б.Перреном.: 1. Хаотическое движение молекул газа или колебательное движение молекул твердого тела (жидкости) – тепловое движение. 2.Энергия, связанная с этим движением – внутренняя энергия.*
Слайд 202. Молекулярно-кинетические представления
Имеется два подхода к изучению макроскопических явлений в
макротелах:
Термодинамика или термодинамический подход – феноменологическое исследование явлений и
свойств материальных тел, характеризуемых макроскопическими параметрами Р, Т, V и др. Основа подхода – начала, которые являются обобщением опыта. В этом подходе не выявляются микроскопические механизмы изучаемых явлений. Теплота рассматривается как какое-то внутреннее движение без конкретизации.*
Слайд 212. Молекулярно-кинетические представления
Статистический подход исходит из микроскопического описания. Для этого
вводится представление об атомно-молекулярном строении вещества. В этом случае теплота
рассматривается как проявление беспорядочного движения атомов и молекул. Законы поведения систем большого числа частиц выводятся из статистических закономерностей.Оба подхода используют молекулярно-кинетическую теорию, но в разной степени.
*
Слайд 22*
2. Молекулярно-кинетические представления
В основе молекулярно-кинетических представлений о строении лежат 3
положения:
Любое тело состоит из большого числа малых частиц;
Молекулы находятся в
хаотическом движении;Интенсивность движения молекул зависит от температуры вещества.
Из основного уравнения молекулярно-кинетической теории вытекает: средняя кинетическая энергия поступательного движения одной молекулы идеального газа прямо пропорциональна его термодинамической температуре и зависит только от нее:
E = 3/2 k T
Термодинамическая температура – мера кинетической энергии поступательного движения идеального газа, что раскрывает молекулярно-кинетическое толкование температуры.
Слайд 24*
3. Хаос и порядок в природе.
Энтропия определяет многие закономерности в
поведении систем в направлении их эволюции.
Понятие энтропии оказалось связанным
с количеством информации и с качеством энергии. Энтропия позволяет количественно оценить порядок (структуру) и беспорядок (хаос), а также их взаимосвязь и возможность перехода одного в другое.
Идея о возможности превращения хаоса в порядок легла в основу синергетики, научного направления на стыке физики, химии, математики, биологии и социологии.
Слайд 25*
3. Хаос и порядок в природе.
Понятие состояния физической системы является
центральным элементом физической теории. В зависимости от того, как это
состояние определяется теории делятся на динамические и статистические.К первым относятся классическая механика, равновесная термодинамика, классическая электродинамика ( координата, импульс, поле, заряд, давление, температура).
Вторую группу представляют статистическая механика (молекулярно-кинетическая теория), квантовая механика ( вероятности распределения, волновая функция).
Слайд 26*
3. Хаос и порядок в природе.
В 1845-47 гг. получил обоснование
закон сохранения количества энергии при взаимопревращениях ее видов в изолированных
системах – всеобщий закон природы – первое начало термодинамики.Через 20 лет ученые обнаружили знаменитую тень энергии – энтропию – меру рассеяния (диссипации) энергии. Р.Клаузиус, У.Томсон и др. сформулировали закон возрастания энтропии – второе начало термодинамики. Распространение этого закона на всю Вселенную привело к ошибочной теории «тепловой смерти Вселенной».
Слайд 27*
3. Хаос и порядок в природе.
Ограниченность действия закона возрастания энтропии
и его статистический характер были доказаны Л.Больцманом в 1872г.
Теплота есть
энергия беспорядочного хаотического движения вещества.Этот закон справедлив лишь для статистических систем, состоящих из большого числа хаотически движущихся объектов, поведение которых подчиняется законам теории вероятностей и определяется изменением параметров состояния.
Разбилась посуда, стерлись покрышки, сгорели дрова, исчезли знания – энтропия увеличилась и становится максимальной при наступлении полного беспорядка (хаоса), т.е. при отсутствии каких-либо закономерностей.
Слайд 28*
3. Хаос и порядок в природе.
В 1878 г. Больцман применил
понятие вероятности, введенное Максвеллом и показал, что II начало ТД
также является следствием статистических законов.С понижением температуры упорядоченность макросистем растет – газ превращается в более упорядоченную систему частиц – жидкость, а она в еще более упорядоченную – твердое тело. Соответственно уменьшается величина энтропии. Это и составляет суть тепловой теоремы Нернста – третьего начала термодинамики.
Эти три закона вместе с молекулярно-кинетической теорией составили основу термодинамики, сформировавшейся в конце 19 в. как теория теплового двигателя.
Слайд 29*
3. Хаос и порядок в природе.
Особенность тепловой энергии состоит в
том, что она является энергией неупорядоченного, хаотического движения мельчайших частиц
тела, в то время как все другие виды энергии – результат упорядоченного движения.Порядок всегда проще превратить в хаос, упорядочить же хаос гораздо труднее.
С развитием статистической физики и термодинамики на место причинных динамических законов становятся статистические законы, позволяющие предвидеть не с абсолютной достоверностью, а лишь с большой степенью вероятности.
Слайд 30*
3. Хаос и порядок в природе.
Точка зрения Больцмана означала, что
необратимое возрастание энтропии в изолированной системе следует рассматривать как проявление
все увеличивающегося хаоса, постепенного забывания начальной асимметрии, ибо она приводит к уменьшению термодинамической вероятности W. (s = ln w)В состоянии теплового равновесия энтропия достигает своего максимума. Возрастание энтропии в необратимых процессах есть «стрела времени». Для изолированной системы будущее всегда расположено в направлении возрастания энтропии. Энтропия же возрастает по мере увеличения хаоса в системе.
Слайд 31*
3. Хаос и порядок в природе.
С возникновением ТД в физике
сложилась щекотливая ситуация: законы Ньютоновской классической механики являются обратимыми (демон
Лапласа), а II начало термодинамики указывает на то, что вследствие необратимого характера процессов в ТД системах, они не могут быть управляемы до конца.(демон Максвелла).Мечта Л.Больцмана – объединить динамику и термодинамику не сбылась в полной мере.
Слайд 32*
4. Начала термодинамики.
Само название «термодинамика» указывает на происхождение этой науки,
занимавшейся первоначально изучением теплоты; в дальнейшем она включила в себя
изучение превращений энергии во всех ее формах.Термодинамика основана на небольшом числе утверждений, которые в сжатой форме включают в себя огромный опыт человечества по изучению свойств энергии в процессах ее превращений. Эти утверждения носят название законов (или начал) термодинамики.
Всего насчитывается четыре закона, или начала, термодинамики. Первым было установлено второе начало, последним – нулевое начало.
Слайд 33*
4. Начала термодинамики.
Нулевое начало термодинамики, сформулированное всего около 60 лет
назад, по существу представляет собой полученное “ задним числом” логическое
оправдание для введения понятия температуры физических тел. Пока достаточно считать, что температура – это просто уточнение и количественное выражение понятия « степени нагретости».Первое начало термодинамики обычно формулируется так: «Энергия сохраняется». Тот факт, что сохраняется именно энергия, а не теплота, стал основополагающим открытием 50-х годов XIX столетия, которым мы обязаны Кельвину и Клаузиусу.
Слайд 34*
4. Начала термодинамики.
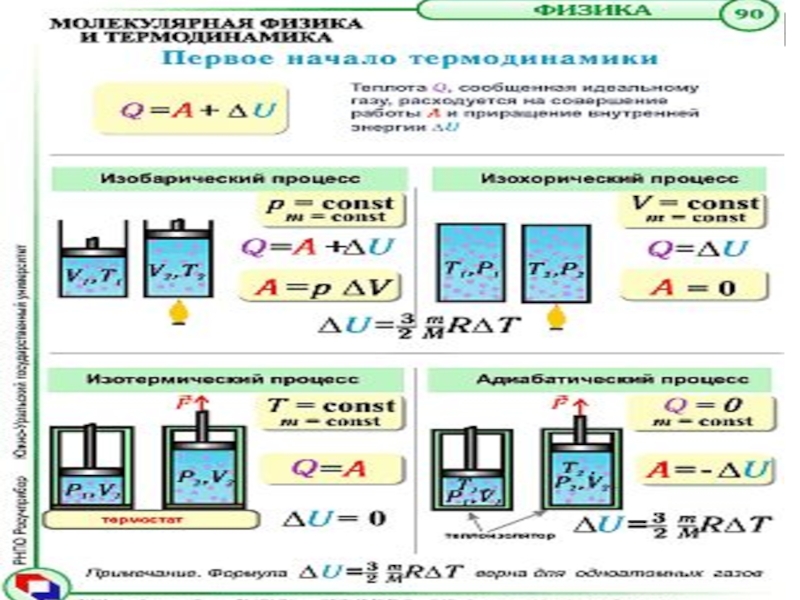
Первое начало термодинамики – это закон сохранения энергии,
написанный в виде, удобном для определения механической работы, полученной из
тепла. Теплоту можно преобразовать в работу.Количество теплоты ΔQ, сообщенное телу, идет на увеличение его внутренней энергии ΔU и на совершение работы ΔA, т.е.
ΔQ = ΔU + ΔA
Всякая термодинамическая система в любом состоянии обладает внутренней энергией – энергией теплового движения молекул и потенциальной энергией их взаимодействия.
Слайд 35*
4. Начала термодинамики.
Первое начало термодинамики - это закон сохранения энергии
для систем, в которых существенную роль играют тепловые процессы. Важнейшей
характеристикой такой системы является ее внутренняя энергия. Внутренняя энергия термодинамической системы U - это энергия физической системы, зависящая от ее внутреннего состояния. Внутренняя энергия включает в себя энергию хаотического (теплового) движения всех микрочастиц системы и энергию взаимодействия этих частиц между собой. Во внутреннюю энергию не входит кинетическая энергия движения системы как целого и ее потенциальная энергия во внешних полях. Внутренняя энергия - функция состояния системы, т.е. величина внутренней энергии не зависит от процесса перехода системы в данное состояние, а определяется значением параметров состояния.Слайд 36*
4. Начала термодинамики.
Из I-го начала термодинамики следует важный вывод: невозможен
вечный двигатель первого рода, т.е. двигатель, который совершал бы работу
из «ничего», без внешнего источника энергии.Второе начало термодинамики устанавливает наличие в природе фундаментальной асимметрии, т.е. однонаправленности всех происходящих в ней самопроизвольных процессов.
Невозможен переход теплоты от тела менее нагретого к телу более нагретому, без каких-либо других изменений в системе или окружающей среде.
Теплоту можно преобразовать в работу полностью лишь при абсолютном нуле температур.
Невозможно совершить работу за счет энергии тел, находящихся в термодинамическом равновесии.
Слайд 37*
4. Начала термодинамики.
В современной термодинамике второе начало формулируется как закон
возрастания энтропии. Понятие энтропии можно четко и ясно сформулировать в
рамках статистической термодинамики, где энтропия S определяется как величина, пропорциональная натуральному логарифму числа квантовых состояний Ω , доступных для системы:S = k ln Ω
здесь k = 1,38 · 10-23 Дж/К - постоянная Больцмана.
В классической механике нет аналога квантового состояния, поэтому возникает вопрос, что же именно мы должны подсчитать, как найти величину Ω - число квантовых состояний?
Слайд 38*
4. Начала термодинамики.
Термодинамическая система - это совокупность макроскопических тел, которые
могут взаимодействовать между собой и с другими телами (внешней средой)
- обмениваться с ними энергией и веществом. В частности, термодинамическая система может состоять из одного макроскопического тела.В некоторых отношениях простейшим макроскопическим телом является идеальный газ, на примере которого мы будем иллюстрировать понятия и законы термодинамики.
Состояние термодинамической системы характеризуют макроскопическими параметрами состояния: давлением, температурой, объемом, плотностью и т.д. Например, для заданной массы идеального газа параметрами состояния являются три величины: P, V, T.
Слайд 39*
4. Начала термодинамики.
Равновесное состояние - это такое состояние системы, в
которое она самопроизвольно переходит через достаточно большой промежуток времени (время
релаксации) в условиях изоляции от окружающей среды. В равновесном состоянии параметры системы имеют определенные значения и не меняются со временем.Термодинамическим процессом называется всякое изменение во времени хотя бы одного из параметров состояния системы.
Слайд 40*
4. Начала термодинамики.
Равновесным термодинамическим процессом называют процесс, состоящий из непрерывной
последовательности равновесных состояний. Строго равновесным может быть только бесконечно медленный
процесс. Равновесный процесс является обратимым, т.к. он может быть осуществлен в обратном направлении через те же промежуточные состояния и без каких-либо изменений в окружающих телах.Классическая термодинамика дает полное количественное описание только равновесных процессов. Термодинамика неравновесных процессов занимается изучением количественных закономерностей в неравновесных процессах для состояний, не сильно отличающихся от равновесных.
Слайд 41*
Коэффициент полезного
действия теплового движителя
К.П.Д. тепловой машины, работающей по циклу Карно
возрастание
энтропии равно количеству теплоты, сообщенной телу при квазистатическом процессе, деленному
на абсолютную температуру.Для идеального механического процесса без трения (обратимый) и для живых организмов
Во всех необратимых процессах
Слайд 42*
4. Начала термодинамики.
Двигатель, работающий только за счет энергии находящихся в
тепловом равновесии тел, был бы на практике вечным двигателем. II-ое
начало исключает возможность создания такого вечного двигателя второго рода.Третье начало термодинамики касается свойств веществ при очень низких температурах. Оно утверждает невозможность охлаждения вещества до температуры абсолютного нуля посредством конечного числа шагов.
Третье начало вполне можно считать одним из «настоящих» законов термодинамики, поскольку оно очевидным образом предполагает атомное строение вещества, тогда как другие законы представляют собой лишь обобщение непосредственного опыта и не зависят ни от каких предположений подобного рода.
Слайд 43*
4. Начала термодинамики.
Таким образом, между третьим началом термодинамики и остальными
ее законами обнаруживается существенное различие, причем даже логическое обоснование третьего
начала выглядит не столь надежным, как остальных законов.Достоинством и недостатком термодинамического метода, одновременно, является независимость от принятого взгляда на строение вещества. С помощью термодинамики можно решать многие важные задачи, вовсе не касаясь вопросов строения вещества.
Слайд 50*
5. Синергетика.
Научному мировоззрению XIX века было присуще исследование закрытых систем,
что привело к разработке статистической механики и равновесной термодинамики.
В XX
в. наука исходит из того, что все системы любого порядка являются открытыми. Такие представления легли в основу теории самоорганизации или синергетики (неравновесная термодинамика).В понятии самоорганизации отражается общая тенденция развития Природы: от менее к более сложному.
Слайд 51*
Синергетика.
Синергетика – новое направление в познании человеком природы, общества и
самого себя, смысла своего существования. Новое качество в познании достигается
за счет использования нелинейного мышления и синтеза достижений различных наук при конструировании образа мировоззрения. По определению Философского словаря, синергетика – это область научного знания, в которой посредством междисциплинарных исследований выявляются общие закономерности самоорганизации, становление устойчивых структур в открытых системах.Слайд 52*
Синергетика.
Понятие самоорганизации выражает способность сложных систем к упорядочению своей внутренней
структуры и переходу от менее сложных к более сложным формам
организации вещества.Самоорганизация в сложных и динамичных открытых системах возможна лишь при наличии достаточно большого числа взаимодействующих элементов.
Понятие «простой» и «сложный» всегда относительные, их смысл выявляется только при сопоставлении свойств родственных объектов.
Слайд 53Синергетика.
Автором термина «Синергетика» является Ричард Бакминстер Фуллер — известный дизайнер,
архитектор и изобретатель из США.
Ч. Шеррингтон называл синергетическим, или интегративным,
согласованное воздействие нервной системы (спинного мозга) при управлении мышечными движениями.С. Улам, много работавший с ЭВМ, в 1964 году в своей книге «Нерешенные математические задачи» высоко оценил синергию — непрерывное сотрудничество между машиной и её оператором, осуществляемое за счёт вывода информации на дисплей.
*
Слайд 54Синергетика.
Область исследований синергетики чётко не определена и вряд ли может
быть ограничена, так как её интересы распространяются на все отрасли
естествознания. Общим признаком является рассмотрение динамики любых необратимых процессов и возникновения принципиальных новаций.*
Слайд 55Синергетика.
Математический аппарат синергетики скомбинирован из разных отраслей теоретической физики: нелинейной
неравновесной термодинамики, теории катастроф, теории групп, тензорного анализа, дифференциальной топологии,
неравновесной статистической физики*
Слайд 59*
Синергетика.
И лишь сравнительно недавно стало ясно, что тенденция к созиданию,
к переходу от менее упорядоченного состояния к более упорядоченному, то
есть самоорганизация, присуща неживой природе в той же мере, что и живой, нужны лишь подходящие условия для ее проявления.Слайд 60*
Синергетика.
Идеи самоорганизации высказывались еще в традиционной классической науке XVIII-XIX веках.
Эти идеи отражаются в космической гипотезе Канта-Лапласа, рыночной экономической теории
Смита, эволюционной теории Дарвина, теории Максвелла-Больцмана, описывающей поведение термодинамических систем и т.д.Слайд 61*
Синергетика.
Важнейшее свойство самоорганизующихся систем – открытость.
Открытые системы – это
системы необратимые, в них важным оказывается фактор времени.
Большинство систем Вселенной
носит открытый характер, а это значит, что во Вселенной доминируют не стабильность и равновесие, а неустойчивость и неравновесность. Слайд 62*
Синергетика.
Другое важнейшее свойство самоорганизующихся систем – нелинейность. Процессы, происходящие в
нелинейных системах, часто носят пороговый характер — при плавном изменении
внешних условий поведение системы изменяется скачком. Скачок – это крайне нелинейный процесс, при котором малые изменения параметров системы (обычно они называются управляющими параметрами) вызывают очень сильные изменения состояния системы, её переход в новое качество.Слайд 63*
Синергетика.
Механизм самоорганизации по И. Пригожину выглядит следующим образом:
Состояние системы в любой момент времени можно представить
как точку в некотором воображаемом пространстве, где параметры (характеристики системы) будут играть роль координат. Такое пространство называют фазовым. В результате обмена веществом, энергией и информацией с другими системами, а также случайных малых отклонений от равновесия (флуктуаций) с течением времени параметры системы изменяются, происходит смена состояний, точка перемещается внутри фазового пространства и описывает так называемую фазовую траекторию (пересекающиеся кривые, спирали, замкнутые линии с общим центром)Слайд 64*
а — устойчивый узел;
b — неустойчивый узел; с —
устойчивый фокус;
d — неустойчивый фокус;
е — седло;
f— центр.Рис.1 Фазовые траектории в окрестностях особых точек.
Слайд 65*
Синергетика.
В ходе эволюционного этапа развития диссипативная система достигает состояния сильной
неравновесности и теряет устойчивость. Это критическое состояние называется точкой бифуркации,
т.е. точкой, в которой возможно множество вариантов дальнейшего развития системы.Точки бифуркаций – это также особые физические точки – точки равновесия, которое может быть как устойчивым, так и неустойчивым. Для синергетики интерес представляют именно неустойчивые состояния, т.к. они дают возможность перехода системы в новое качественное состояние, новый режим, которому будет отвечать новый тип поведения системы
Слайд 66*
Синергетика.
Та траектория или направление, которое отличается от других относительной устойчивостью,
иными словами, является более реальным, называется аттрактором. Аттрактор (от лат.-притягивать)
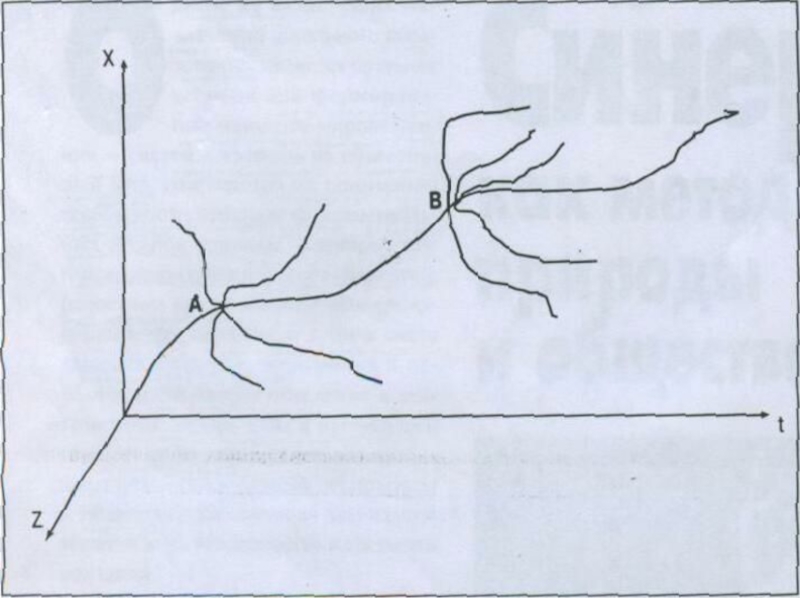
– это относительно устойчивое состояние системы, притягивающее к себе множество «линий» развития возможных бифуркаций. Наглядно это можно представить в виде конуса бытовой воронки, направляющего движения частиц жидкости и сыпучих тел (например, песка) к своему центру (вершине конуса – горловине воронки) независимо от первоначальных траекторий. Пространство внутри конуса воронки (аттрактора), где любая частица (система) туда попавшая постепенно смещается в заданном направлении, называют «зоной аттрактора».Слайд 67*
Синергетика.
Различают несколько разновидностей аттрактора, среди которых следует выделить так называемый
«странный аттрактор». При состояниях системы, характеризуемых странным аттрактором, становится невозможным
определить поведение частиц в каждый данный момент, хотя мы уверены, что они находятся в зоне аттрактора.Слайд 68
Странный аттрактор — это аттрактор, не являющийся регулярным.
Динамика на странных
аттракторах часто бывает хаотической: прогнозирование траектории, попавшей в аттрактор, затруднено,
поскольку малая неточность в начальных данных через некоторое время может привести к сильному расхождению прогноза с реальной траекторией.*
Слайд 69Синергетика.
Это явление также называют эффектом бабочки, подразумевая возможность преобразования слабых
турбулентных потоков воздуха, вызванных взмахом крыльев бабочки в одной точке
планеты в мощное торнадо на другой её стороне вследствие многократного их усиления в атмосфере за некоторое время.*
Слайд 71Синергетика.
Аттракторы классифицируют по:
Формализации понятия стремления: различают максимальный аттрактор, неблуждающее множество,
аттрактор Милнора, центр Биркгофа, статистический и минимальный аттрактор.
Регулярности самого аттрактора:
аттракторы делят на регулярные (притягивающая неподвижная точка, притягивающая периодическая траектория, многообразие) и странные (нерегулярные — зачастую фрактальные )Локальности и глобальности
*
Слайд 72*
Синергетика.
В точке бифуркации система как бы «колеблется» перед выбором того
или иного пути развития. При этом принципиально неизвестно, в каком
именно направлении это развитие пойдет. Однако спрогнозировать будущее открытой неравновесной системы оказывается невозможным. В таких случаях чрезвычайно важны случайные флуктуации.Слайд 74*
С ростом сложности системы растет и вероятность увеличения числа возможных
путей развития, т.е. дивергенции, а вероятность появления двух развивающихся систем
в одном и том же канале эволюции практически равна нулю. Это и означает, что процесс самоорганизации ведет к непрерывному росту числа организационных форм.Описанный механизм самоорганизации (по Пригожину – «порядок через флуктуацию») реализуется абсолютно во всех системах – от атомов до галактик, от отдельных клеток до человеческих существ и вплоть до обществ и культур.
Слайд 75*
. В 1927 году бельгийским ученным Ж. Леметром было введено
понятие сингулярности как исходного состояния Вселенной. Ж. Леметр предположил, что
первоначальный радиус Вселенной по размерам был близок к электрону, и она имела бесконечную плотность (10 96 г/см3). В 1965 году С. Хокинг математически обосновал необходимость сингулярности в любой модели расширяющейся Вселенной. Известные законы физики в сингулярности не работают.Слайд 76*
Синергетика.
Самоорганизующиеся системы должны отвечать требованиям:
Быть неравновесными, т.е. находиться далеко от
термодинамического равновесия;
Быть открытыми, т.е. обладать способностью обмениваться веществом, энергией и
информацией.Наличие флуктуации, т.е. небольших отклонений, которые формируют нарастающие структуры;
Нарушение симметрии;
Определенное достаточное количество взаимодействующих элементов;
Наличие положительной обратной связи.
Слайд 77*
Синергетика.
Развитие теории самоорганизации идет по нескольким направлениям: синергетика (Г.Хакен), неравновесная
термодинамика (И.Пригожин) и др.
Основные идей теории самоорганизации:
Процессы эволюции и деградации
равноправны;Процессы созидания или структурирования имеют единый алгоритм независимо от Природы;
Эволюция большинства сложных систем носит нелинейный характер.
Слайд 79*
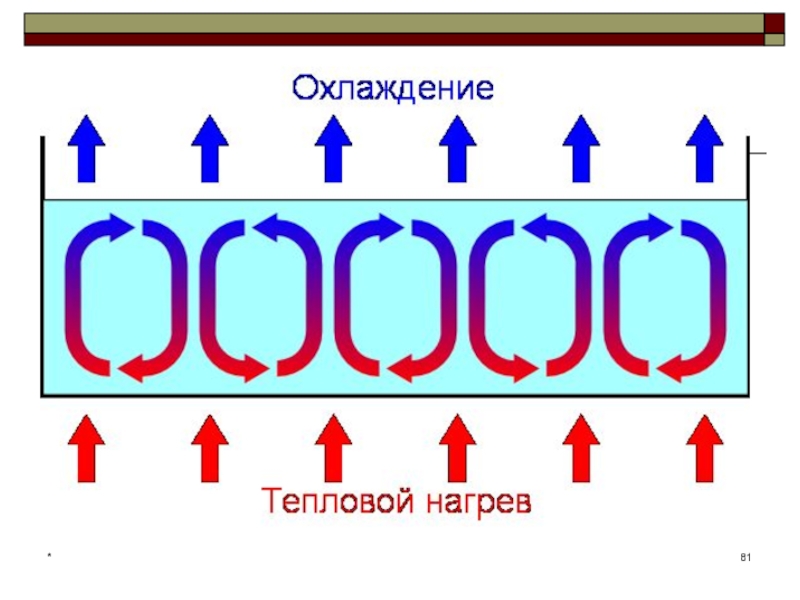
Ячейка Бенара – конвективная неустойчивость
Явления конвективной неустойчивости
в гидродинамике описываются общими
законами синергетики, так как
здесь существуют нелинейные зависимости и принекоторых значениях определенных параметров из хаотического движения жидкости
возникают пространственно - временные периодические структуры
(самоорганизация), которые образуются в результате нестационарных конвективных течений.
Слайд 80Ячейка Бенара – конвективная неустойчивость
Ячейки Бенара или Рэлея — Бенара
— возникновение упорядоченности в виде конвективных ячеек в форме цилиндрических
валов или правильных шестигранных структур в слое вязкой жидкости с вертикальным градиентом температуры, то есть равномерно подогреваемой снизу.Ячейки Рэлея — Бенара являются одним из трёх стандартных примеров самоорганизации, наряду с лазером и реакцией Белоусова — Жаботинского.
*
Слайд 84*
С мировоззренческой точки зрения синергетику иногда позиционируют, как «глобальный эволюционизм»
или «универсальную теорию эволюции», дающую единую основу для описания механизмов
возникновения любых новаций подобно тому, как некогда кибернетика определялась, как «универсальная теория управления», одинаково пригодная для описания любых операций регулирования и оптимизации: в природе, в технике, в обществе и т. п. и т. д. Время показало, что всеобщий кибернетический подход оправдал далеко не все возлагавшиеся на него надежды. Аналогично и расширительное толкование применимости методов синергетики подвергается критике.Слайд 87*
Основное понятие синергетики — определение структуры как состояния, возникающего в
результате многовариантного и неоднозначного поведения таких многоэлементных структур или многофакторных
сред, которые не деградируют к стандартному для замкнутых систем усреднению термодинамического типа, а развиваются вследствие открытости, притока энергии извне, нелинейности внутренних процессов, появления особых особых режимов обострения и наличия более одного устойчивого состояния. В означенных системах не выполняется ни второе начало термодинамики, ни теорема Пригожина о минимуме скорости производства энтропии, что может привести к образованию новых структур и систем, в том числе и более сложных, чем исходные,Слайд 88*
Этот феномен трактуется синергетикой как всеобщий механизм повсеместно наблюдаемого в
природе направления эволюции : от элементарного и примитивного — к
сложносоставному и более совершенному.В отдельных случаях образование новых структур имеет регулярный, волновой характер и тогда они называются автоволновыми процессами (по аналогии с автоколебаниями ). – Реакция Белоусова –Жаботинского – химические часы.
Слайд 89
Реакция Белоусова—Жаботинского — класс химических реакций, протекающих в колебательном режиме,
при котором некоторые параметры реакции (цвет, концентрация компонентов, температура и
др.) изменяются периодически, образуя сложную пространственно-временную структуру реакционной среды.*
Слайд 92Синергетика.
Наблюдаются случаи использования терминологии синергетики для придания веса псевдонаучным изысканиям.
Некоторые учёные стали представлять себе и широкой общественности синергетику как
«панацею», решающую коренные вопросы во всех науках, в том числе — в гуманитарных, при этом зачастую на фоне некритического отвержения классических и апробированных подходов и теорий.*