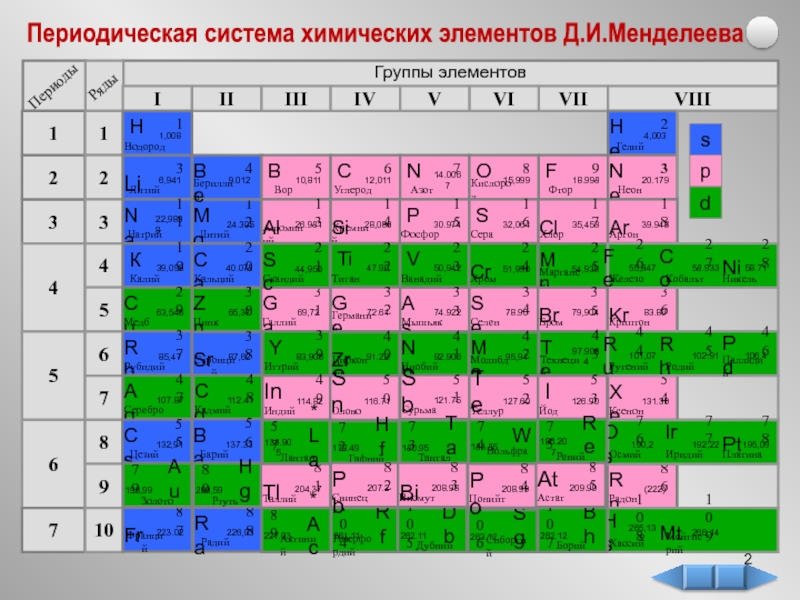
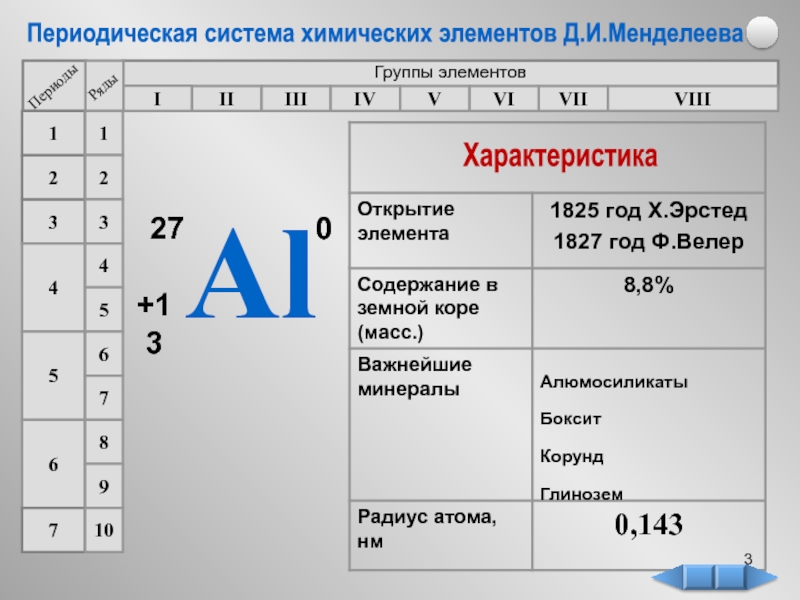
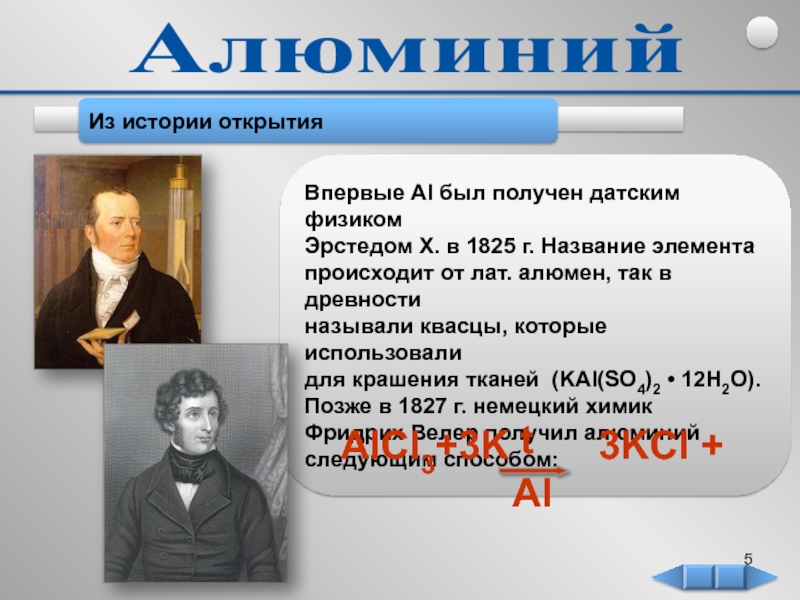
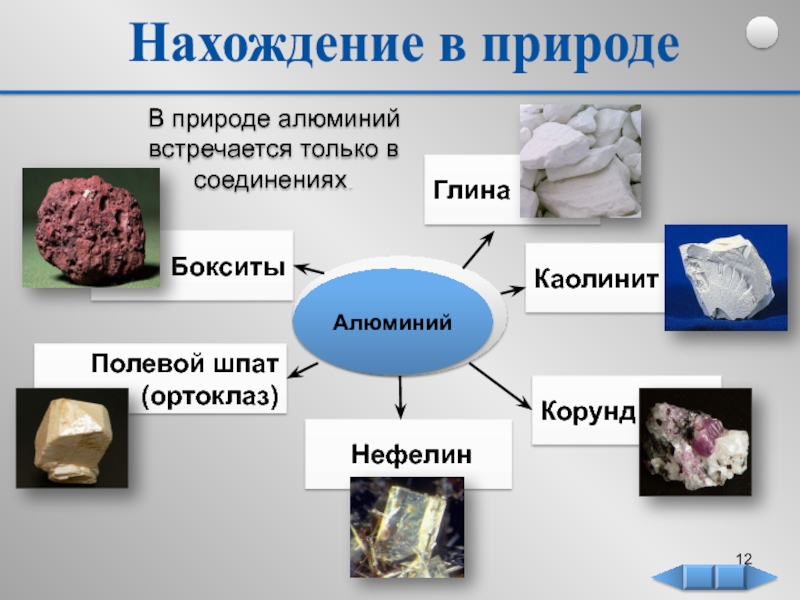
в 1825 г. Название элемента
происходит от лат. алюмен, так
в древности называли квасцы, которые использовали
для крашения тканей (KAl(SO4)2 • 12H2O).
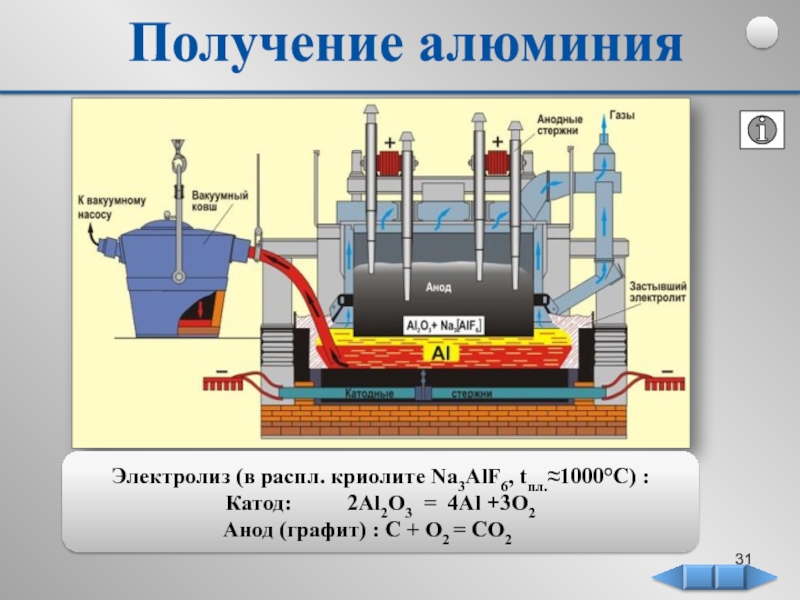
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
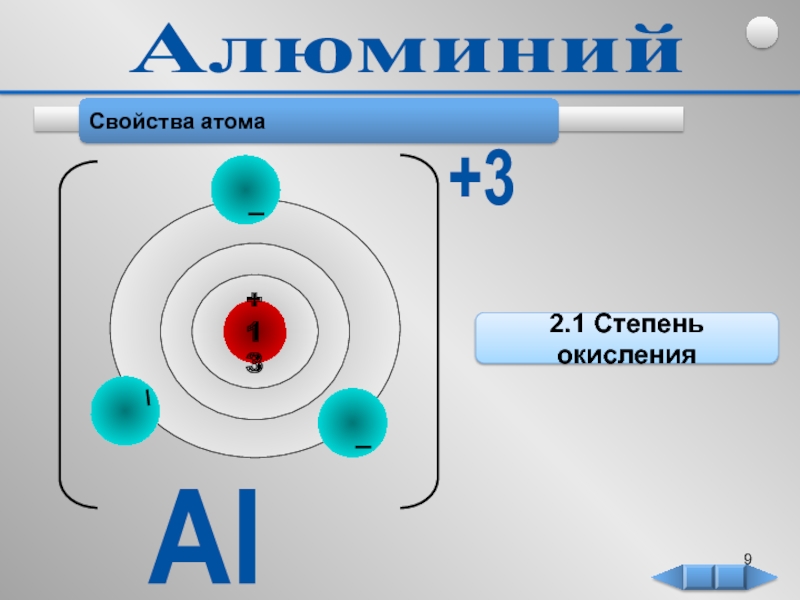
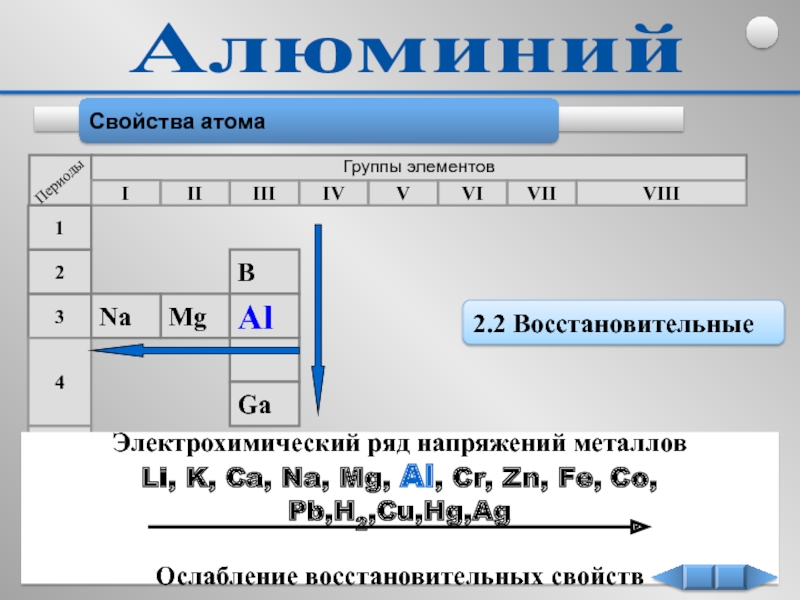
Алюминий




















![1
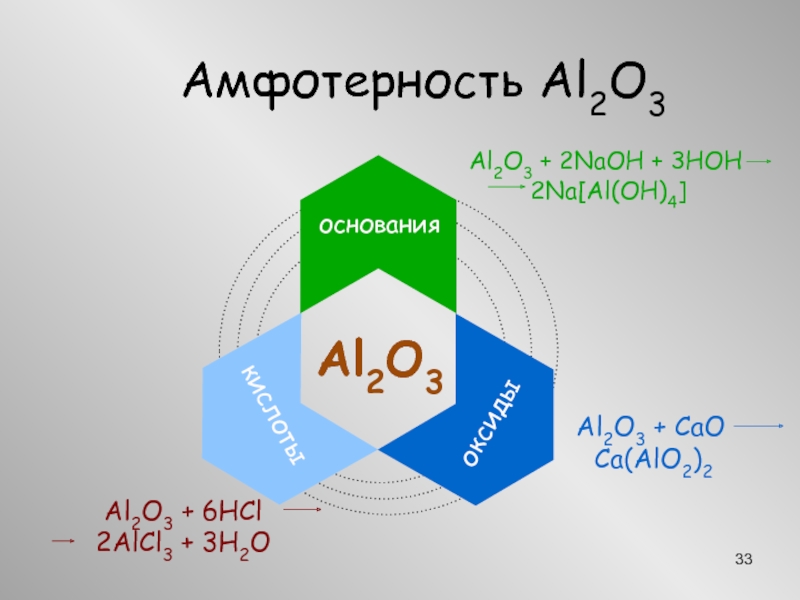
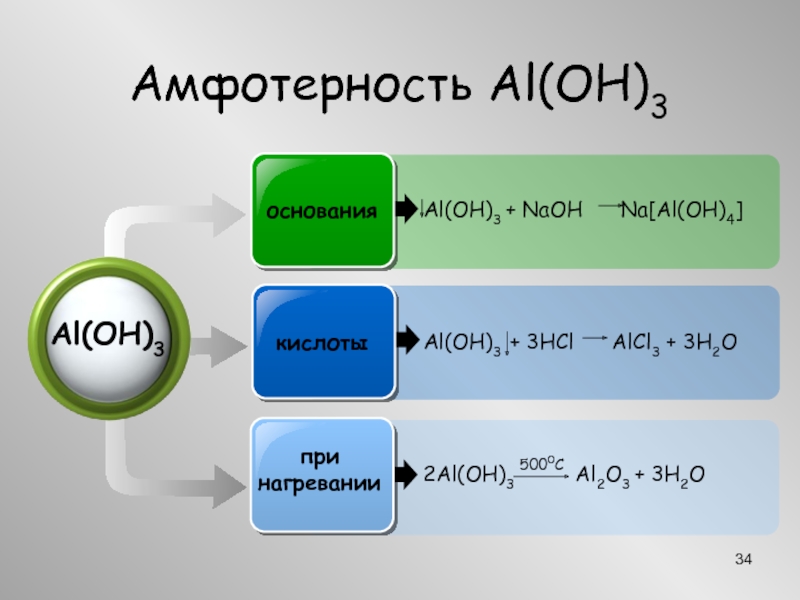
Алюминий АмфотерностьВ расплаве щелочи2Al + 2NaOH + 6HOН 2Na[Al(OН)4] + 3H2В АмфотерностьВ расплаве щелочи2Al + 2NaOH + 6HOН 2Na[Al(OН)4] + 3H2В расплаве2Al + 2NaOH + 2H2O](/img/thumbs/0110d73537a043c577d2506f5f96d467-800x.jpg)



![1
Алюминий ЗакреплениеAlAl2O3AlCl3Na[Al(OH)4]Al(OH)31357248 ЗакреплениеAlAl2O3AlCl3Na[Al(OH)4]Al(OH)31357248](/img/thumbs/8d0a9705be23febd9192a9ddda2b7252-800x.jpg)