Слайд 1Гидрирование полинитросоединений на
1 % платиновом катализаторе
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ВОЛЖСКИЙ ПОЛИТЕХНИЧЕСКИЙ
ИНСТИТУТ (ФИЛИАЛ)
ФЕДЕРАЛЬНОГО ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО ОБРАЗОВАТЕЛЬНОГО
УЧРЕЖДЕНИЯ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
КАФЕДРА "ХИМИЯ И ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ"
Выполнил: студент гр. ВХТ-401
Костенко Н.В.
Научный руководитель: Курунина Г. М.
Волжский, 2013
Слайд 2Исследование реакции гидрирования полинитросоединений на 1% платиновом катализаторе, нанесенном на
оксид самария.
Научная новизна
Впервые были гидрированы полинитросоединения на платиновом катализаторе, нанесенном
на оксид самария. В качестве растворителя использовали этиловый спирт.
Гидрирование проводится в мягких условиях (t = 25ºC, P = 1 атм.).
Цель работы
Слайд 3Задачи работы
Проанализировать литературные и патентные данные.
Изучить физические и химические свойства
полинитросоединений и полиаминосоединений.
Провести термодинамический расчет реакции.
Осуществить гидрирование полинитросоединений на
1%Pt/Sm2O3.
Провести расчет материального и теплового баланса.
Выбрать реактор для проведения процесса гидрирования.
Разработать операторную схему гидрирования полинитросоединений.
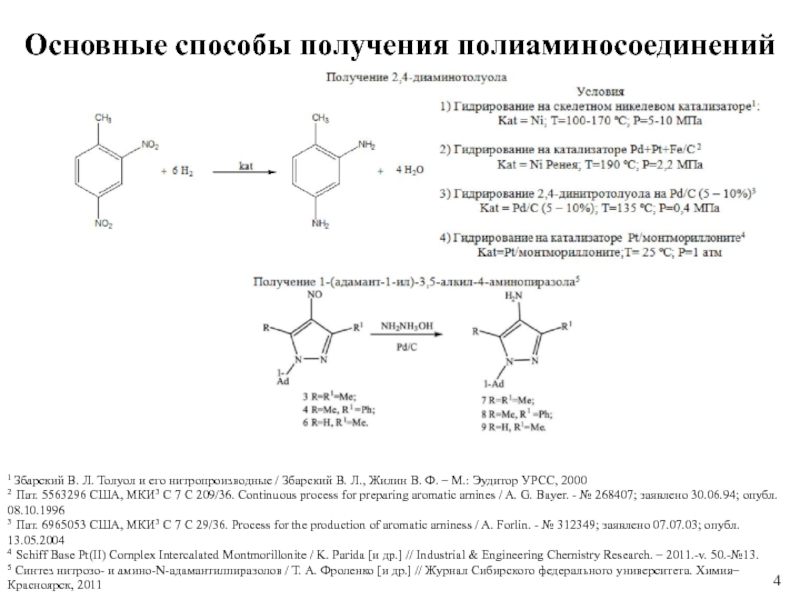
Слайд 4Основные способы получения полиаминосоединений
1 Збарский В. Л. Толуол и его
нитропроизводные / Збарский В. Л., Жилин В. Ф. – М.:
Эудитор УРСС, 2000
2 Пат. 5563296 США, МКИ3 C 7 C 209/36. Continuous process for preparing aromatic amines / A. G. Bayer. - № 268407; заявлено 30.06.94; опубл. 08.10.1996
3 Пат. 6965053 США, МКИ3 C 7 C 29/36. Process for the production of aromatic aminess / A. Forlin. - № 312349; заявлено 07.07.03; опубл. 13.05.2004
4 Schiff Base Pt(II) Complex Intercalated Montmorillonite / K. Parida [и др.] // Industrial & Engineering Chemistry Research. – 2011.-v. 50.-№13.
5 Синтез нитрозо- и амино-N-адамантилпиразолов / Т. А. Фроленко [и др.] // Журнал Сибирского федерального университета. Химия– Красноярск, 2011
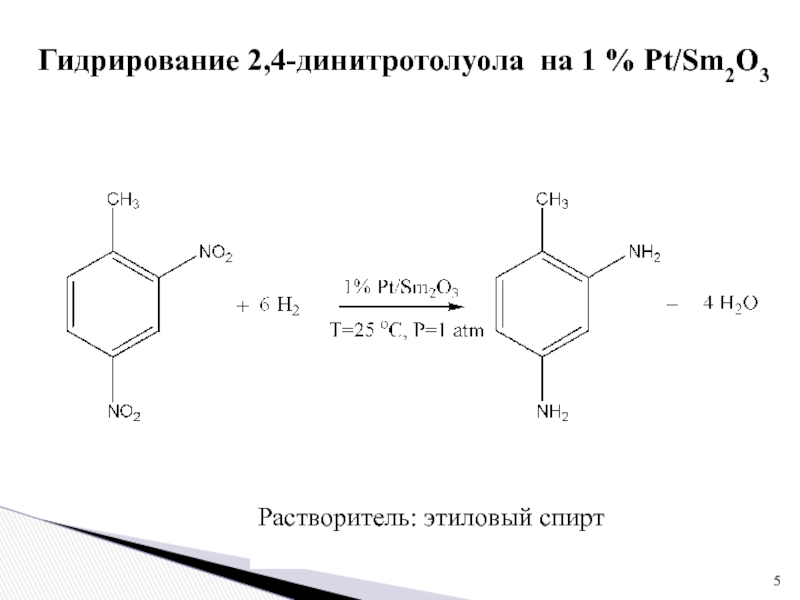
Слайд 5Растворитель: этиловый спирт
Гидрирование 2,4-динитротолуола на 1 % Pt/Sm2O3
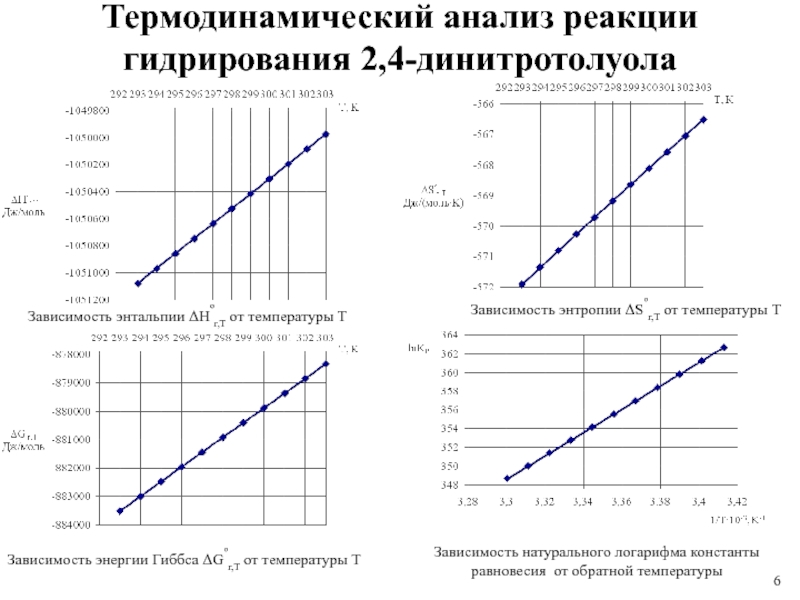
Слайд 6Зависимость энтальпии Hºr,T от температуры T
Зависимость энтропии Sºr,T от температуры
T
Зависимость энергии Гиббса Gºr,T от температуры T
Зависимость натурального логарифма
константы равновесия от обратной температуры
Термодинамический анализ реакции гидрирования 2,4-динитротолуола
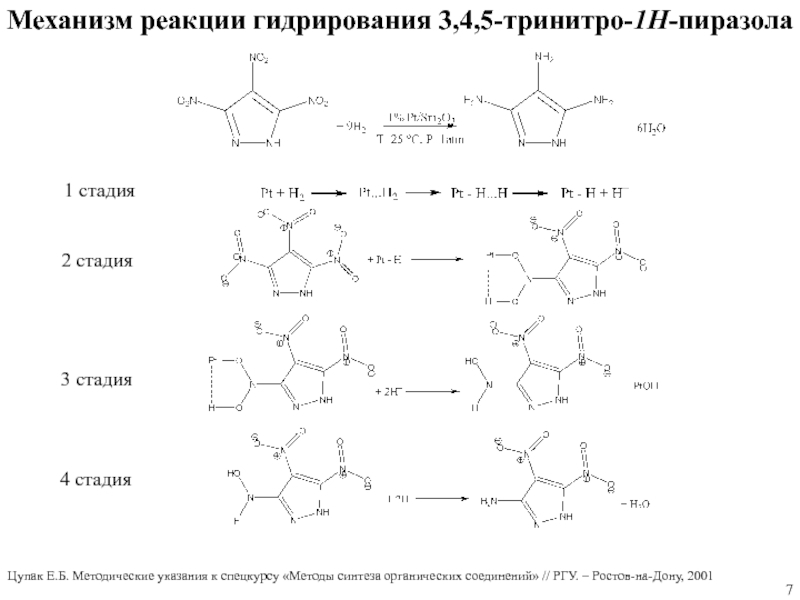
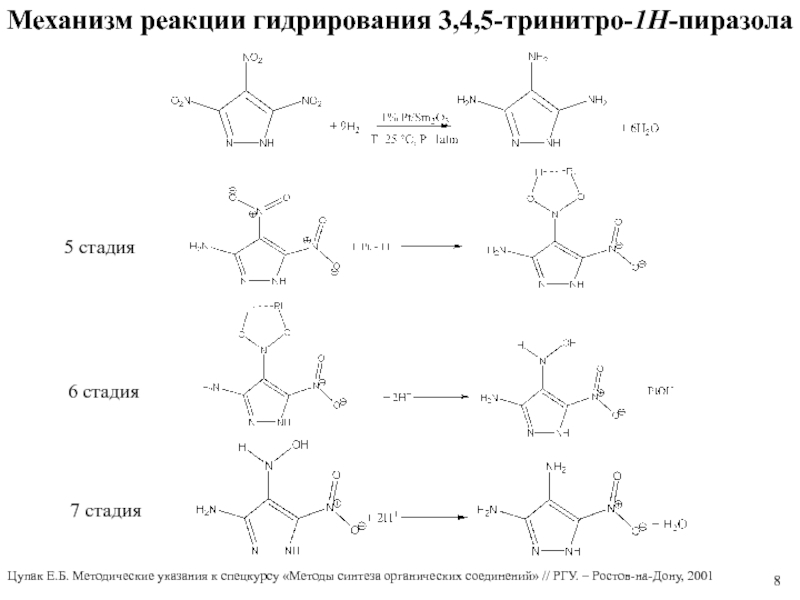
Слайд 7Механизм реакции гидрирования 3,4,5-тринитро-1Н-пиразола
1 стадия
2 стадия
3 стадия
4 стадия
Цупак Е.Б.
Методические указания к спецкурсу «Методы синтеза органических соединений» // РГУ.
– Ростов-на-Дону, 2001
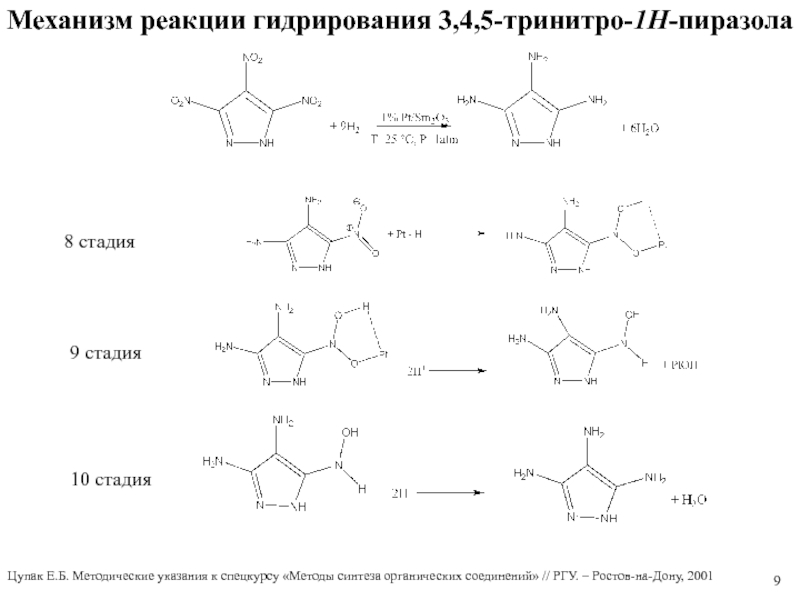
Слайд 8Механизм реакции гидрирования 3,4,5-тринитро-1Н-пиразола
5 стадия
6 стадия
7 стадия
Цупак Е.Б. Методические
указания к спецкурсу «Методы синтеза органических соединений» // РГУ. –
Ростов-на-Дону, 2001
Слайд 9Механизм реакции гидрирования 3,4,5-тринитро-1Н-пиразола
8 стадия
9 стадия
10 стадия
Цупак Е.Б. Методические
указания к спецкурсу «Методы синтеза органических соединений» // РГУ. –
Ростов-на-Дону, 2001
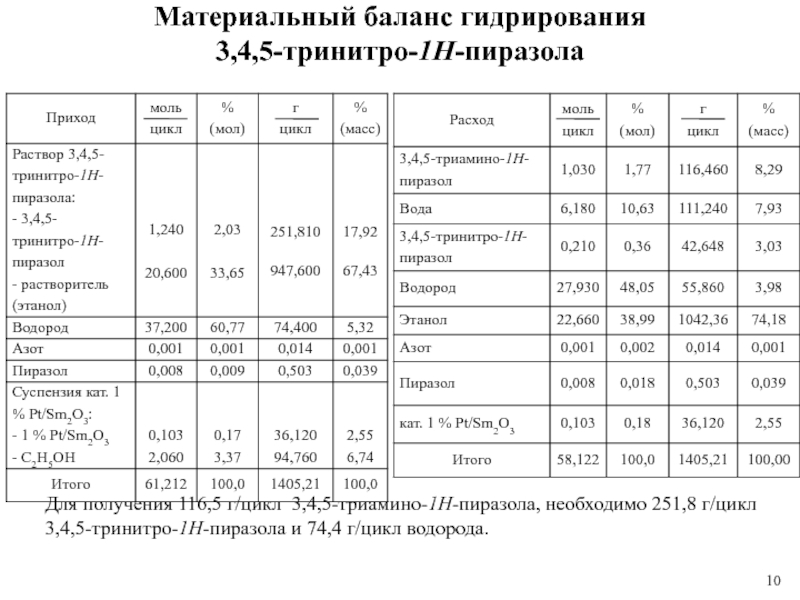
Слайд 10Материальный баланс гидрирования
3,4,5-тринитро-1Н-пиразола
Для получения 116,5 г/цикл 3,4,5-триамино-1Н-пиразола, необходимо 251,8 г/цикл
3,4,5-тринитро-1Н-пиразола и 74,4 г/цикл водорода.
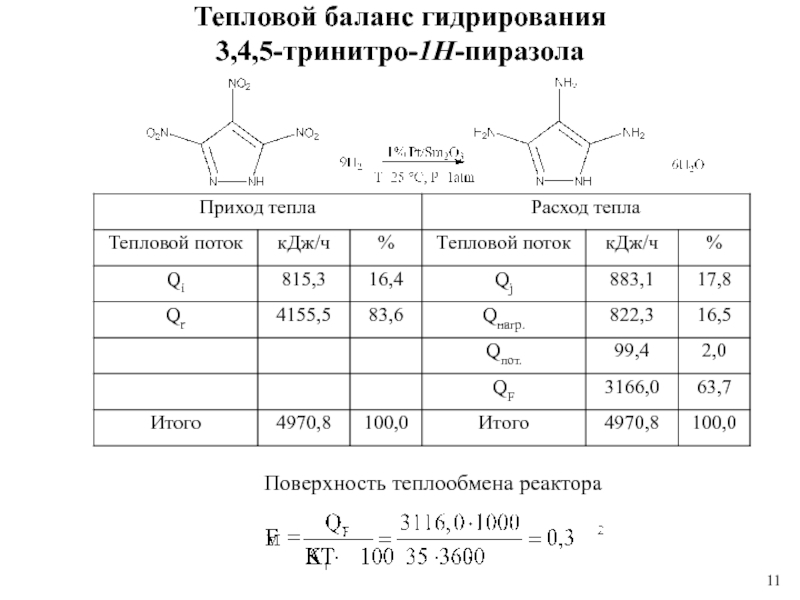
Слайд 11Тепловой баланс гидрирования
3,4,5-тринитро-1Н-пиразола
Поверхность теплообмена реактора
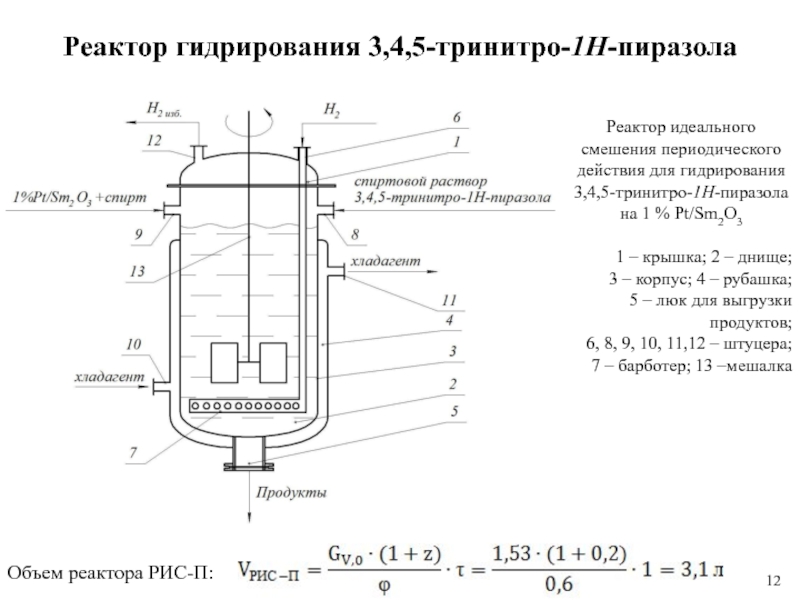
Слайд 12Реактор гидрирования 3,4,5-тринитро-1Н-пиразола
Реактор идеального смешения периодического действия для гидрирования
3,4,5-тринитро-1Н-пиразола
на 1
% Pt/Sm2O3
1 – крышка; 2 – днище;
3 – корпус; 4
– рубашка;
5 – люк для выгрузки продуктов;
6, 8, 9, 10, 11,12 – штуцера;
7 – барботер; 13 –мешалка
Объем реактора РИС-П:
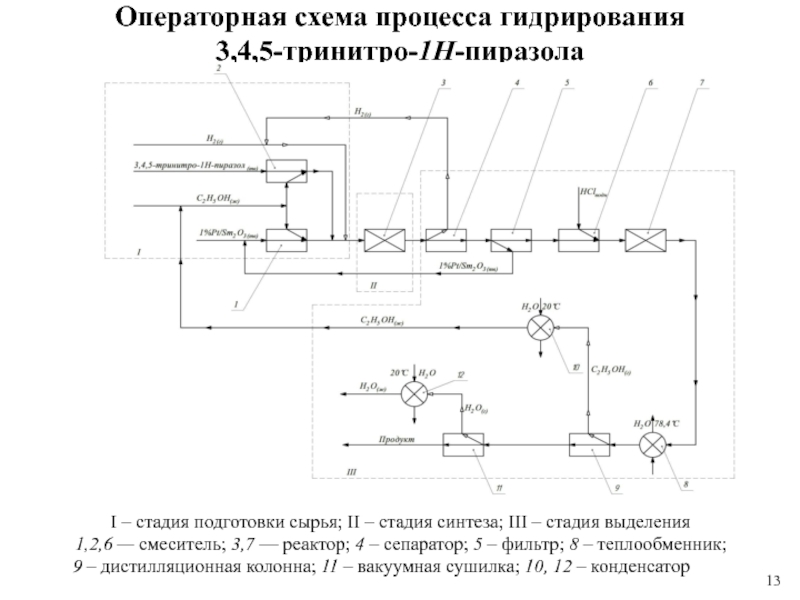
Слайд 13Операторная схема процесса гидрирования
3,4,5-тринитро-1Н-пиразола
I – стадия подготовки сырья; II –
стадия синтеза; III – стадия выделения
1,2,6 — смеситель; 3,7 —
реактор; 4 – сепаратор; 5 – фильтр; 8 – теплообменник; 9 – дистилляционная колонна; 11 – вакуумная сушилка; 10, 12 – конденсатор
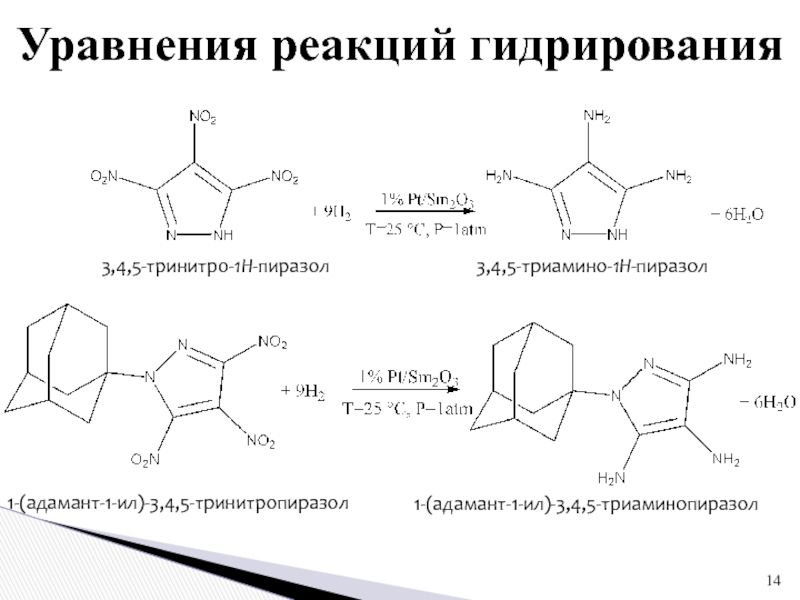
Слайд 14Уравнения реакций гидрирования
3,4,5-тринитро-1Н-пиразол
3,4,5-триамино-1Н-пиразол
1-(адамант-1-ил)-3,4,5-тринитропиразол
1-(адамант-1-ил)-3,4,5-триаминопиразол
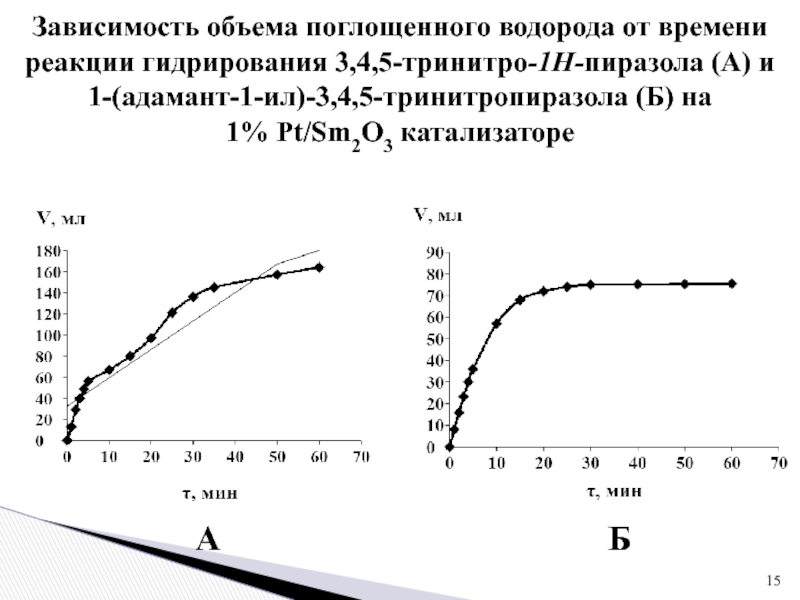
Слайд 15Зависимость объема поглощенного водорода от времени реакции гидрирования 3,4,5-тринитро-1Н-пиразола (А)
и 1-(адамант-1-ил)-3,4,5-тринитропиразола (Б) на
1% Pt/Sm2O3 катализаторе
А
Б
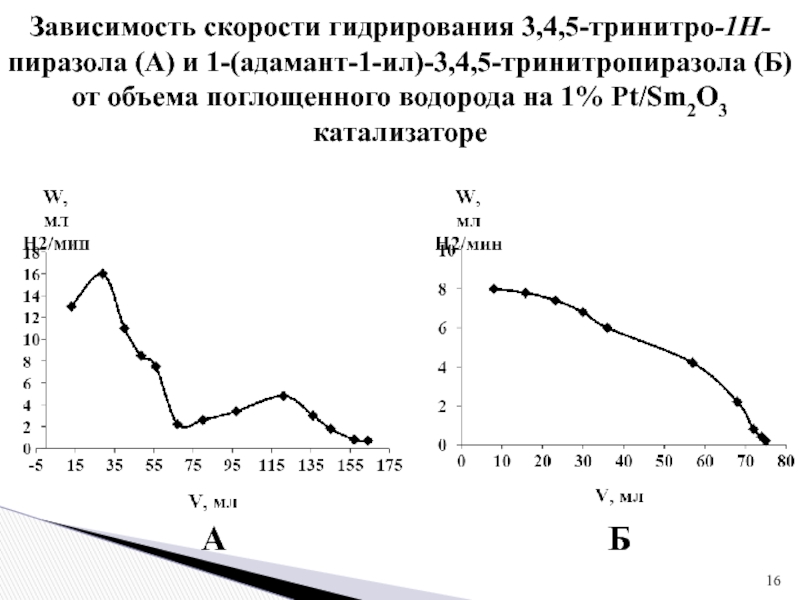
Слайд 16Зависимость скорости гидрирования 3,4,5-тринитро-1Н-пиразола (А) и 1-(адамант-1-ил)-3,4,5-тринитропиразола (Б) от объема
поглощенного водорода на 1% Pt/Sm2O3 катализаторе
А
Б
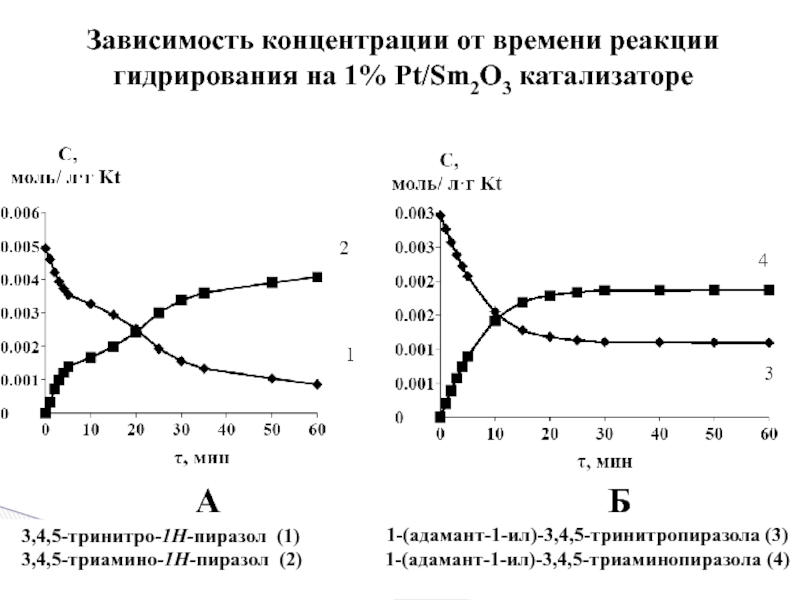
Слайд 17Зависимость концентрации от времени реакции гидрирования на 1% Pt/Sm2O3 катализаторе
А
Б
3,4,5-тринитро-1Н-пиразол (1)
3,4,5-триамино-1Н-пиразол (2)
1-(адамант-1-ил)-3,4,5-тринитропиразола (3)
1-(адамант-1-ил)-3,4,5-триаминопиразола (4)
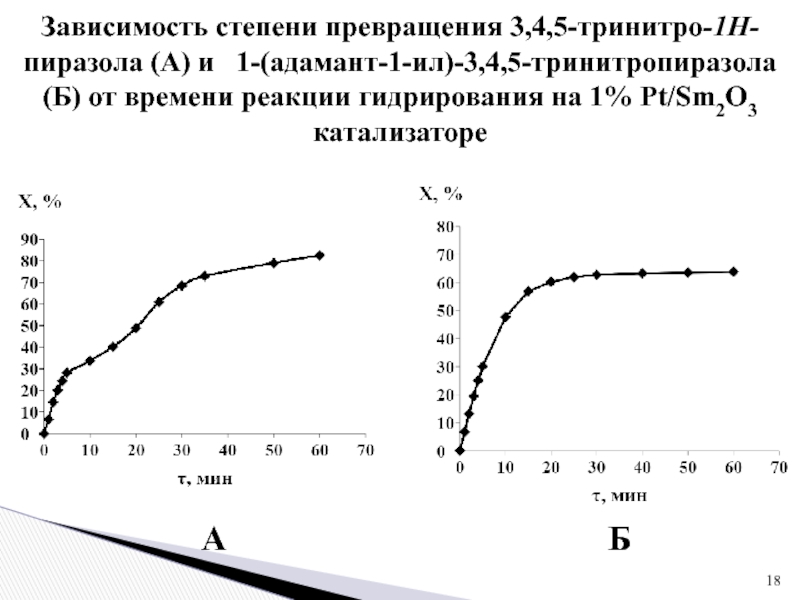
Слайд 18А
Б
Зависимость степени превращения 3,4,5-тринитро-1Н-пиразола (А) и 1-(адамант-1-ил)-3,4,5-тринитропиразола (Б) от
времени реакции гидрирования на 1% Pt/Sm2O3 катализаторе
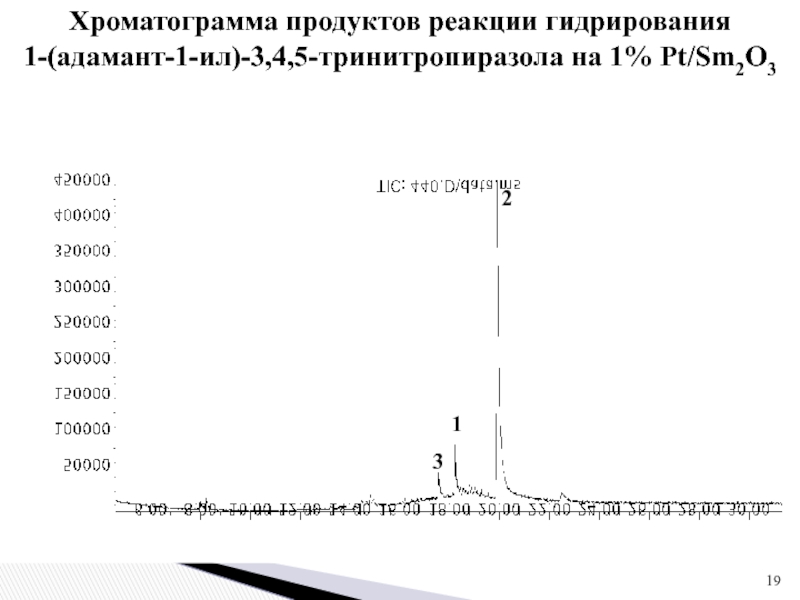
Слайд 19Хроматограмма продуктов реакции гидрирования
1-(адамант-1-ил)-3,4,5-тринитропиразола на 1% Pt/Sm2O3
1
2
3
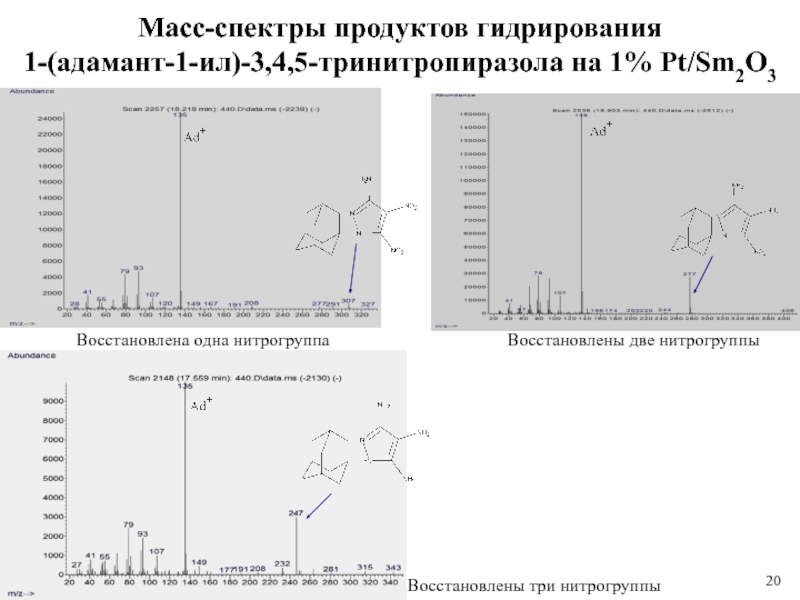
Слайд 20Масс-спектры продуктов гидрирования
1-(адамант-1-ил)-3,4,5-тринитропиразола на 1% Pt/Sm2O3
Восстановлены три нитрогруппы
Восстановлена одна нитрогруппа
Восстановлены
две нитрогруппы
Слайд 21Апробация результатов исследований
1. Мазаева А.О., Костенко Н.В., Зорина Г.И., Курунина
Г.М., Бутов Г.М.Термодинамический анализ реакции гидрирования n-нитрофенола и выбор растворителя
// Международный журнал прикладных и фундаментальных исследований. 2012. № 1. С. 176-177.
2. А.Ю. Ушакова, Н.В. Костенко, А.О. Мазаева, К.А. Калинова, Г.И. Зорина, Г.М. Курунина, Г.М. Бутов Выбор растворителя для реакции гидрирования N-нитрофенола и N-хлорнитробензола / // Сб. тез. науч.-практ. конф. мол. учёных по направл.: Химия – наука будущего. Инновации в энергосбережении и энергоэффективности. Информ. технологии – локомотив инновац. развития : в рамках молодёж. конгресса "Интеграция инноваций: регион. аспекты", 19-21 апр. 2012 г. / ВПИ (филиал) ВолгГТУ [и др.] - Волгоград, 2012. - C. 10-11.
3. А.О. Мазаева, Н.В. Костенко, Зорина Г.И., Курунина Г.М., Бутов Г.М.Исследование реакции гидрирования n-нитрофенола на 1% платиновом катализаторе, нанесенном на оксиды Sm и Gd// 18-я межвузовская научно-практическая конференция молодых ученых и студентов г. Волжского [Электронный ресурс]: сборник материалов профильных секций конференции. – Электрон. текстовые дан. ( 22,0 МБ ) – Волжский: ВПИ (филиал) ГОУВПО ВОЛГГТУ, 2012.
4. А.Ю. Ушакова, А.О. Мазаева, Н.В. Костенко, К.А. Калинова, Г.М. Курунина, Г.И. Зорина, Г.М. Бутов.. Гидрирование n-хлорнитробензола и n-нитрофенола на платиновых катализаторах, нанесенных на оксиды РЗЭ // Сб. тезисов и статей международной молодежной конференции - Катализ в органическом синтезе, 4-6 июля 2012.- Новочеркасск, - C.157
5. Н.В. Костенко, К.А. Калинова, Г.М. Курунина, Г.И. Зорина, Г.М. Бутов Гидрирование ароматических нитросоединений на Pt катализаторах, нанесенных на оксиды РЗЭ // Тезисы докладов конференции-конкурса научных, конструкторских и технологических работ студентов Волгоградского технического университета, 23-26 октября 2012.- Волгоград, - C.80
6. Н.В. Костенко, Б.П. Гладких, Г.М. Курунина, Г.И. Зорина, Б.А. Лысых, Г.М. Бутов Гидрирование 1-(адамант-1-ил)-3,4,5-тринитропиразола и 3,4,5-тринтро-1Н-пиразола на 1% Pt/Sm2O3 катализаторе // 19-я межвузовская научно-практическая конференция молодых ученых и студентов г. Волжского [Электронный ресурс]: сборник материалов профильных секций конференции. – Волжский: ВПИ (филиал) ГОУВПО ВОЛГГТУ, 2013 (в печати)
7. Г.М. Курунина, Г.И.Зорина, Г.М. Бутов, Н.В. Костенко, Б. П. Гладких Выбор растворителя и кинетика реакции гидрирования n-хлорнитробензола [Электронный ресурс] // 12-я научно-практическая конференция профессорско-преподавательского состава ВПИ (филиал) ВолгГТУ (г. Волжский, 27-28 янв. 2013 г.) (в печати)
8. Н.В. Костенко, Б.П. Гладких, Г.М. Курунина, Г.И. Зорина, Г.М. Бутов Гидрирование n-хлорнитробензола на платиновых катализаторах, нанесенных на оксиды гадолиния и алюминия // V Международный студенческий научный форум 2013 г 15 февраля – 31 марта 2013 года (в печати)

Слайд 23Выводы
1. Впервые осуществлено гидрирование 3,4,5-тринитро-1Н-пиразола и 1-(адамант-1-ил)-3,4,5-тринитропиразола на 1 %
Pt/Sm2O3 катализаторе при комнатной температуре.
2. Проведен термодинамический анализ реакции гидрирования
поли-нитросоединений, на примере 2,4-динитротолуола; в интервале температур от 293 до 303 К; реакция экзотермическая (∆Нr,T < 0), имеет самопроизвольный характер (∆G0r,T < 0) для всех расчитанных температур.
3. В результате кинетических исследований реакции гидрирования поли-нитросоединений установлено, что:
- процесс гидрирования 3,4,5-тринитро-1Н-пиразола и 1-(адамант-1-ил)-3,4,5-тринитропиразола протекает не селективно, наблюдается недопоглащение водорода;
- начальная скорость гидрирования 3,4,5-тринитро-1Н-пиразола составляет 16 мл Н2/мин, а 1-(адамант-1-ил)-3,4,5-тринитропиразола 8 мл Н2/мин;
- восстановление нитрогрупп протекает ступенчато;
-степень превращения 3,4,5-тринитро-1Н-пиразола составляет 83%, а 1-(адамант-1-ил)-3,4,5-тринитропиразола - 64 %.
4. Рассчитан материальный баланс реакции гидрирования полинитросоединений, на примере 3,4,5-тринитро-1Н-пиразола. Для получения 116,5 г/цикл 3,4,5-триамино-1Н-пиразола необходимо 251,8 г/цикл 3,4,5-тринитро-1Н-пиразола и 74,4 г/цикл водорода.
5. Выбран реактор РИС-П, рассчитаны поверхность теплообмена (0,3 м2) и объем реактора (3,1 л). Рассчитан тепловой баланс реакции гидрирования 3,4,5-тринитро-1Н-пиразола.
6. Предложена операторная схема гидрирования полинитросоединений.

Слайд 251. По окончанию гидрирования 3,4,5-тринитро-1Н-пиразола (1-(адамант-1-ил)-3,4,5-тринитропиразол), реакционную массу смешивали с
17 мл водного раствора соляной кислоты HCl, для перевода 3,4,5-триамино-1Н-пиразола
(1-(адамант-1-ил)-3,4,5-триаминопиразол) в соль.
2. После реакционную массу отстаивали, а затем фильтровали, с помощью фильтра Шота от катализатора.
3. После удаления катализатора, из раствора отгонялся растворитель и вода под вакуумом.
Методика выделения целевого продукта
Слайд 26Катализатор готовили по следующей методике: в стакан для приготовления катализатора
помещали расчетный объем соли платины, добавляли 20 мл воды и
с помощью мешалки перемешивали в течение 20 минут, затем вносили расчетную навеску носителя: Sm2O3. Пропитку носителя раствором соли платины вели 30 минут при перемешивании, затем полученную суспензию выливали в фарфоровую чашку и помещали в сушильный шкаф на сутки, выдерживали при температуре 105±1ºС до постоянного веса. После высушивания катализатор измельчали и просеивали через сито с размером отверстия 0,01 мм. В таком виде катализатор готов к исследованию его активности.
Методика приготовления катализатора
Слайд 27Методика приготовления раствора
платинохлористоводородной кислоты
Расчет объема платинохлористоводородной кислоты, используемой для приготовления
катализатора рассмотрен для навески H2PtCl6 – 50 г; объем колбы
1000 мл. Молярная масса платинохлористоводородной кислоты:
Массовая доля платины в растворе кислоты равна:
Тогда ее масса составит:
В 1 мл приготовленного раствора содержится 0,018825 г платины.
Платинохлористоводородную кислоту помещают в мерную колбу на 1000 мл, в нее приливали небольшое количество воды (≈ 10 мл), растворяли ее, затем уровень воды в колбе доводили до метки.
Катализатор обычно готовят в зависимости от количества предполагаемых опытов, тогда для приготовления 5 г 1% Pt катализатора на носителе берут 0,05 г Pt и 4,95 г носителя. В пересчете на объем раствора, это составит:
Слайд 281- генератор водорода; 2,7 – кран; 3,4,5 – очиститель склянки;
6 – газометр; 8 – измерительные бюретки; 9
– груша; 10 – каталитическая «утка»; 11 – качалка; 12 - электромотор
Схема установки для каталитического гидрирования органических соединений