Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Гидролиз солей
Содержание
- 1. 1 Гидролиз солей
- 2. Гидролиз – это взаимодействие с молекулами воды.Гидролиз
- 3. Гидролизу подвергаются соли:образованные слабым основанием и сильной
- 4. Расчет константы гидролиза Kh, pH и степени
- 5. [HA] ·
- 6. Слайд 6
- 7. Слайд 7
- 8. Стенень гидролиза зависит от:Ионного произведения воды
- 9. Расчет константы гидролиза Kh, pH и степени
- 10. [BOH] ·
- 11. Слайд 11
- 12. Слайд 12
- 13. Стенень гидролиза зависит от:Ионного произведения воды
- 14. Расчет константы гидролиза Kh, pH и степени
- 15. [BOH] ·
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Вычислить рН и степень гидролиза 0,35% раствора
- 21. Равновесия в растворах кислых солей (NaHCO3)
- 22. Слайд 22
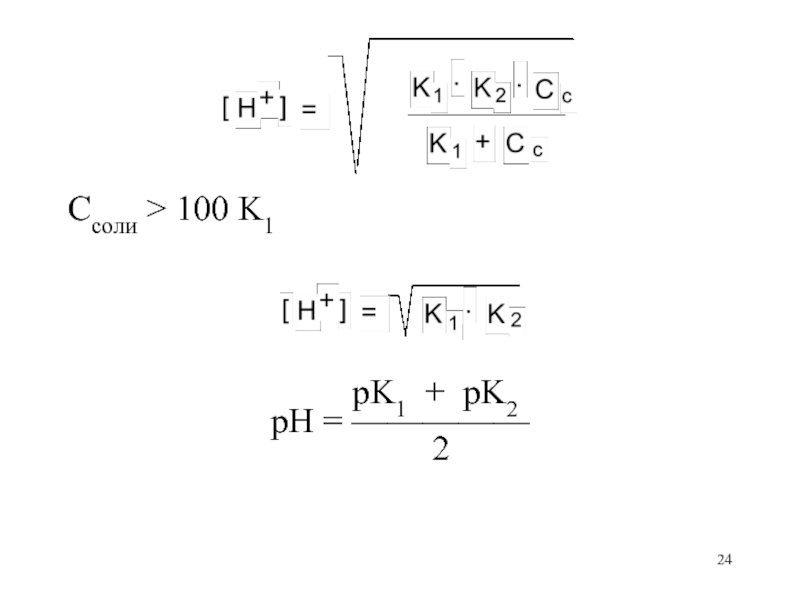
- 23. [HA– ] = Cсоли
- 24. Cсоли > 100 K1
- 25. Вычислить рН раствора гидрокарбоната натрия.NaHCO3 – кислая
- 26. К 50 мл 0,1 М раствора Na2CO3
- 27. Идет реакция:Na2CO3 + HCl
- 28. Скачать презентанцию
Гидролиз – это взаимодействие с молекулами воды.Гидролиз – это процесс, при котором молекулы воды, взаимодействуя с ионами растворенного вещества, разлагаются с выделением ионов водорода или гидроксид-ионов, в результате чего изменяется рН
Слайды и текст этой презентации
Слайд 3
Гидролизу подвергаются соли:
образованные слабым основанием и сильной кислотой NH4Cl, N2H4·HCl
образованные
сильным основанием и слабой кислотой CH3COONa, C6H5COOK
образованные слабым основанием и
слабой кислотойСлайд 4Расчет константы гидролиза Kh, pH и степени гидролиза h соли,
образованной сильным основанием и слабой кислотой
BA B+
+ A–A– + H2O HA + OH–
[HA] · [OH–]
Kh = ——————
[A–]
Слайд 5
[HA] · [OH–]
[H+] Kw
Kh = —————— ·
——— = ———[A–] [H+] Kк-ты
[HA] · [OH–] Kw
—————— = ———
[A–] Kк-ты
[HA] = [OH–]
[A–] = Ссоли – [OH–] Ссоли
(h < 5%)
Слайд 6
[OH–]2
Kw———— = ———
Ссоли Kк-ты
pOH = ½ pKw – ½ pKк-ты – ½ lg Cсоли
pOH = 7 – ½ pKк-ты – ½ lg Cсоли
pH = 7 + ½ pKк-ты + ½ lg Cсоли
Слайд 8Стенень гидролиза зависит от:
Ионного произведения воды
(чем
to тем Kw тем
h)2. Природы кислоты
(чем слабее кислота, тем в большей степени протекает гидролиз)
3. Концентрации соли
(чем Ссоли тем h)
Слайд 9Расчет константы гидролиза Kh, pH и степени гидролиза h соли,
образованной слабым основанием и сильной кислотой
BA B+
+ A–B+ + H2O BOH + H+
[BOH] · [H+]
Kh = ——————
[B+]
Слайд 10
[BOH] · [H+]
[OH–] Kw
Kh = —————— · ——— =
———[B+] [OH–] Kосн
[BOH] · [H+] Kw
—————— = ———
[B+] Kосн
[BOH] = [H+]
[B+] = Ссоли – [H+] Ссоли
(h < 5%)
Слайд 11
[H+] 2
Kw———— = ———
Ссоли Kосн
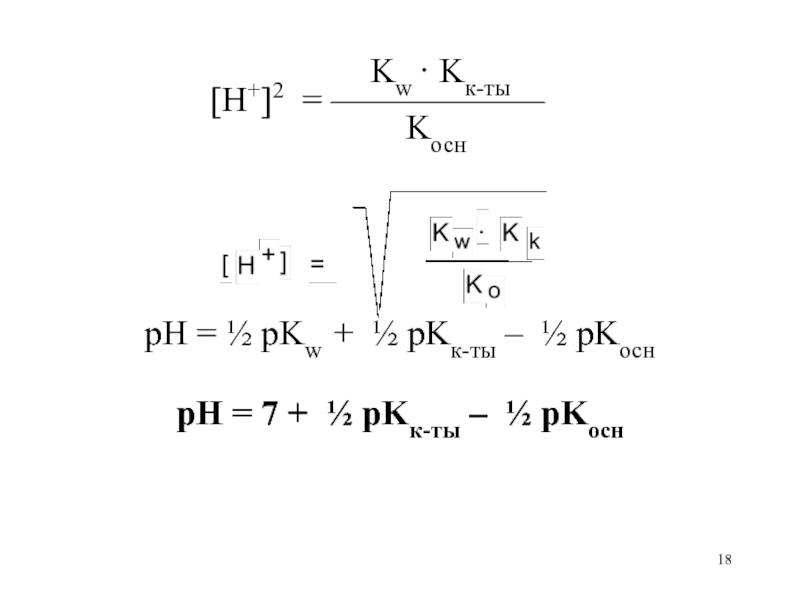
pH = ½ pKw – ½ pKосн – ½ lg Cсоли
pH = 7 – ½ pKосн – ½ lg Cсоли
Слайд 13Стенень гидролиза зависит от:
Ионного произведения воды
(чем
to тем Kw тем
h)2. Природы основания
(чем слабее основание, тем в большей степени протекает гидролиз)
3. Концентрации соли
(чем Ссоли тем h)
Слайд 14Расчет константы гидролиза Kh, pH и степени гидролиза h соли,
образованной слабым основанием и слабой кислотой
BA B+
+ A–B+ + A– + H2O BOH + HA
[BOH] · [HA]
Kh = ——————
[B+] · [A–]
Слайд 15
[BOH] · [HA] [OH–]
[H+] Kw
Kh = ——————
· —— · —— = ————[B+] · [A–] [OH–] [H+] Kк-ты · Kосн
[BOH] · [HA] Kw
—————— = ————
[B+] · [A–] Kк-ты · Kосн
[BOH] = [HA]
[B+] = Ссоли – [H+] Ссоли
[A–] = Ссоли – [OH–] Ссоли
(h < 5%)
Слайд 16
[HA] 2
Kw———— = ————
Ссоли2 Kк-ты · Kосн
Выразим [HA] через [H+]
HA H+ + A–
[H +] · [A–]
Kк-ты = ——————
[HA]
[A–] = Ссоли
[H +] · Ссоли
[HA] = ——————
Kк-ты
Слайд 17
[HA] 2
Kw———— = ————
Ссоли2 Kк-ты · Kосн
[H +] · Ссоли
[HA] = ——————
Kк-ты
[H +]2 · Ссоли2 Kw
—————— = ————
Kк-ты2 · Ссоли2 Kк-ты · Kосн
[H +]2 Kw
———— = ———
Kк-ты Kосн
Слайд 20Вычислить рН и степень гидролиза 0,35% раствора солянокислого гидразина N2H4·HCl
pH
= 7 – ½ pKосн – ½ lg Cсоли
pKосн = 6,03 пересчитаем 0,35% = 0,05 МpH = 7 – ½ · 6,03 – ½ · lg 0,05 = 4,63
или 0,04%
Слайд 22 MHA
M+ + HA–
30%
HA– + H+ H2A HA– H+ + A2–
[H+] = [A2–] – [H2A]
H2A H+ + HA– HA– H+ + A2–
[H+] · [HA– ] [H+] · [A2– ]
K1 = ————— K2 = —————
[H2A] [HA– ]
Слайд 23[HA– ] = Cсоли
[H+]
· Cсоли
[H+] · [A2– ]K1 = ————— K2 = —————
[H2A] Cсоли
[H+] · Cсоли K2 · Cсоли
[H2A] = ————— [A2– ] = —————
K1 [H+]
[H+] = [A2–] – [H2A]
K2 · Cсоли [H+] · Cсоли
[H+] = ————— – —————
[H+] K1
Слайд 25Вычислить рН раствора гидрокарбоната натрия.
NaHCO3 – кислая соль
pK1 = 6,35
pK2 = 10,32pK1 + pK2
pH = —————
2
6,35 + 10,32
pH = —————— = 8,3
2
Слайд 26К 50 мл 0,1 М раствора Na2CO3 добавлено 25 мл
0,2 М раствора HCl. Вычислить рН раствора.
Na2CO3 + HCl
NaHCO3 + NaClNa2CO3 + 2HCl H2CO3 + 2NaCl
(Na2CO3) = C(Na2CO3) · V = 50 · 0,1 = 0,5 мМ
(HCl) = C(HCl) · V = 25 · 0,2 = 0,5 мМ
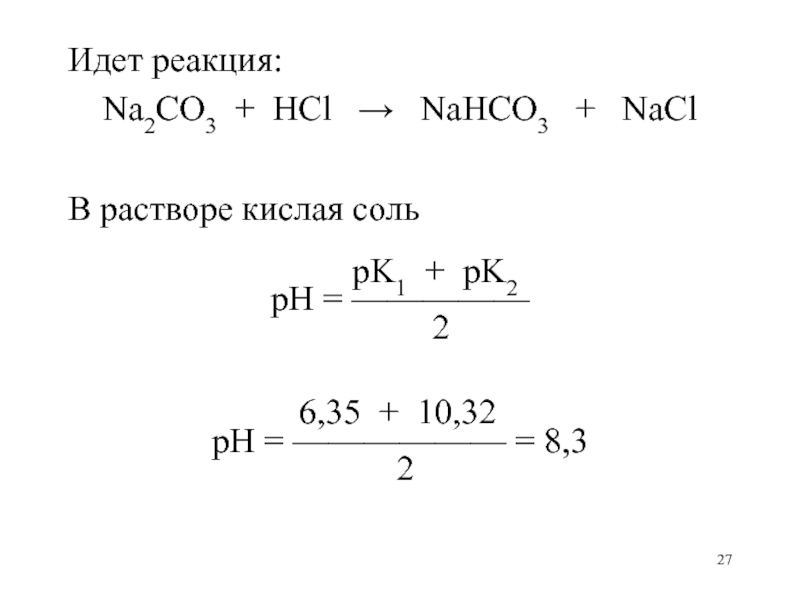
Слайд 27Идет реакция:
Na2CO3 + HCl NaHCO3 +
NaCl
В растворе кислая соль
pK1 + pK2pH = —————
2
6,35 + 10,32
pH = —————— = 8,3
2




![1
Гидролиз солей [HA] · [OH–] [H+] KwKh [HA] · [OH–] [H+] KwKh](/img/tmb/3/278526/1ee45ed3f733d385f55369520f9eb9fe-800x.jpg)
![1
Гидролиз солей [OH–]2 [OH–]2](/img/thumbs/8b868b3577172c0f42c5c080b67f40fb-800x.jpg)
![1
Гидролиз солей Cгидр [OH–] Cгидр](/img/tmb/3/278526/d0ccb84df1785bbd58af370d14841918-800x.jpg)


![1
Гидролиз солей [BOH] · [H+] [OH–] KwKh = [BOH] · [H+] [OH–] KwKh = ——————](/img/thumbs/e622eb8f14aa76fd8a131df628ad2ae7-800x.jpg)
![1
Гидролиз солей [H+] 2 [H+]](/img/tmb/3/278526/9f3548b8299c08b8ad8ec9b601d2bd1b-800x.jpg)
![1
Гидролиз солей Cгидр [H+] Cгидр](/img/thumbs/9421855b7e86ac1814b631948a845747-800x.jpg)


![1
Гидролиз солей [BOH] · [HA] [OH–] [H+] Kw [BOH] · [HA] [OH–] [H+] Kw](/img/thumbs/ee2bc01b54eeebdb4b61558893bd0cf2-800x.jpg)
![1
Гидролиз солей [HA] 2 [HA] 2](/img/thumbs/ece0b7539710407851aae968802a5550-800x.jpg)
![1
Гидролиз солей [HA] 2 [HA] 2](/img/tmb/3/278526/abd03054907846bbec0aedd40aae785c-800x.jpg)




![1
Гидролиз солей [HA– ] = Cсоли [H+] · Cсоли [HA– ] = Cсоли [H+] · Cсоли](/img/tmb/3/278526/4ce2227836564a87ca11aab8b02c0568-800x.jpg)