Слайд 1ПРОСТОРОВА ІЗОМЕРІЯ (СТЕРЕОІЗОМЕРІЯ)
Існують такі види стереоізомерії
геометрична (π-діастереоізомерія);
енантіомерія (оптична);
конформаційна.
Якщо структурна
ізомерія визначається відмінністю у будові ланцюгів Карбону або відмінністю у
положенні функціональних груп або кратних зв'язків, то явище стереоізомерії (просторової ізомерії) обумовлене відмінністю розташування атомів і функціональних груп сполук у просторі
Деякі терміни та визначення:
Конфігурація – певне просторове розташування атомів у молекулі, яке не може бути перетворене в інше у наслідок їх обертання довкола зв’язків без їх розщеплення
Конформація – певне просторове розташування атомів у молекулі, яке може змінюватись при обертанні груп атомів довкола зв’язків без їх розщеплення
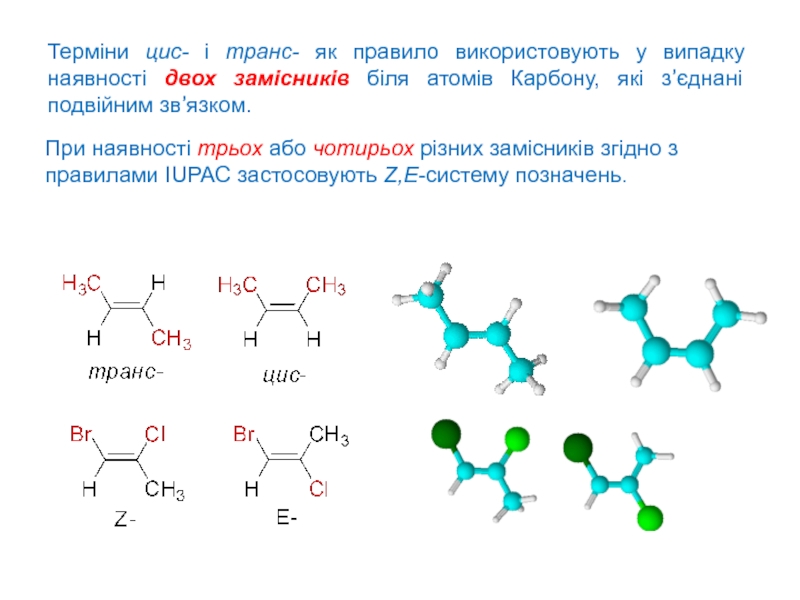
Слайд 2Терміни цис- і транс- як правило використовують у випадку наявності
двох замісників біля атомів Карбону, які з’єднані подвійним зв’язком.
При наявності
трьох або чотирьох різних замісників згідно з правилами IUPAC застосовують Z,E-систему позначень.
Слайд 3Для визначення типу ізомеру спочатку визначають старшого замісника при кожному
атомі Карбону біля зв’язку С=С.
Старшинство атома визначається його порядковим
номером e періодичній системі елементів.
Так, наймолодший замісник - Гідроген, за ним ідуть Lі, Ве, С, N, О, F і так далі.
У випадку функційних груп старшинство визначається природою першого атому (—SО3Н > —ОН > —NН2 > —СН3), а у випадку їх рівності — природою другого (—СН2—СН3 < —СН2—NН2 < —СН2—OH < —CH2—F) і так далі. У випадку груп з різними типами зв'язків старшість зростає в ряді:
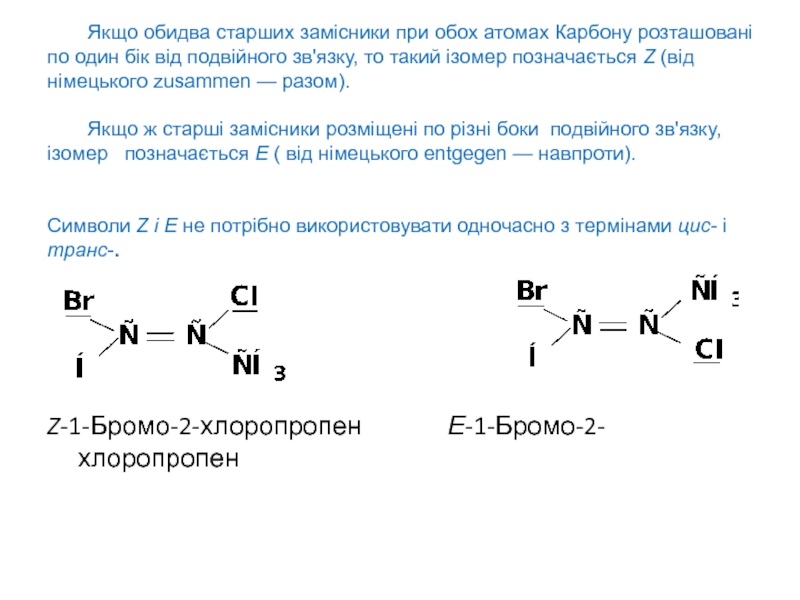
Слайд 4 Якщо обидва старших замісники при обох атомах Карбону розташовані по
один бік від подвійного зв'язку, то такий ізомер позначається Z
(від німецького zusammen — разом).
Якщо ж старші замісники розміщені по різні боки подвійного зв'язку, ізомер позначається Е ( від німецького entgegen — навпроти).
Символи Z і Е не потрібно використовувати одночасно з термінами цис- і транс-.
Z-1-Бромо-2-хлоропропен Е-1-Бромо-2-хлоропропен
Слайд 5Оптична ізомерія (дзеркальна енантіомерія
Явище хіральності молекул було відкрите Л. Пастером
у 1848 р. при вивченні кристалів, які випадають з розчину
рацемічного тартрату натрію-амонію. Він встановив, що ці кристали мають дві форми, які є дзеркальним відображенням одна одної і не суміщуються в просторі.
Пастер провів кристаллизації тринадцяти енантіомерно чистих сполук (різних тартратів та винної кислоти), а також шести рацемічних тартратів і зробив висновок про існування раніше невідомого виду ізомерії винних кислот — енантіомерії.
Саме поняття хіральності було введено лордом Кельвіном в кінці XIX ст
Я називаю яку-небудь геометричну фігуру або групу точок хіральною і кажу, що вона має хіральність, якщо її зображення в ідеальному плоскому дзеркалі не може бути з нею суміщене.
Структурне трактування хіральності стало можливе після введення в 1874 р. Я. Вант-Гоффом та Ж. Ле Белем концепції асиметричного атома Карбону, тобто тетраедричного атома Карбону з чотирьома різними замісниками.
Пізніше Майєр поширив це на атом Нітрогену, а У. Дж. Поуп на атоми S, Se, Sn
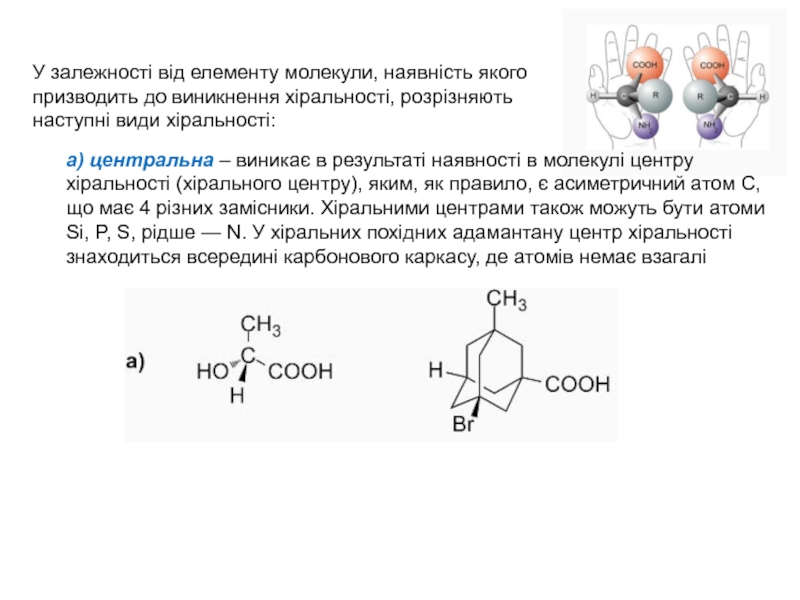
Слайд 6У залежності від елементу молекули, наявність якого призводить до виникнення
хіральності, розрізняють наступні види хіральності:
а) центральна – виникає в результаті
наявності в молекулі центру хіральності (хірального центру), яким, як правило, є асиметричний атом С, що має 4 різних замісники. Хіральними центрами також можуть бути атоми Si, P, S, рідше — N. У хіральних похідних адамантану центр хіральності знаходиться всередині карбонового каркасу, де атомів немає взагалі
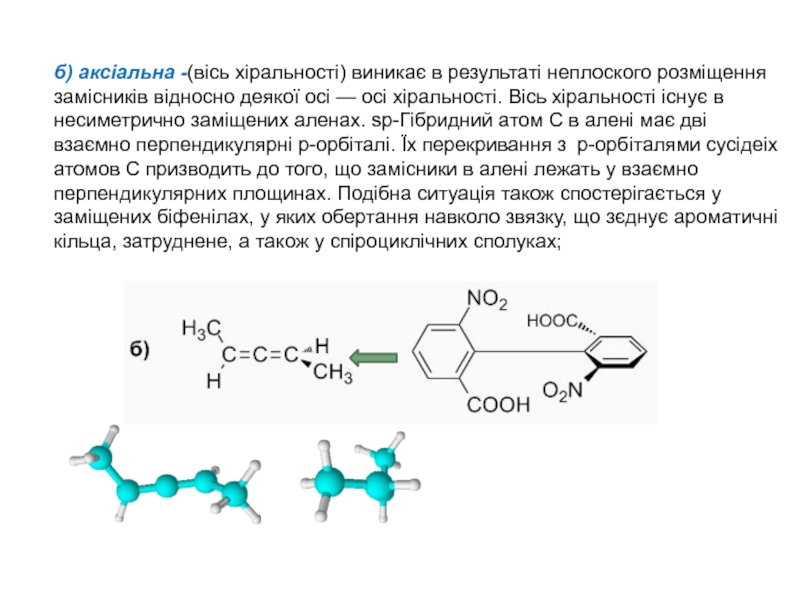
Слайд 7б) аксіальна -(вісь хіральності) виникає в результаті неплоского розміщення замісників
відносно деякої осі — осі хіральності. Вісь хіральності існує в
несиметрично заміщених аленах. sp-Гібридний атом С в алені має дві взаємно перпендикулярні p-орбіталі. Їх перекривання з p-орбіталями сусідеіх атомов С призводить до того, що замісники в алені лежать у взаємно перпендикулярних площинах. Подібна ситуація також спостерігається у заміщених біфенілах, у яких обертання навколо звязку, що зєднує ароматичні кільца, затруднене, а також у спіроциклічних сполуках;
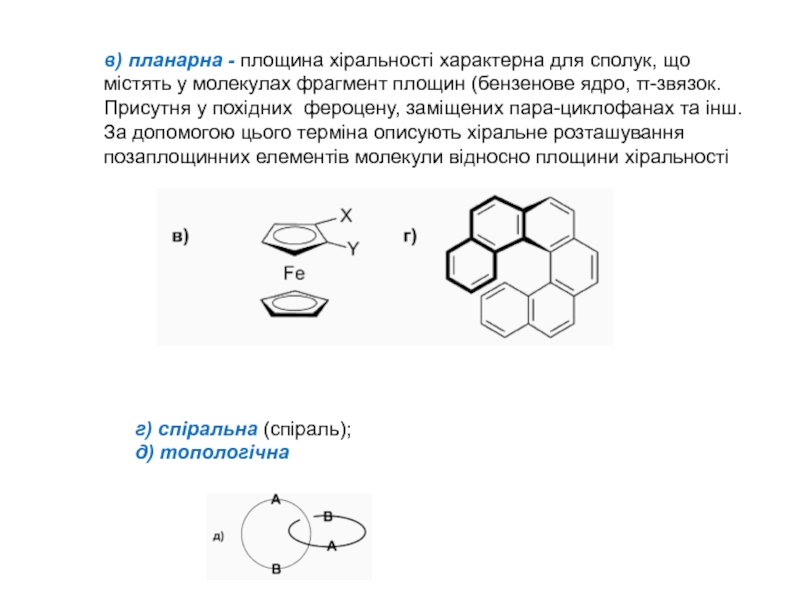
Слайд 8в) планарна - площина хіральності характерна для сполук, що містять
у молекулах фрагмент площин (бензенове ядро, -звязок. Присутня у похідних
фероцену, заміщених пара-циклофанах та інш. За допомогою цього терміна описують хіральне розташування позаплощинних елементів молекули відносно площини хіральності
г) спіральна (спіраль);
д) топологічна
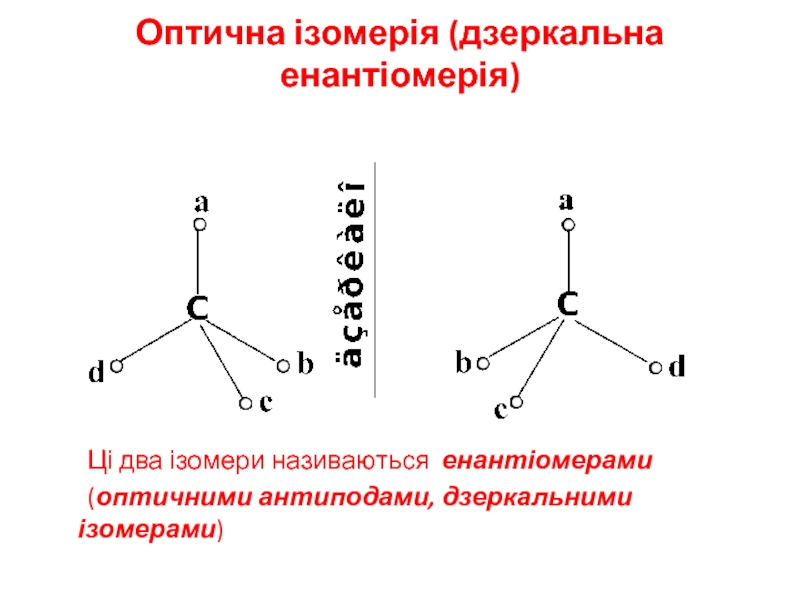
Слайд 9Оптична ізомерія (дзеркальна енантіомерія)
Ці два ізомери називаються енантіомерами
(оптичними антиподами,
дзеркальними ізомерами)
Слайд 10Енантіомери мають однаковий якісний і кількісний склад, однакову хімічну будову
і відрізняються лише просторовим розташуванням замісників біля асиметричного атома Карбону
— так званою просторовою конфігурацією.
Речовини, що складаються з асиметричних молекул, проявляють оптичну активність — їх розчини обертають площину поляризації плоско-поляризованого променя світла. Якщо один енантіомер обертає її за годинниковою стрілкою, то другий — проти.
Той оптичний антипод, що обертає площину поляризації за годинниковою стрілкою називається правообертаючим і позначається (d) або (+), а той, що проти — лівообертаючим і позначається (ℓ) або (—).
Слайд 11Звичайні структурні формули не дозволяють передати реальну просторову конфігурацію молекули.
Для відображення просторової конфігурації найчастіше застосовують
формули з клиноподібними зв'язками
проекційні формули Е.Фішера.
Слайд 12У формулах з клиноподібними зв'язками ті з них, що лежать
у площині малюнка позначають звичайними лініями. Зв’язки, що напрямлені від
площини малюнка в бік спостерігача показують клиноподібними заштрихованими рисочками
а ті, що напрямлені в протилежний бік – незаштрихованими
Так, фрагменти СОН та Н розташовані в площині малюнка, група СН2ОН знаходиться перед нею, а гідроксильна група (ОН) – відповідно за площиною малюнка.
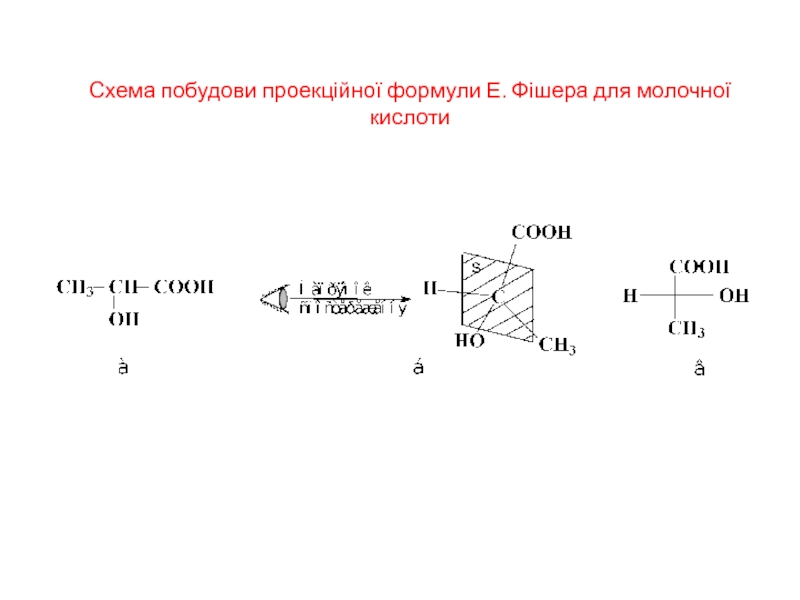
Слайд 13Схема побудови проекційної формули Е. Фішера для молочної кислоти
Слайд 14Кожна тетраедрична модель з хіральним атомом Карбону може бути подана
дванадцятьма проекціями Фішера — залежно від розміщення замісників відносно напряму
спостереження.
Для зменшення кількості формул, згідно з правилами IUPAC, головну функціональну групу розташовують зверху, а головний вуглецевий ланцюг — вертикально.
Слайд 15При використанні фішеровських формул слід дотримуватись певних правил:
Формули Фішера можна
повертати в площині на кут кратний 180о і не можна
повертати на кут 90о, 270о, 450о тощо.
У формулах Фішера дозволяється міняти місцями за годинниковою стрілкою або проти неї три замісники біля асиметричного атома вуглецю.
Переміна місцями двох будь-яких замісників веде до формули антиподу.
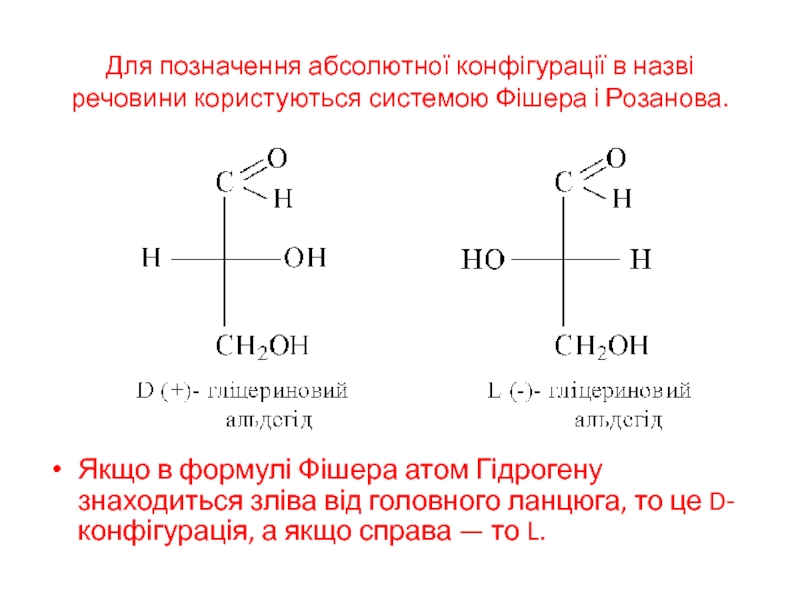
Слайд 16Для позначення абсолютної конфігурації в назві речовини користуються системою Фішера
і Розанова.
Якщо в формулі Фішера атом Гідрогену знаходиться зліва
від головного ланцюга, то це D-конфігурація, а якщо справа — то L.
Слайд 17Універсальна система Р.Кана, К.Інгольда і В.Прелога позначення абсолютної конфігурації молекули
Нехай
старшинство замісників зменшується в порядку а>b>c>d. Для застосування R, S-системи,
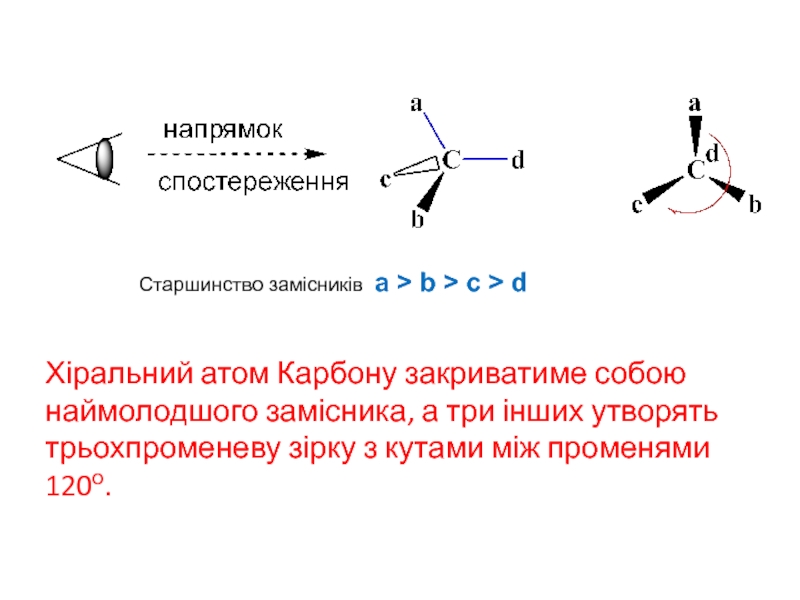
молекулу необхідно розмістити в просторі таким чином, щоб око спостерігача знаходилося на осі: хіральний центр — наймолодший замісник (найчастіше це водень) і так щоб цей наймолодший замісник був з протилежного боку по відношенню до ока спостерігача.
Слайд 18Хіральний атом Карбону закриватиме собою наймолодшого замісника, а три інших
утворять трьохпроменеву зірку з кутами між променями 120о.
Старшинство замісників a
> b > c > d
Слайд 19
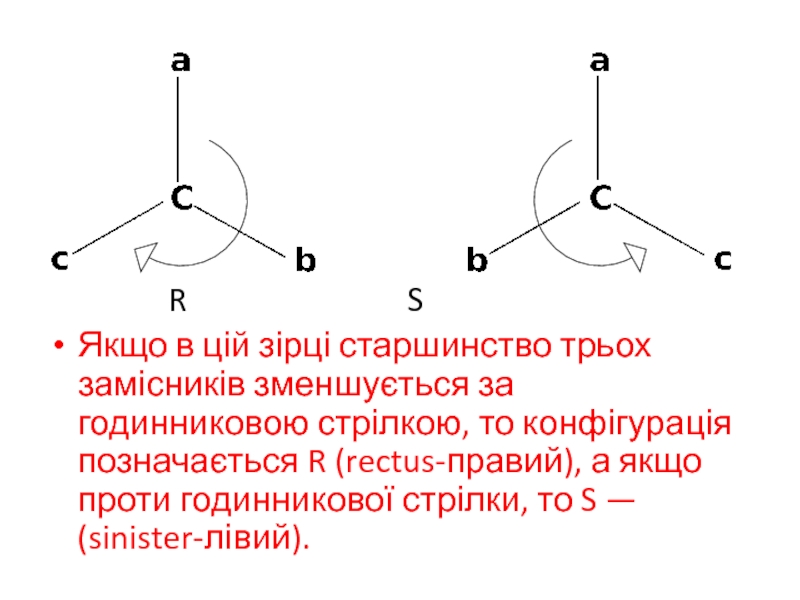
R S
Якщо в цій зірці старшинство трьох замісників
зменшується за годинниковою стрілкою, то конфігурація позначається R (rectus-правий), а
якщо проти годинникової стрілки, то S — (sinister-лівий).
Слайд 20При наявності в молекулі декількох хіральних атомів Карбону, конфігурацію кожного
з них необхідно розглядати окремо.
Визначити R або S-конфігурацію можна і
безпосередньо на основі проекційної формули Фішера. Для цього зручно користуватись “зворотним” принципом В.Потапова.
“Якщо в проекційній формулі Фішера старшинство трьох найстарших замісників зменшується за годинниковою стрілкою, то молекула має S-конфігурацію, а якщо проти годинникової стрілки, то — R.”
Слайд 21
Конформаційна (поворотна) ізомерія
Конформація — певна конфігурація молекули в просторі, яка
виникає в результаті обертання фрагментів молекули навколо ординарного σ-зв'язку. Ці
стереоізомерні структури перебувають у динамічній рівновазі і відрізняються між собою стабільністю. Більш стабільні конформації (у яких молекули перебувають більшу частину часу) називаються конформерами або поворотними ізомерами.
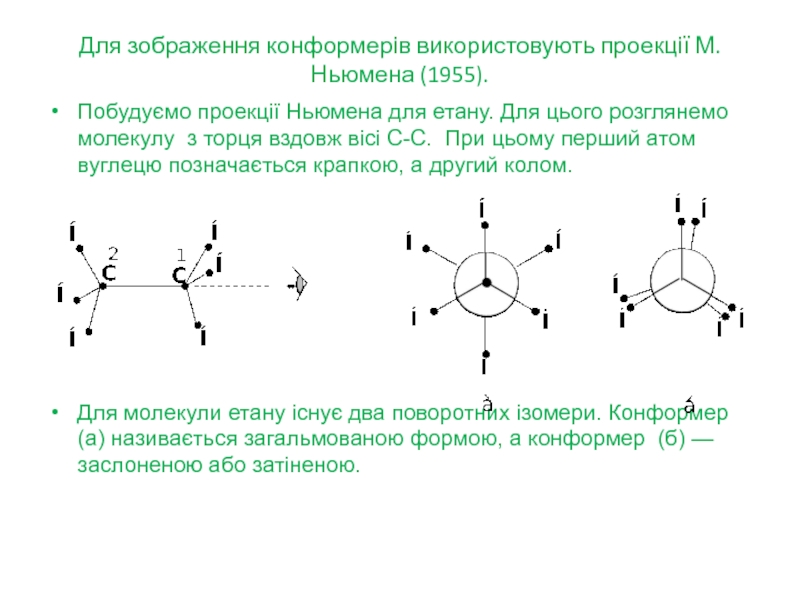
Слайд 22Для зображення конформерів використовують проекції М.Ньюмена (1955).
Побудуємо проекції Ньюмена для
етану. Для цього розглянемо молекулу з торця вздовж вісі С-С.
При цьому перший атом вуглецю позначається крапкою, а другий колом.
Для молекули етану існує два поворотних ізомери. Конформер (а) називається загальмованою формою, а конформер (б) — заслоненою або затіненою.
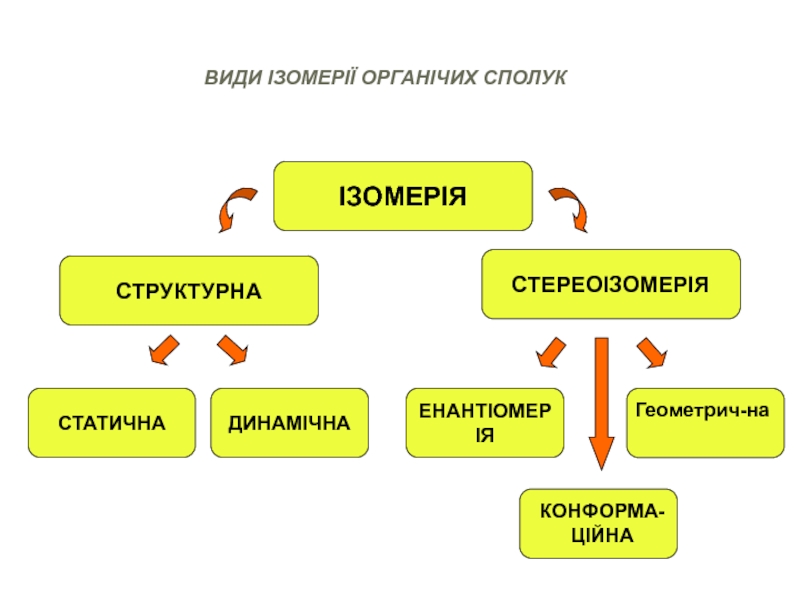
Слайд 23ІЗОМЕРІЯ
СТРУКТУРНА
СТЕРЕОІЗОМЕРІЯ
СТАТИЧНА
ДИНАМІЧНА
ЕНАНТІОМЕРІЯ
Геометрич-на
КОНФОРМА-ЦІЙНА
ВИДИ ІЗОМЕРІЇ ОРГАНІЧИХ СПОЛУК
Слайд 24Класифікація органічних сполук
за будовою вуглецевого скелета.
Ациклічні (аліфатичні) – насичені
та ненасичені,
Карбоциклічні (аліциклічні та ароматичні),
Гетероциклічні.
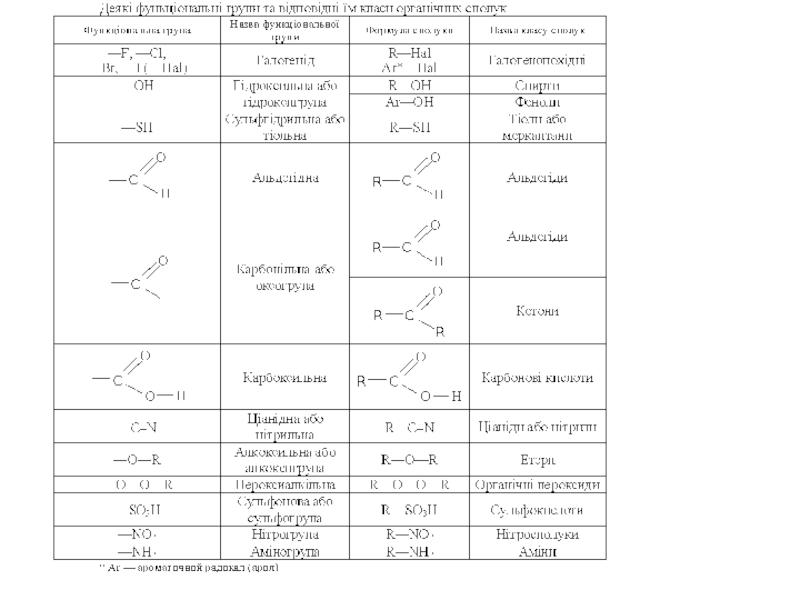
Слайд 25Існує також інший спосіб класифікації - за функціональними групами, оскільки
кожен з вищенаведених класів може мати різноманітні функціональні похідні.
Функціональною
групою називається угрупування атомів, що надає молекулі певних хімічних властивостей.