Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Растворы. Способы выражения концентраций. Сильные и слабые
Содержание
- 1. 1 Растворы. Способы выражения концентраций. Сильные и слабые
- 2. Граф структуры
- 3. Растворы - гомогенные термодинамически устойчивые системы, состоящие
- 4. Раствор может иметь любое агрегатное состояние: жидкое газообразное (газовая смесь). твердое
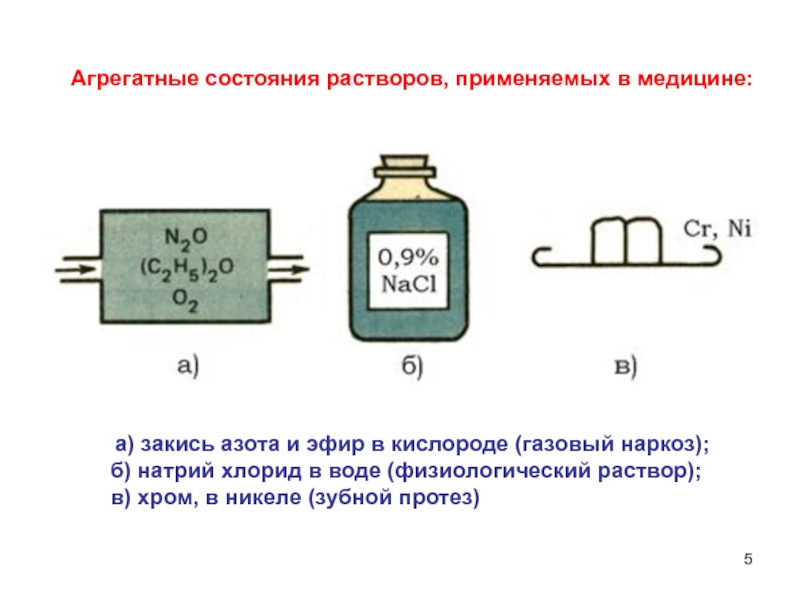
- 5. Агрегатные состояния растворов, применяемых в медицине:а) закись
- 6. Характеризуются гомогенностью состава и отсутствием поверхности
- 7. 2. По наличию или отсутствию электролитической диссоциации
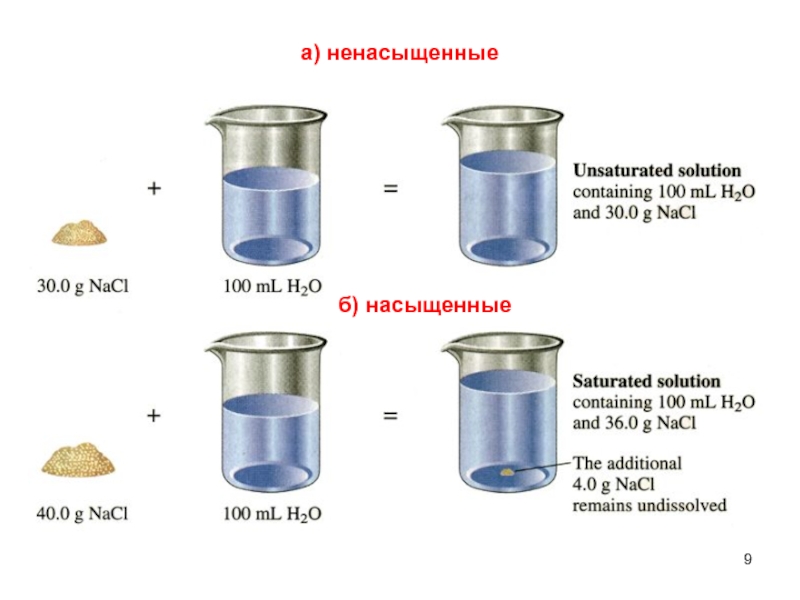
- 8. а) Ненасыщенный - раствор, в котором еще
- 9. б) насыщенные а) ненасыщенные
- 10. в) пересыщенные – содержащие значительно больше растворенного
- 11. РастворимостьРастворимость – способность вещества растворяться в том
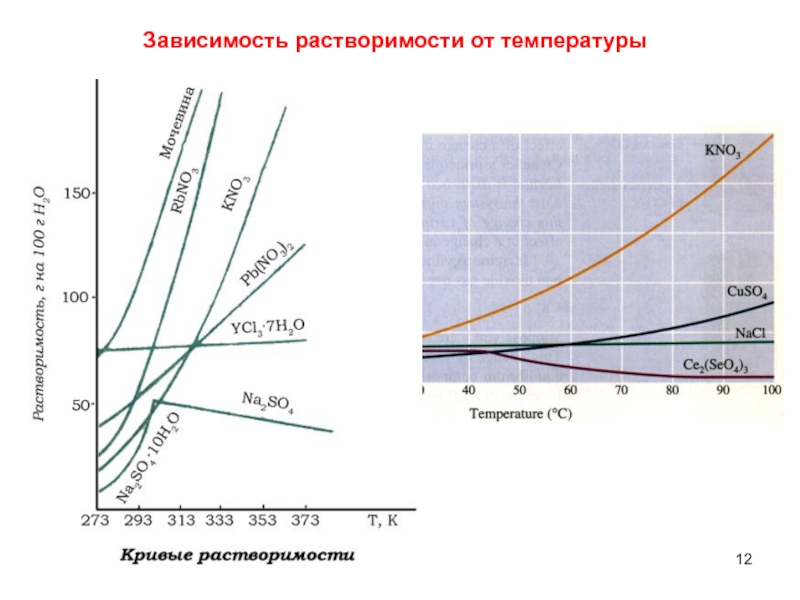
- 12. Зависимость растворимости от температуры
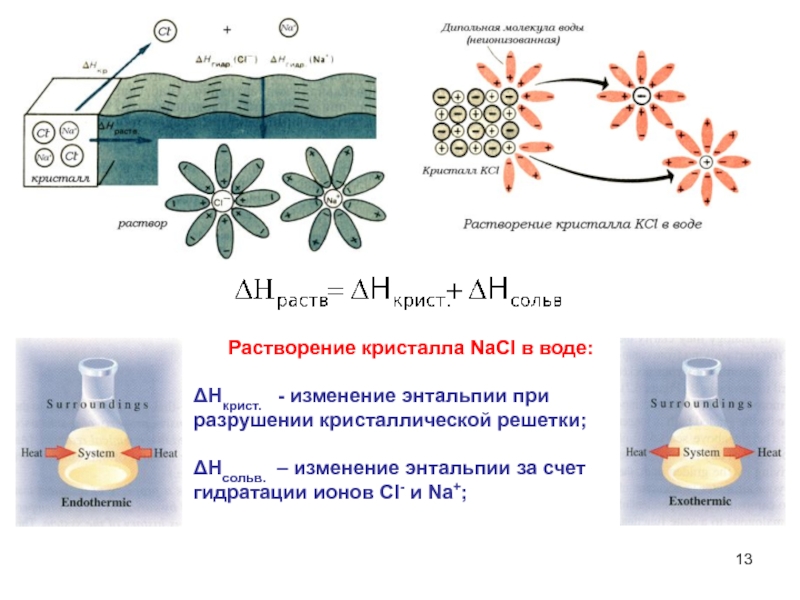
- 13. Растворение кристалла NaCl в воде:ΔНкрист. -
- 14. Процентная –масса вещества в 100 г раствораПроцентная
- 15. «% - сотая часть » 2 мл
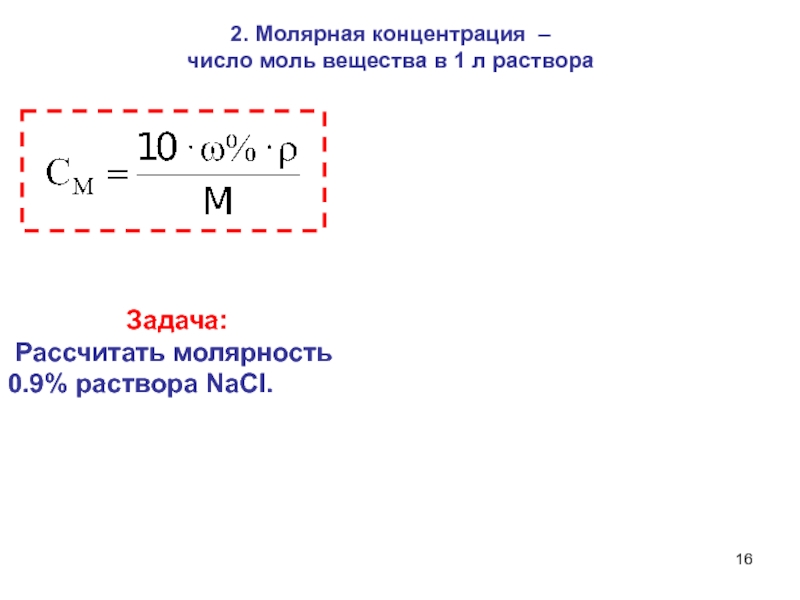
- 16. 2. Молярная концентрация – число моль
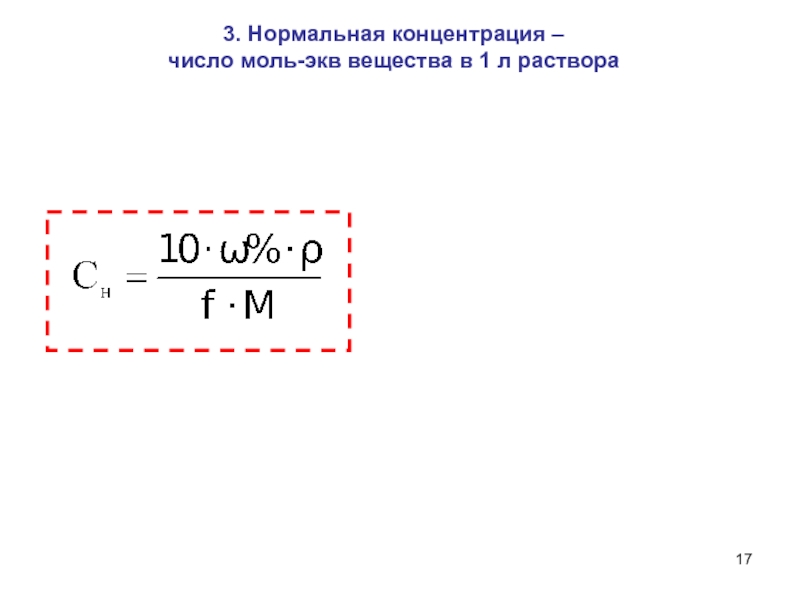
- 17. 3. Нормальная концентрация – число моль-экв вещества в 1 л раствора
- 18. Фактор эквивалентности – fэкв(Х)
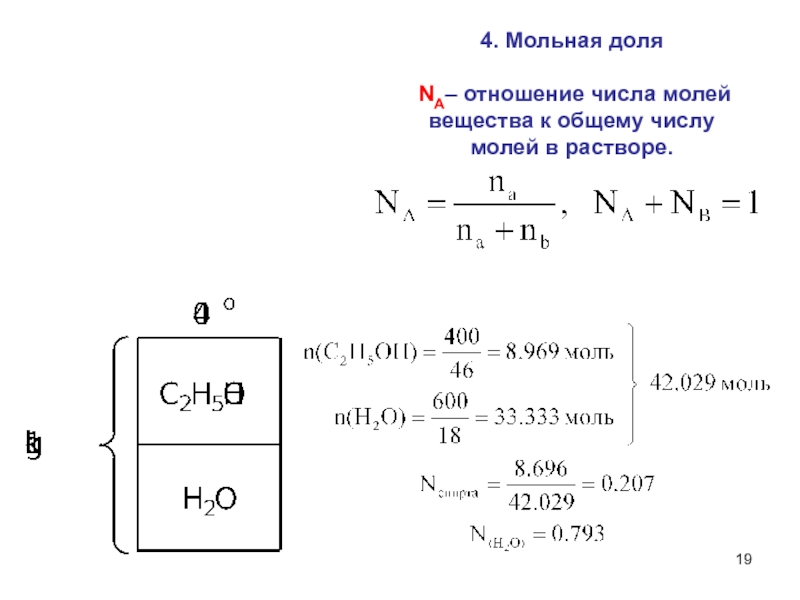
- 19. 4. Мольная доля NA– отношение числа молей вещества к общему числу молей в растворе.
- 20. 5. Моляльность m - число
- 21. 6. Титр раствора Т –
- 22. Осмолярная концентрация - суммарное
- 23. Растворы электролитов Электролиты – вещества,
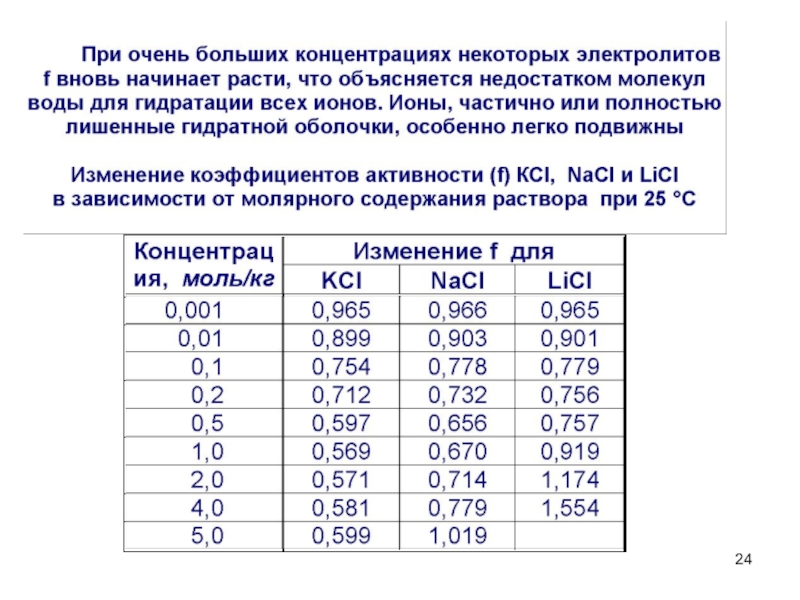
- 24. Слайд 24
- 25. Ионная сила растворов Ионная сила
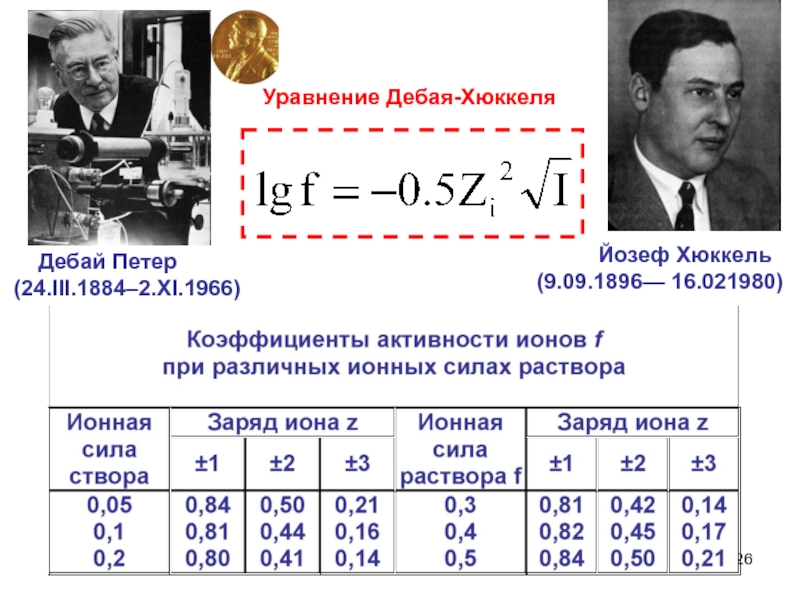
- 26. Уравнение Дебая-Хюккеля Дебай Петер (24.III.1884–2.XI.1966) Йозеф Хюккель(9.09.1896— 16.021980)
- 27. NB! При добавлении к насыщенному раствору малорастворимого
- 28. NB! При добавлении к насыщенному раствору малорастворимого
- 29. 2. Слабые электролиты диссоциируют обратимо, ступенчато.α –
- 30. Закон разбавления Оствальда
- 31. При
- 32. 2. Степень диссоциации кислоты HX равна 0,25.
- 33. Задача: Рассчитать концентрацию ионов водорода [Н+] в 9% растворе уксуса (пл.=1), Кд=1.75∙10-5.
- 34. Задача: Рассчитать концентрацию ионов водорода [Н+] в 9% растворе уксуса (пл.=1)Ответ: [Н+]=5.12∙10-3 моль-экв/л
- 35. Спасибо за внимание!
- 36. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Растворы.
«Способы выражения концентраций.
Сильные и слабые электролиты.
Закон разведения
Оствальда»
Слайд 3Растворы
- гомогенные термодинамически устойчивые системы, состоящие из двух и
большего числа компонентов, состав которых изменяться в пределах, допустимых растворимостью.
Точка
зрения Менделеева:Раствор - это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Д. И. Менделеев
(8.02.1834 – 02.02.1907)
NB! Гидратная теория Менделеева стала oдной из основ современной теории растворов.
«В растворе при обычной температуре происходит образование и разрушение ассоциатов (соединениий) – частиц растворителя – гидратов - с частицами растворенного вещества»
Слайд 5Агрегатные состояния растворов, применяемых в медицине:
а) закись азота и эфир
в кислороде (газовый наркоз);
б) натрий хлорид
в воде (физиологический раствор); в) хром, в никеле (зубной протез)
Слайд 6 Характеризуются гомогенностью состава и отсутствием поверхности раздела между растворенным
веществом и растворителем. Размер растворенных частиц (ионов и молекул) меньше
10-9 м.Классификация
1. По молярной массе растворенного вещества
ВМС - полимеры, макромолекулы которых состоят мономерных звеньев, соединенных между собой химическими связями.
Растворы полиэлектролитов - растворы ВМС, в состав которых входят функциональные группы, способные к ионизации.
а) М < 5000 г/моль -
истинные растворы – растворы низкомолекулярных соединений.
б) М > 5000 г/моль -
растворы высокомолекулярных соединений (ВМС).
Слайд 72. По наличию или отсутствию электролитической диссоциации
Растворы электролитов
— в которых вещества диссоциируют на ионы (соли, кислоты и
гидроксиды - КNО3, НСl, КОН).Растворы неэлектролитов – в которых вещества практически не диссоциируют в воде( растворы сахарозы, глюкозы, мочевины. )
Растворы амфолитов - веществ, которые могут диссоциировать и по кислотному, и по основному типу: Аl(ОН)3 ,глицин.
3. По концентрации
а) разбавленные растворы ~ до 10 %;
в) средней концентрации ~ 10 - 30%
б) концентрированные ~ 30 % и выше;
Слайд 8а) Ненасыщенный - раствор, в котором еще можно растворить добавочное
количество данного вещества.
б) Насыщенный - раствор, в котором данное
вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом. 4. По равновесному состоянию
Слайд 10в) пересыщенные –
содержащие значительно больше растворенного вещества чем его
требуется для насыщения при данной температуре
Пересыщенные растворы являются неустойчивыми
системами, способными к существованию только при отсутствии в системе твердых частиц растворенного вещества.Возможность длительного существования таких растворов объясняется трудностью первоначального возникновения мельчайших «зародышевых» кристалликов-центров кристаллизации.
Слайд 11Растворимость
Растворимость – способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях является его содержание в
насыщенном растворе.S – растворимость - масса вещества,
способная растворяться в 100 г растворителя (воды).
Слайд 13Растворение кристалла NaCl в воде:
ΔНкрист. - изменение энтальпии при
разрушении кристаллической решетки;
ΔНсольв. – изменение энтальпии за счет гидратации
ионов Сl- и Na+;Слайд 14Процентная –
масса вещества в 100 г раствора
Процентная концентрация выражается числом,
граммов растворенного вещества, содержащимся в 100 граммах раствора 95 г
Н2О + 5 г NaCl = 100 г5 %-ного раствора NaCl
Способы выражения концентраций растворов
Слайд 15«% - сотая часть »
2 мл 3% раствора –
60 мг
7 мл 4% раствора – 280 мг
25 мл 25%
раствора - ? мгmмг = Vмл∙ω%∙10
Слайд 162. Молярная концентрация – число моль вещества в 1 л
раствора
Задача:
Рассчитать
молярность 0.9% раствора NaCI. Слайд 18 Фактор эквивалентности – fэкв(Х) – число, обозначающее,
какая доля реальной частицы вещества Х эквивалентна одному иону водорода
в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. z – основность кислоты или кислотность основания данной кислотно-основной реакции, или число электронов, присоединяемых или теряемых частицей в данной окислительно-восстановительной реакции.
Эквивалент - реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону.
Слайд 20
5. Моляльность m - число моль вещества в
1000 г растворителя
(не зависит от температуры, поэтому
применяется
в клинической практике!)Слайд 21
6. Титр раствора Т – число грамм вещества
в 1 мл раствора (г/мл).
См = 1000 Т/ Мω% = 100 Т
7. Миллиграмм процент мг % - масса вещества в миллиграммах на 100 мл раствора (мг/ 100 мл – при пл.=1)
Слайд 22 Осмолярная концентрация - суммарное молярное количество всех
кинетически активных частиц, содержащихся в 1 литре раствора, независимо от
их формы, размера и природы.В организме человека осмолярность составляет примерно
290-300 мОсм/л (~0.29-0.30 Осм/л)
Осмолярность
(осмолярная концентрация)
Концентрационный гомеостаз – постоянство кислотности,
концентраций солей и органических веществ в жидких средах организма
Слайд 23Растворы электролитов
Электролиты – вещества, растворы и расплавы
которых проводят электрический ток вследствие диссоциации на ионы.
1. Сильные электролиты
диссоциируют полностью, необратимо, в одну ступень. a – активность
иона
f – коэффициент активности,
учитывающий межионное
взаимодействие
Слайд 25Ионная сила растворов
Ионная сила растворов - величина,
измеряемая полусуммой произведений концентраций всех находящихся в растворе ионов на
квадрат их заряда (понятие введено Г. Льюисом ) Ионная сила – удобная характеристика раствора, учитывающая взаимодействие ионов, что важно для изучения биологических систем и физиологических растворов, ионная сила которых, в том числе и 0.9% (0.15м) NaCI равна, как правило, 0.15 .
Ионная сила характеризует общее число ионных зарядов в единице объема, независимо от их знаков.
Размерность - обратна размерности объема.
Слайд 26Уравнение Дебая-Хюккеля
Дебай Петер
(24.III.1884–2.XI.1966)
Йозеф Хюккель
(9.09.1896— 16.021980)
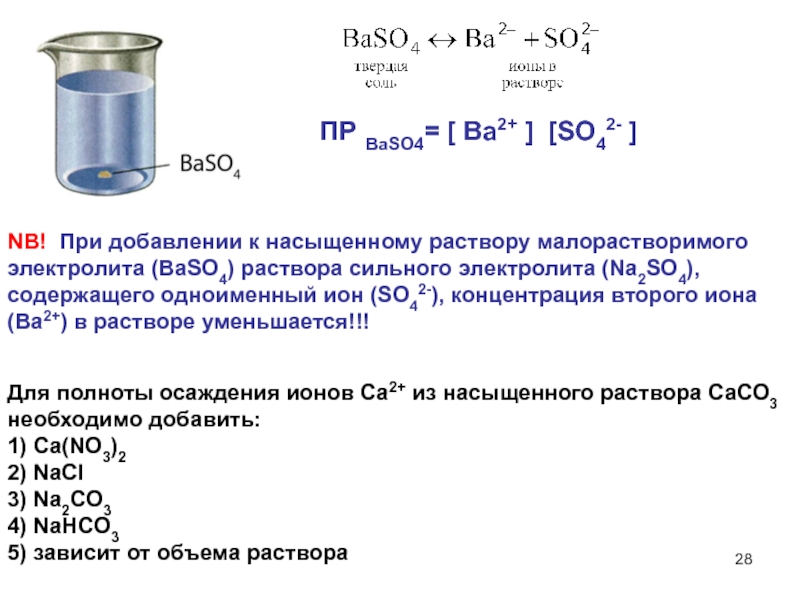
Слайд 27NB! При добавлении к насыщенному раствору малорастворимого электролита раствора сильного
электролита, не имеющего с ним общих ионов, повышается ионная сила
раствора, понижается коэффициент активности f, следовательно, произведение активностей ионов становится меньше ПР, т.е. раствор становится ненасыщенным, происходит растворение осадка. Это явление называется солевым эффектом.ПР ВаSO4= [ Ba2+ ] [SO42- ]
Добавление NaNO3 в насыщенный раствор AgCl:
1) способствует образованию осадка
2) препятствует образованию осадка
3) на образование осадка не влияет
4) зависит от формы сосуда
5) зависит от объема сосуда
Слайд 28NB! При добавлении к насыщенному раствору малорастворимого электролита (BaSO4) раствора
сильного электролита (Na2SO4), содержащего одноименный ион (SO42-), концентрация второго иона
(Ba2+) в растворе уменьшается!!!ПР ВаSO4= [ Ba2+ ] [SO42- ]
Для полноты осаждения ионов Са2+ из насыщенного раствора СаСО3 необходимо добавить:
1) Ca(NO3)2
2) NaCl
3) Na2CO3
4) NaHCO3
5) зависит от объема раствора
Слайд 292. Слабые электролиты диссоциируют обратимо, ступенчато.
α – степень диссоциации
Кд
– константа диссоциации
Степень диссоциации (ионизации) -
отношение числа молекул, распавшихся на ионы, к общему числу молекул в растворе.α зависит от:
Природы вещества и растворителя;
Концентрации;
Температуры;
Присутствия одноименного иона.
Слайд 30 Закон разбавления Оствальда
Нобелевская
премия (1909г)
« в знак признания работ по катализу, а также
за исследования основных принципов управленияхимическим равновесием и скоростями реакций»
С 1887 года работал в одной лаборатории с Вант-Гоффом, Аррениусом и Нернстом.
(02.09.1853 – 4.06.1932)
О нем говорили:
«Потолкуй с Оствальдом полчаса, и ты будешь иметь работу на полгода»
Слайд 322. Степень диссоциации кислоты HX равна 0,25. Какое суммарное число
ионов H+ и X- приходится в ее растворе на каждые
100 нераспавшихся молекул (ответ округлите до целого числа)?1) 16
2) 33
3) 67
4) 85
1. На каждые 20 нераспавшихся молекул кислоты HX приходится 5 ионов H+ и 5 ионов X-. Укажите степень диссоциации кислоты:
1) 0,05
2) 0,10
3) 0,15
4) 0,20






















![1
Растворы.
Способы выражения концентраций.
Сильные и слабые Задача: Рассчитать концентрацию ионов водорода [Н+] в 9% растворе уксуса (пл.=1), Кд=1.75∙10-5. Задача: Рассчитать концентрацию ионов водорода [Н+] в 9% растворе уксуса (пл.=1), Кд=1.75∙10-5.](/img/thumbs/6001da5efa85108fdb50ff38bda34874-800x.jpg)
![1
Растворы.
Способы выражения концентраций.
Сильные и слабые Задача: Рассчитать концентрацию ионов водорода [Н+] в 9% растворе уксуса (пл.=1)Ответ: [Н+]=5.12∙10-3 моль-экв/л Задача: Рассчитать концентрацию ионов водорода [Н+] в 9% растворе уксуса (пл.=1)Ответ: [Н+]=5.12∙10-3 моль-экв/л](/img/thumbs/164048c22afb353a054ae5024ec4472c-800x.jpg)