Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1.Условия протекания химических реакций между растворами электролитов до конца
Содержание
- 1. 1.Условия протекания химических реакций между растворами электролитов до конца
- 2. Условия протекания химических реакций между растворами электролитов
- 3. Условия протекания химических реакций между растворами электролитов
- 4. Кислоты, их классификация и свойства Кислотами называются сложные
- 5. Кислоты, их классификация и свойства Кислоты БескислородныеHFHCl КислородсодержащиеH2SO4H3PO4
- 6. Кислоты, их классификация и свойства
- 7. Кислоты, их классификация и свойства Часть молекулы кислоты без водорода называется кислотным остатком.Простые -Cl, -Br, -IСложныеSO3, -PO4, -SiO3
- 8. Кислоты, их классификация и свойства Стабильность Стабильные H2SO4 H3PO4 HClНестабильные H2CO3 H2SiO3 H2SO3
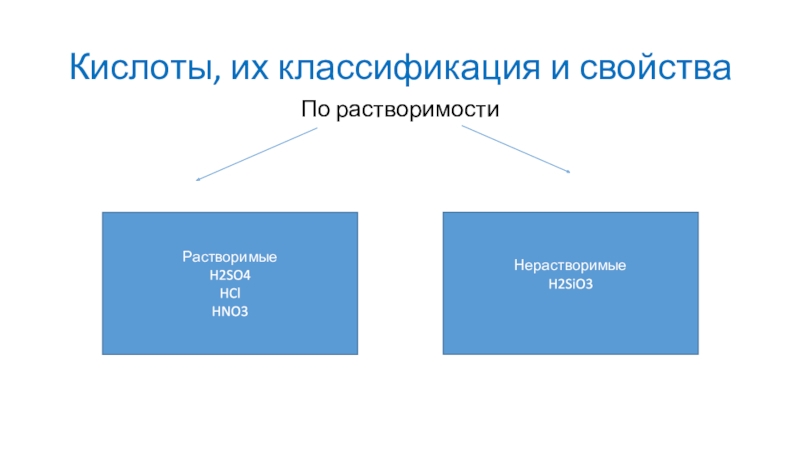
- 9. Кислоты, их классификация и свойства По растворимости Растворимые H2SO4 HCl HNO3Нерастворимые H2SiO3
- 10. Кислоты, их классификация и свойства Правила техники
- 11. Кислоты, их классификация и свойства
- 12. Кислоты, их классификация и свойства Химические свойства
- 13. Слайд 13
- 14. Кислоты, их классификация и свойства Химические свойства МеталлхОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)CuO + H2SO4 = Cu SO4 + H2O
- 15. Слайд 15
- 16. Кислоты, их классификация и свойства Химические свойства
- 17. Слайд 17
- 18. Кислоты, их классификация и свойства Реагируют с
- 19. Слайд 19
- 20. Кислоты, их классификация и свойства Разложение кислородсодержащих
- 21. Слайд 21
- 22. Домашние задание №1. Распределите химические формулы кислот в
- 23. Слайд 23
- 24. Спасибо за внимание
- 25. Скачать презентанцию
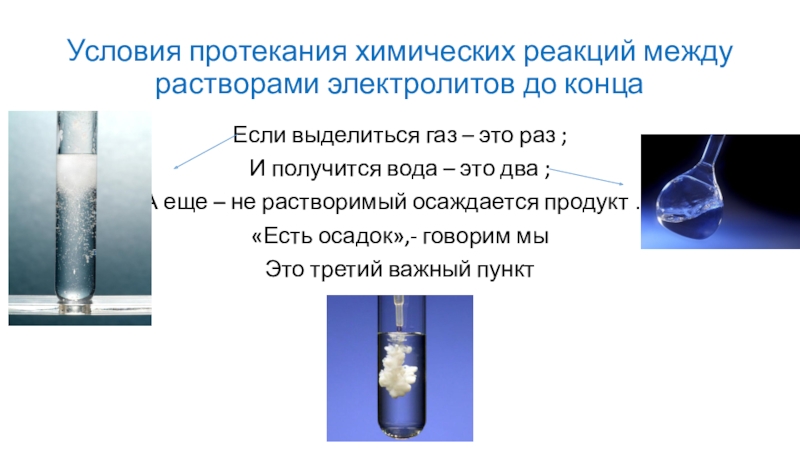
Условия протекания химических реакций между растворами электролитов до концаЕсли выделиться газ – это раз ;И получится вода – это два ;А еще – не растворимый осаждается продукт …«Есть осадок»,- говорим мы
Слайды и текст этой презентации
Слайд 11.Условия протекания химических реакций между растворами электролитов до конца . 2.Кислоты,
их классификация и свойства
Слайд 2Условия протекания химических реакций между растворами электролитов до конца
Если выделиться
газ – это раз ;
И получится вода – это два
;А еще – не растворимый осаждается продукт …
«Есть осадок»,- говорим мы
Это третий важный пункт
Слайд 3Условия протекания химических реакций между растворами электролитов до конца
Химик «правила
обмена» не забудет никогда :
В результате непременно будет газ или
вода Выпадет еще осадок - вот тогда у нас порядок !
Слайд 4Кислоты, их классификация и свойства
Кислотами называются сложные вещества, в состав
молекул которых входят атомы водорода, способные замещаться или обмениваться на
атомы металла и кислотный остаток.Слайд 5Кислоты, их классификация и свойства
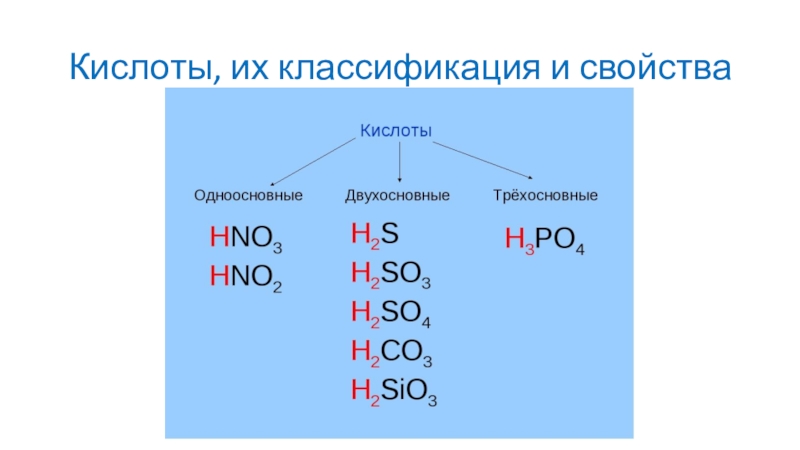
Кислоты
Бескислородные
HF
HCl
Кислородсодержащие
H2SO4
H3PO4
Слайд 7Кислоты, их классификация и свойства
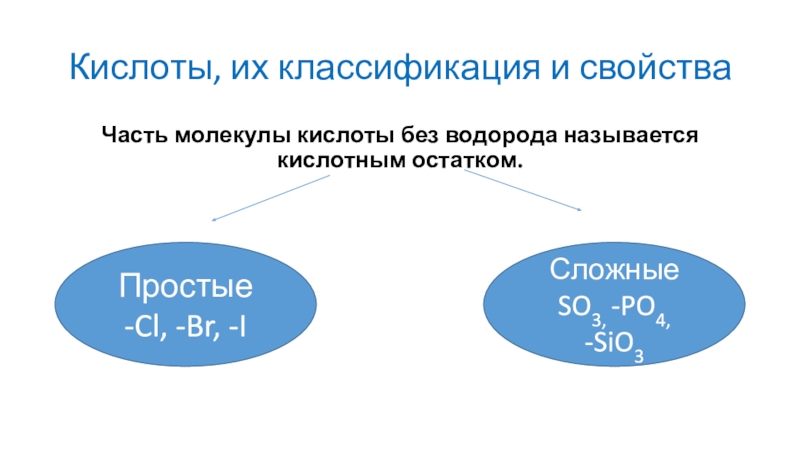
Часть молекулы кислоты без водорода
называется кислотным остатком.
Простые
-Cl, -Br, -I
Сложные
SO3, -PO4,
-SiO3
Слайд 8Кислоты, их классификация и свойства
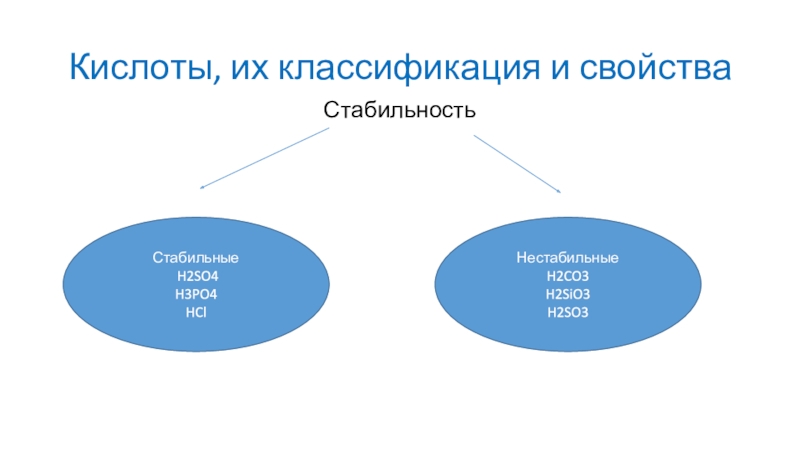
Стабильность
Стабильные
H2SO4
H3PO4
HCl
Нестабильные
H2CO3
H2SiO3
H2SO3
Слайд 9Кислоты, их классификация и свойства
По растворимости
Растворимые
H2SO4
HCl
HNO3
Нерастворимые
H2SiO3
Слайд 10Кислоты, их классификация и свойства
Правила техники безопасности при работе
с кислотами
1.При разбавлении кислот водой следует кислоту тонкой струйкой при
перемешивании наливать в воду, а не наоборот. 2. Если случайно кислота попадет на руку или на одежду, то немедленно смойте ее большим количеством воды, а потом обработайте место раствором гидрокарбоната натрия (соды).
Слайд 12Кислоты, их классификация и свойства
Химические свойства
МЕТАЛЛ + КИСЛОТА
= СОЛЬ + H2
(р. замещения)
Реагируют с металлами в ряду активности
до H2 (искл. HNO3 –азотная кислота) Zn + 2 HCl = ZnCl2 + H2
Слайд 14Кислоты, их классификация и свойства
Химические свойства
МеталлхОу + КИСЛОТА= СОЛЬ + Н2О
(р. обмена)
CuO + H2SO4 = Cu SO4 + H2O
Слайд 16Кислоты, их классификация и свойства
Химические свойства
Реагируют с
основаниями
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
H3PO4 + 3NaOH = Na3PO4 + 3H2O
Слайд 18Кислоты, их классификация и свойства
Реагируют с солями слабых, летучих
кислот - если образуется кислота, выпадающая в осадок или выделяется газ:
2
NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)Сила кислот уменьшается
каждая предыдущая кислота может вытеснить из соли последующую
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 .
Слайд 20Кислоты, их классификация и свойства
Разложение кислородсодержащих кислот при нагревании
(
искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная
и сернистая) – разлагаются на газ и воду: H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
Сероводородная кислота в продуктах выделяется в виде газа:
СаS + 2HCl = H2S↑ + CaCl2
Слайд 22Домашние задание
№1. Распределите химические формулы кислот в таблицу. Дайте им
названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2 ,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
№2. Составьте уравнения реакций:
Ca + HCl
Na + H2SO4
Al + H2S
Ca
+ H3PO4
Назовите продукты реакции.Слайд 23
Домашние задание
№3. Составьте уравнения реакций, назовите продукты:
Na2O +
H2CO3ZnO + HCl
CaO + HNO3
Fe2O3 + H2SO4
№4. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO3
NaOH + H2SO3
Ca(OH)2 + H2S
Al(OH)3 + HF
HCl + Na2SiO3
H2SO4 + K2CO3
HNO3 + CaCO3
Назовите продукты реакции.
Параграф 39, сделать карточку «типичные реакции кислот»