разных фазах.
По виду участвующих в процессе фаз различают следующие
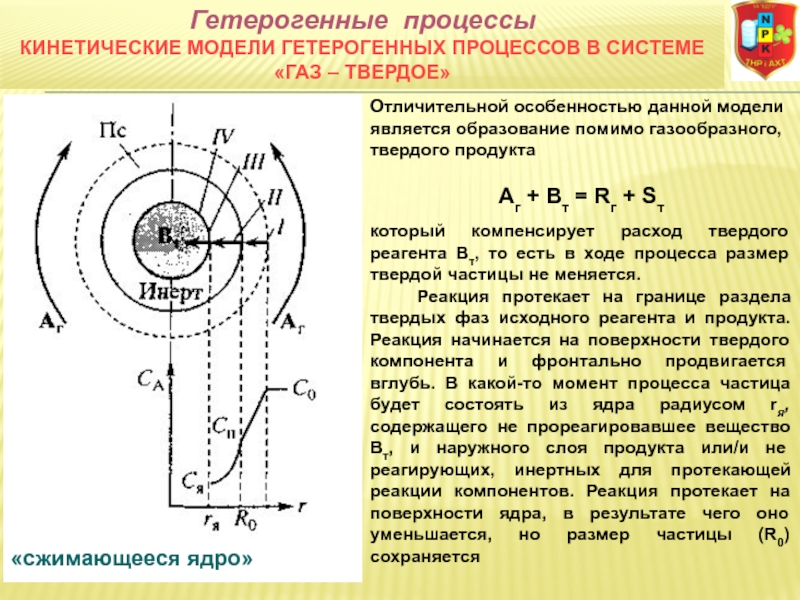
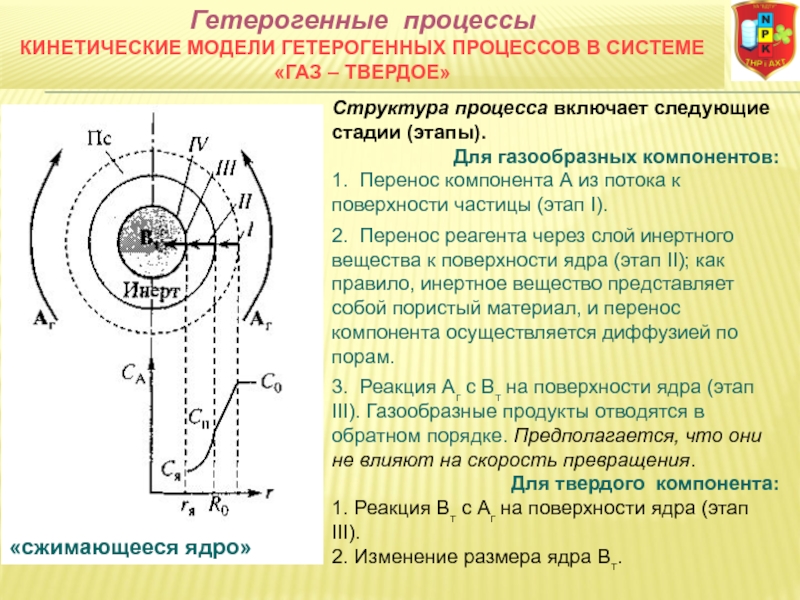
гетерогенные системы: а) «газ-твердое» (Г-Т) (адсорбция и десорбция газов, обжиг руд, окисление металлов, восстановление твердых оксидов, горение твердых топлив);
2FеS (тв.) + ЗО2 (г.) = 2FeО (тв.) + 2SО2 (г.)
4FеS2, (тв.) + 11O2 (г.) = 8SО2 (г.) + 2Fе2О3 (тв.)
С (тв.) + Н20 (г.) = СО (г.)+ Н2 (г.)
б) «жидкость—твердое» (Ж-Т) (адсорбция, растворение, выщелачивание, экстракция, кристаллизация);
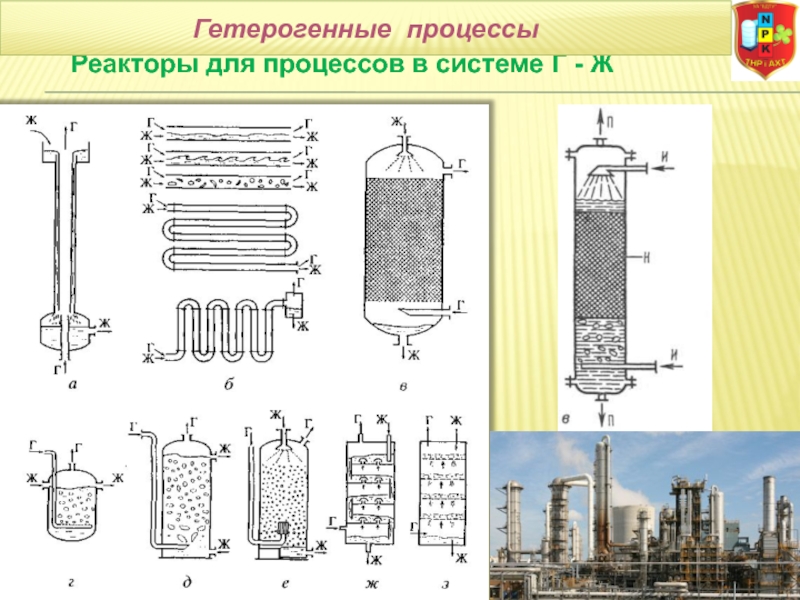
в) «газ-жидкость» (Г-Ж) (абсорбция, конденсация, перегонка жидких смесей, дистилляция и ректификация);
г) несмешивающаяся система «жидкость—жидкость» (Ж-Ж) (жидкостная экстракция);
д) система «твердое—твердое» (Т-Т) (спекание, процессы получения цемента и керамики, высокотемпературный синтез неорганических материалов);
е) многофазные системы — «газ—жидкость—твердое», «жидкость-жидкость (несмешивающиеся) – газ»
Гетерогенные процессы