Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
279 химия 21.10
Содержание
- 1. 279 химия 21.10
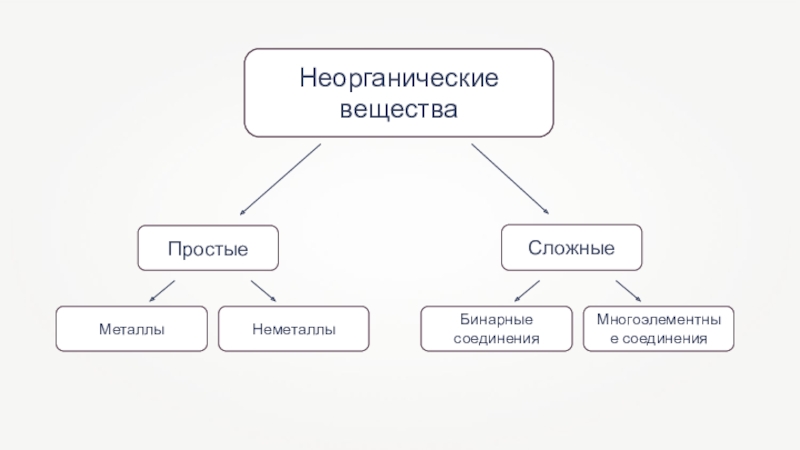
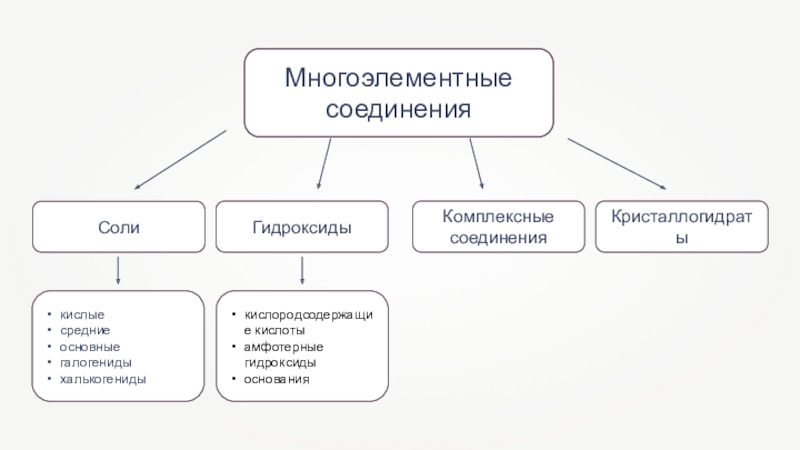
- 2. Неорганические вещества
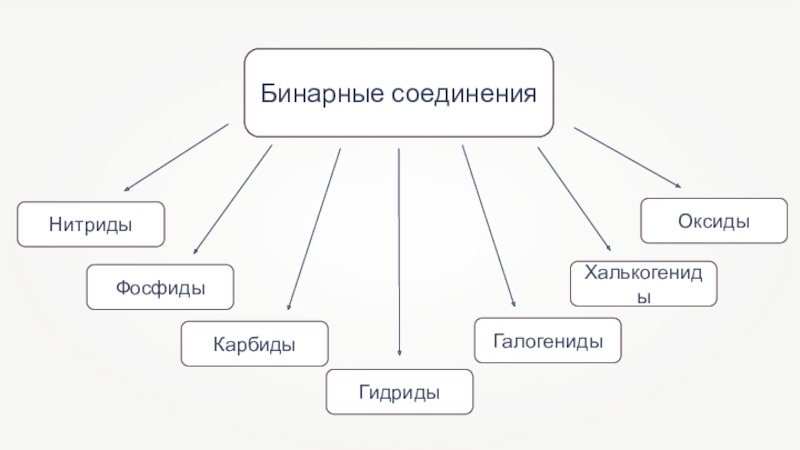
- 3. Бинарные соединения
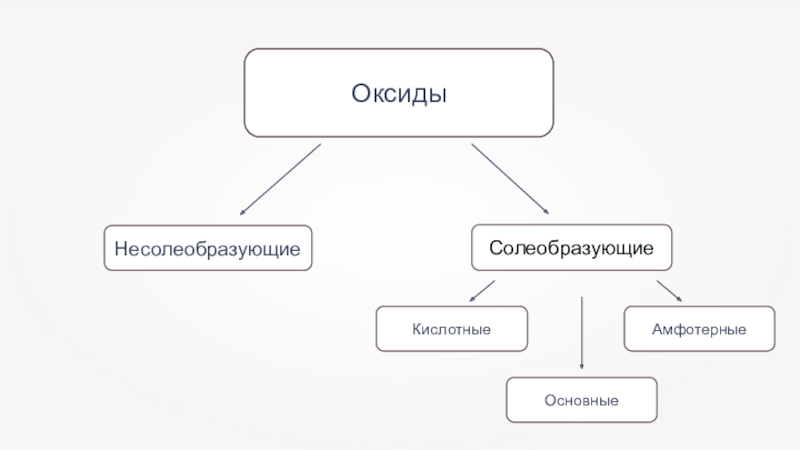
- 4. Оксиды
- 5. Многоэлементные соединения
- 6. Металлы
- 7. Слайд 7
- 8. Взаимодействие металлов с неметалламиНазвание продукта:неметалл ид + металл а (степень окисления, если переменная)
- 9. Взаимодействие металлов с кислородом
- 10. Взаимодействие металлов с кислородом4Li + O2 = 2Li2O2Na + Cl2 = 2NaCl2Na + O2 = Na2O2
- 11. Взаимодействие металлов с водой2K + 2H2O = 2KOH + H2↑Mg + 2H2O = Mg(OH)2 + H2↑
- 12. Условия взаимодействия металлов с растворами кислот– металл
- 13. Взаимодействие металлов с растворами кислотZn + 2HCl
- 14. Условия взаимодействия металлов с растворами солей– металл
- 15. 2Al + 3CuCl2 = 2AlCl3 + 3Cu↓Mg
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. 2Fe + O2 = 2FeO4Fe + 3O2
- 21. Электрохимическая коррозияFe0 + 2H+ = Fe2+ + H20
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Скачать презентанцию
Неорганические вещества
Слайды и текст этой презентации
Слайд 8Взаимодействие металлов с неметаллами
Название продукта:
неметалл ид + металл а (степень
окисления, если переменная)
Слайд 12Условия взаимодействия металлов с растворами кислот
– металл должен находиться в
ряду активности металлов левее водорода;
– щелочные металлы не рекомендуется
использовать в данных реакциях, так как они будут взаимодействовать ещё и с водой;
– продуктом реакции должна быть растворимая соль, так при образовании осадка дальнейшее протекание реакции невозможно;
– в случае серной и азотной кислот есть свои особенности взаимодействия.
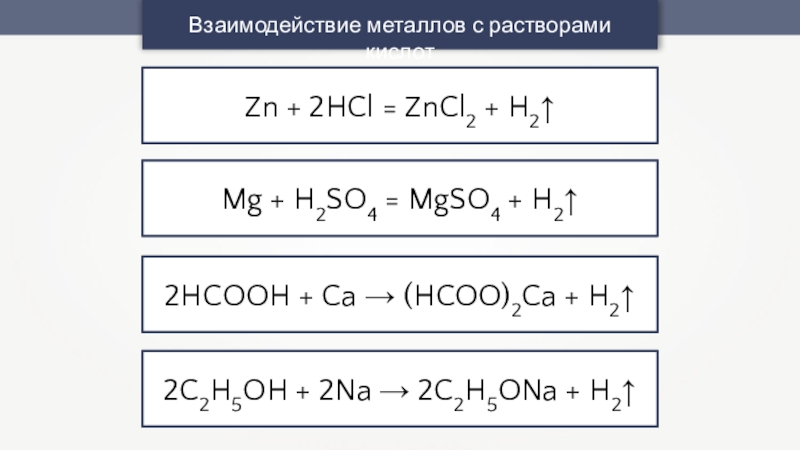
Слайд 13Взаимодействие металлов с растворами кислот
Zn + 2HCl = ZnCl2 +
H2↑
Mg + H2SO4 = MgSO4 + H2↑
2HCOOH + Ca →
(HCOO)2Ca + H2↑2C2H5OH + 2Na → 2C2H5ONa + H2↑
Слайд 14Условия взаимодействия металлов с растворами солей
– металл должен находиться в
ряду активности левее металла, который образует соль;
– в результате
взаимодействия должна образоваться растворимая соль, так как при образовании осадка реакция прекращается; – не рекомендуется использовать щелочные металлы, ввиду того, что они будут взаимодействовать ещё
и с водой.
Ме + соль = новая соль + новый Ме
Слайд 152Al + 3CuCl2 = 2AlCl3 + 3Cu↓
Mg + Pb(NO3)2 =
Mg(NO3)2 + Pb↓
Условия взаимодействия металлов с растворами солей
Слайд 202Fe + O2 = 2FeO
4Fe + 3O2 = 2Fe2O3
8Fe +
6NO2 = 4Fe2O3 +3N2
Химическая коррозия
2Fe + 2H2S + O2 =
2FeS + 2H2O2Fe + 3Cl2 = 2FeCl3
Fe + 2HBr = FeBr2 + H2↑