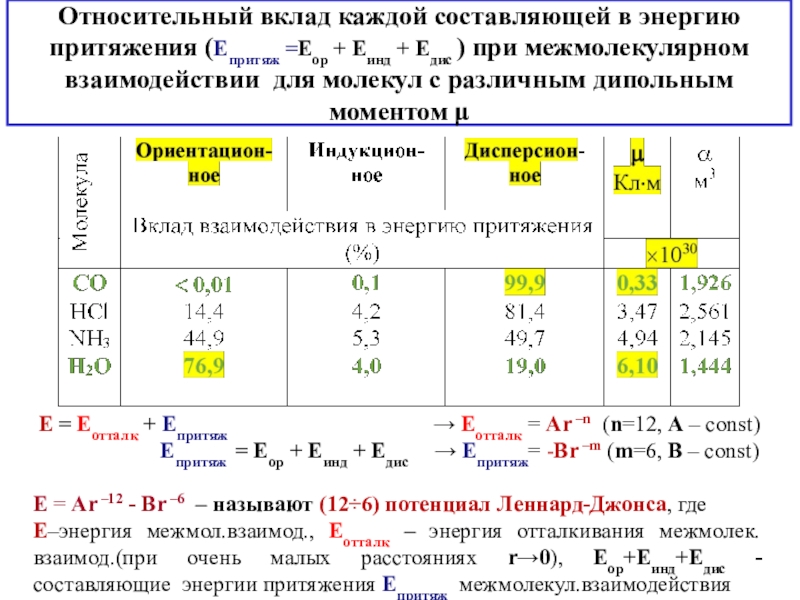
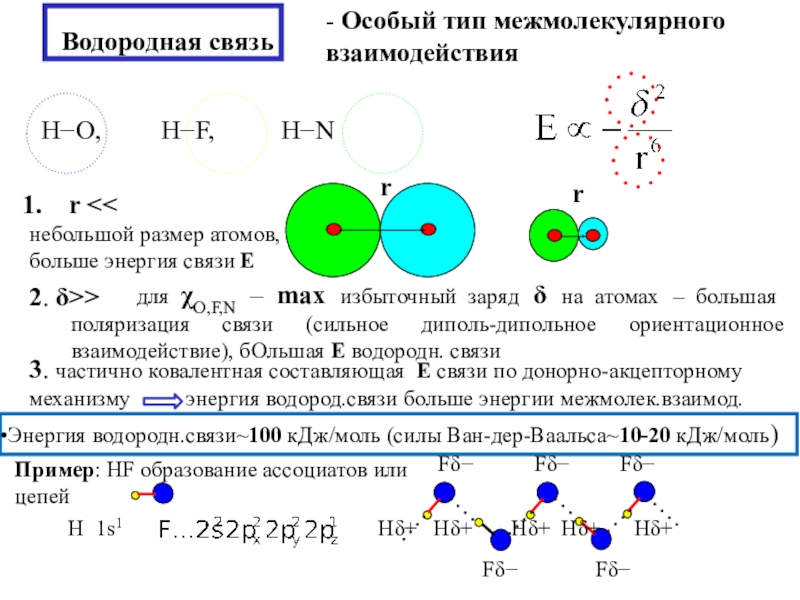
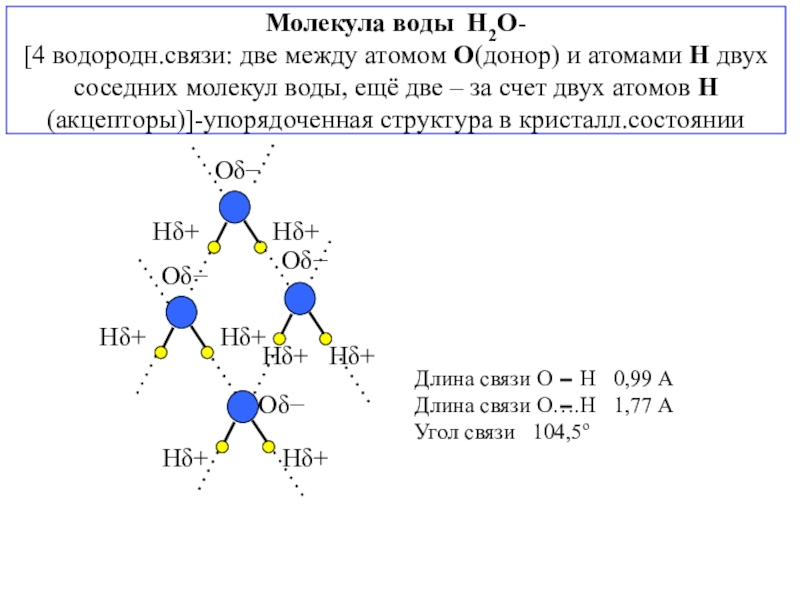
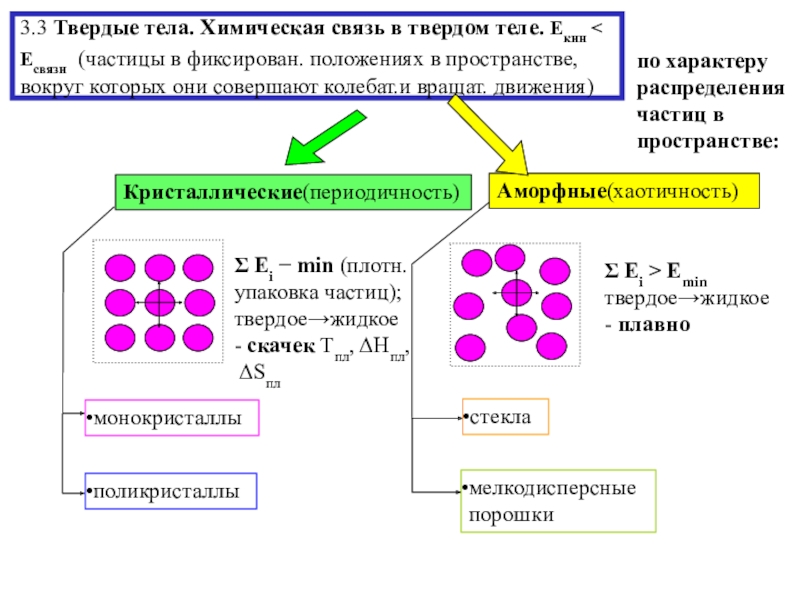
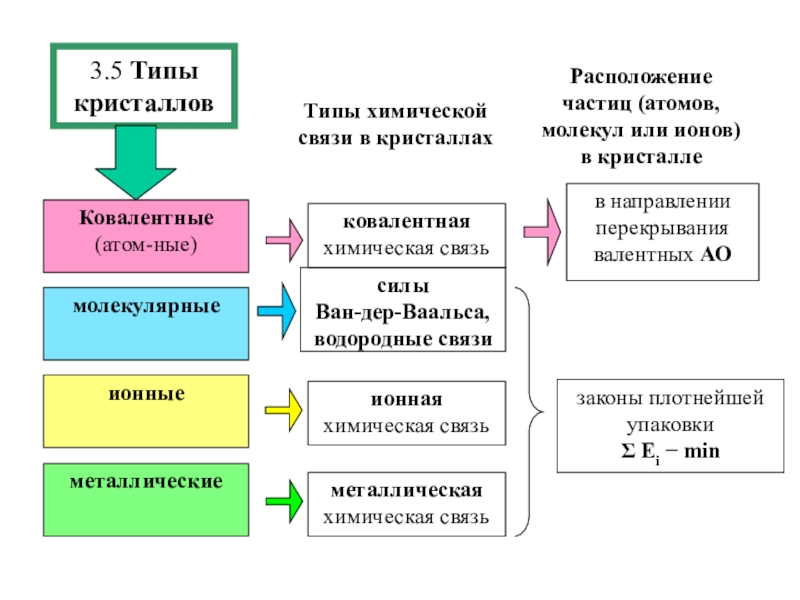
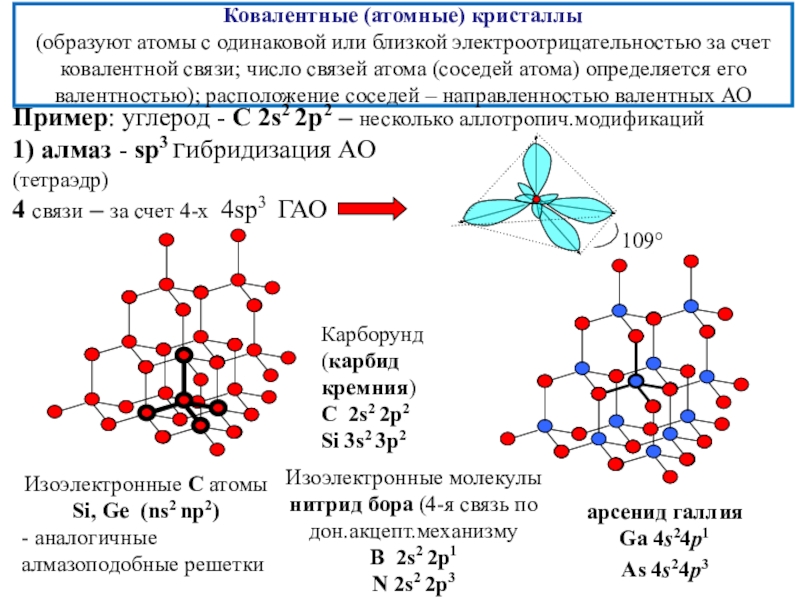
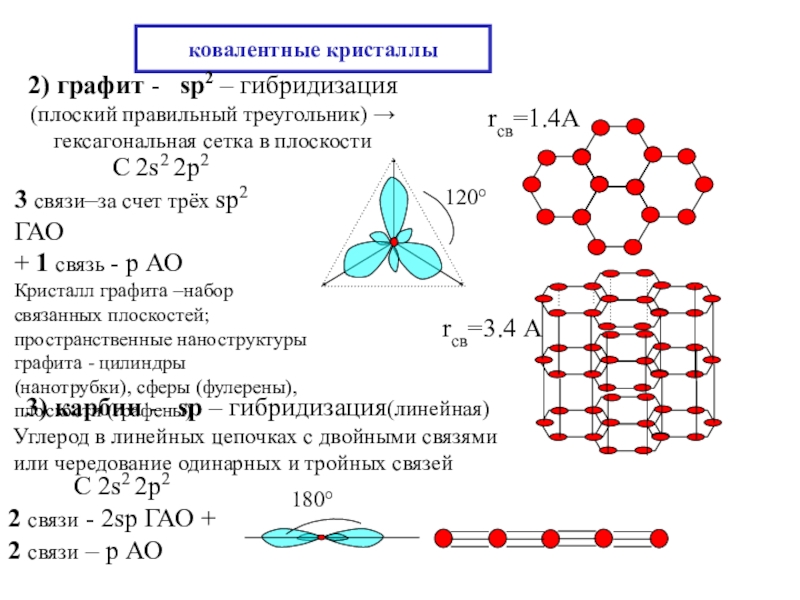
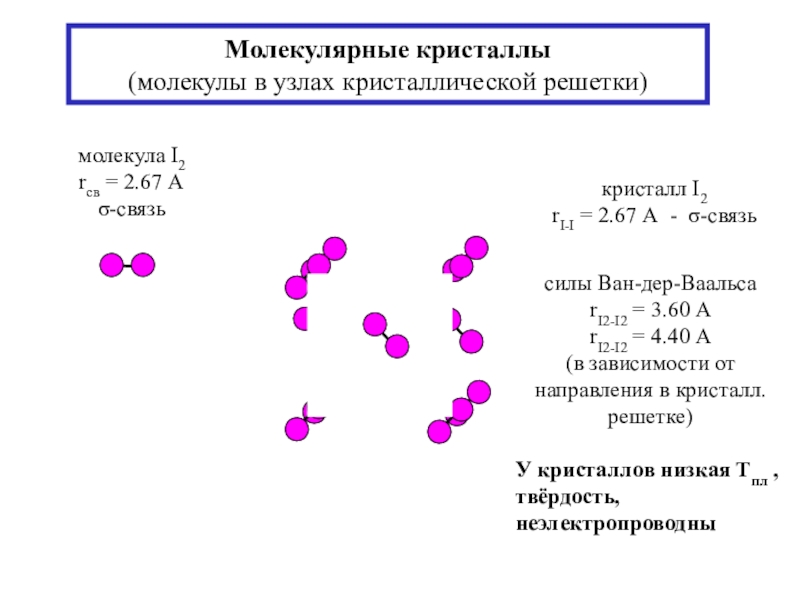
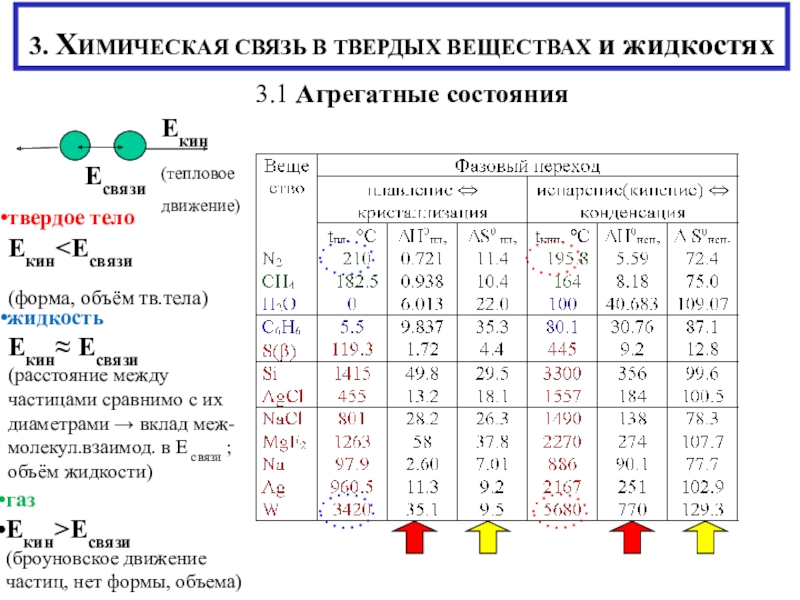
состояния
твердое тело ЕкинЕсвязи
(форма, объём тв.тела)
жидкость
Екин Есвязи
(расстояние между частицами сравнимо с их диаметрами → вклад меж- молекул.взаимод. в Е связи ;
объём жидкости)
газ
Екин>Есвязи
(броуновское движение частиц, нет формы, объема)

![3-ТВЕРДОЕ ТЕЛО Полярность связиДипольный момент(мера полярности связи) = l[Клм], Дебай (D)1 Полярность связиДипольный момент(мера полярности связи) = l[Клм], Дебай (D)1 D = 3,3310-30 Клм-заряд, l-длина](/img/tmb/7/643266/2cffb7edb6adc34382aad2a907d479c9-800x.jpg)

![3-ТВЕРДОЕ ТЕЛО Силы Ван-дер-Ваальса [межмолекулярное взаимодействие - притяжение диполей (без обмена электронами)]1. Ориентационный Силы Ван-дер-Ваальса [межмолекулярное взаимодействие - притяжение диполей (без обмена электронами)]1. Ориентационный эффект (Кьезома) [взаимодействие(электростатическое притяжение) пост.диполь –](/img/tmb/7/643266/314285f0a7e1c151a55b14d3acf3892a-800x.jpg)