Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
3.2.2. Непредельные углеводороды
Содержание
- 1. 3.2.2. Непредельные углеводороды
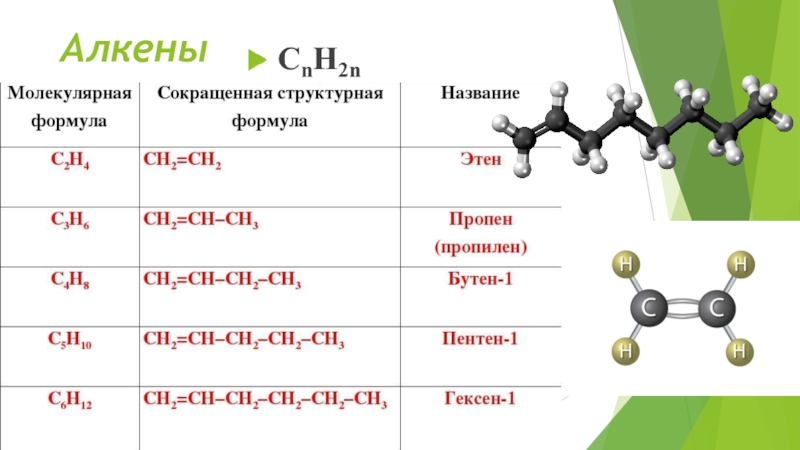
- 2. Алкены
- 3. Особенности строения алкеновДва соседних атома углерода в
- 4. Изомерия алкенов Структурная изомерия: *изомерия
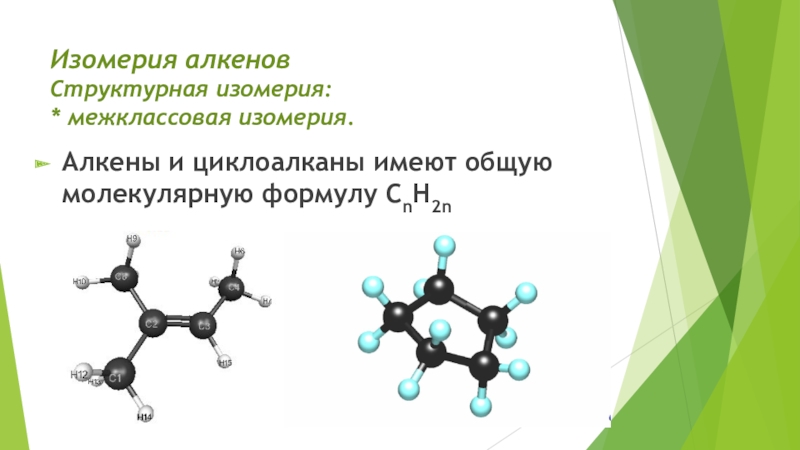
- 5. Изомерия алкенов Структурная изомерия: * межклассовая изомерия. Алкены и циклоалканы имеют общую молекулярную формулу СnH2n
- 6. Пространственная изомерия *цис-транс-изомерияПорядок соединения атомов в молекуле
- 7. Химические свойства алкенов Алкены химически активны. Почему?Легко
- 8. Характерной реакцией алкенов является реакция электрофильного
- 9. Правило Марковникова. Если молекула алкена несимметрична, а
- 10. Реакция полимеризации
- 11. Нахождение в природе и получение
- 12. Применение алкеновАлкены используют для получения: полимеровгалогенпроизводных (растворители)спиртов и т.д.
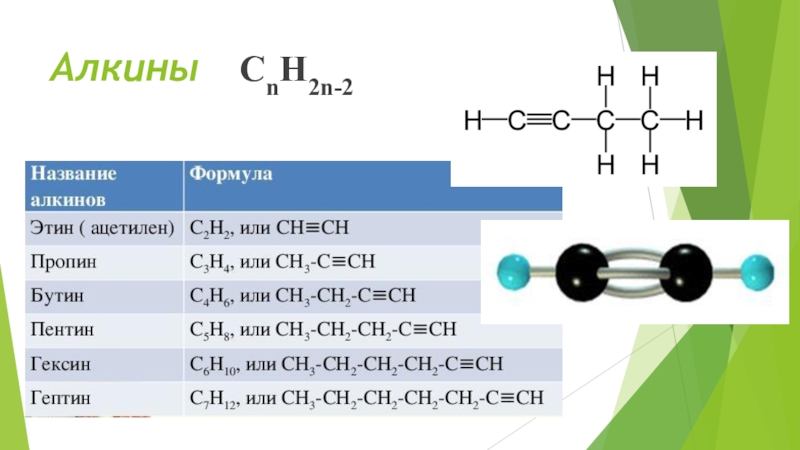
- 13. Алкины СnH2n-2
- 14. Особенности строения алкиновДва соседних атома углерода в
- 15. Как называются вещества, модели молекул которых изображены
- 16. Изомерия алкинов: структурная
- 17. Химические свойства алкенов Алкены химически активны.
- 18. Характерной реакцией алкинов является реакция присоединения АЕ.
- 19. Особым образом протекает реакция гидратация алкинов (реакция
- 20. Особенностью алкинов является способность проявлять слабые кислотные
- 21. Реакция полимеризацииПолимеризация алкинов в присутствии катализаторов дает
- 22. Нахождение в природе и получениеВстречаются ли алкины
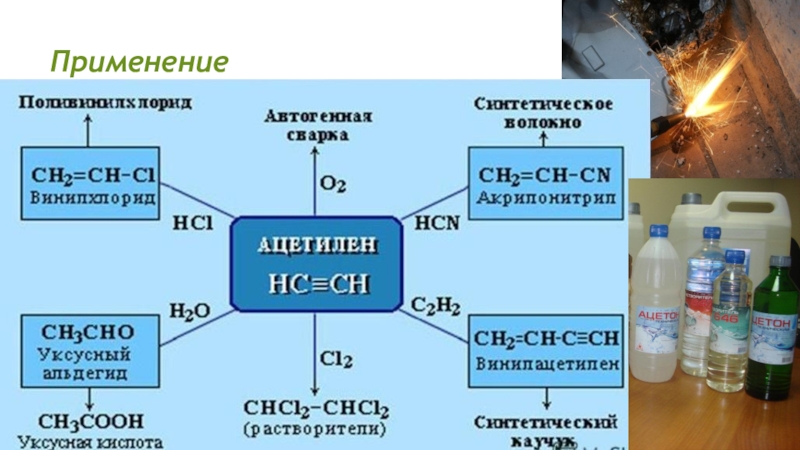
- 23. Применение
- 24. Алкадиены имеют две двойные связи
- 25. Классификация диеновЕсли эти двойные связи разделены двумя
- 26. Изомерия алкадиеновКакие виды изомерии возможны для этого пентадиена?Напишите формулы трех из них и назовите эти вещества.
- 27. Изомерия сопряженных диенов
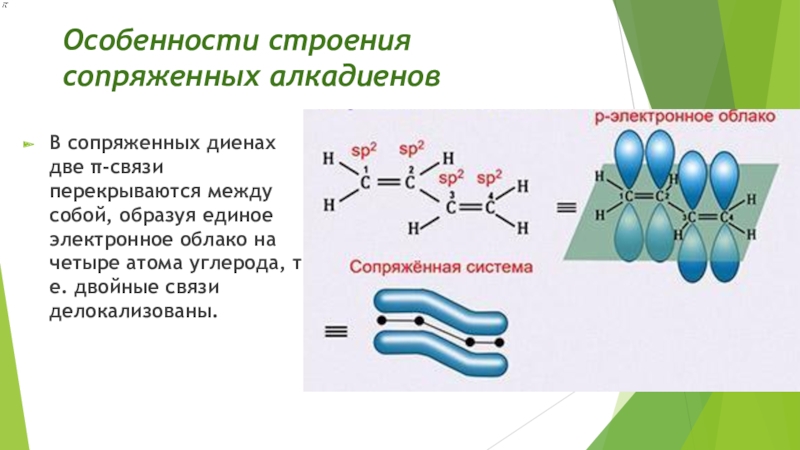
- 28. Особенности строения сопряженных алкадиеновВ сопряженных диенах две
- 29. Реакция окисления
- 30. Реакции присоединения
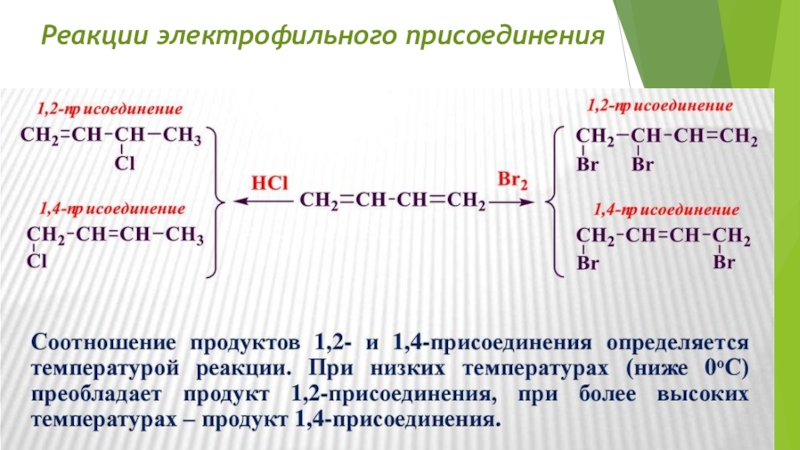
- 31. Реакции электрофильного присоединения
- 32. Реакция полимеризации – важнейшее свойство сопряженных диенов.
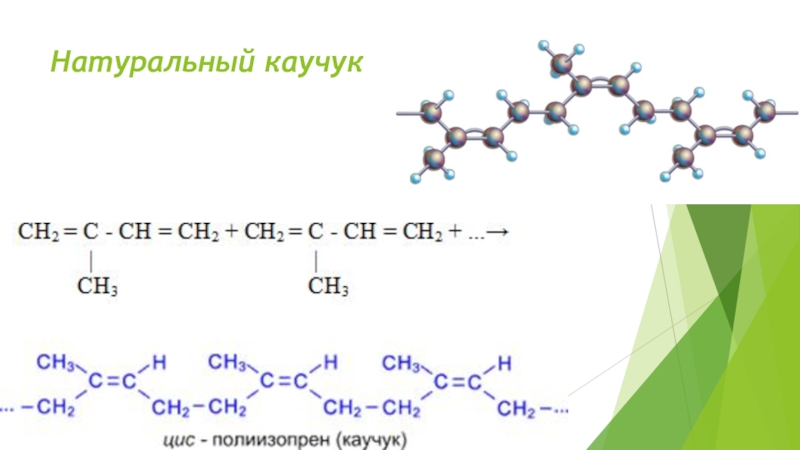
- 33. Натуральный каучук
- 34. Слайд 34
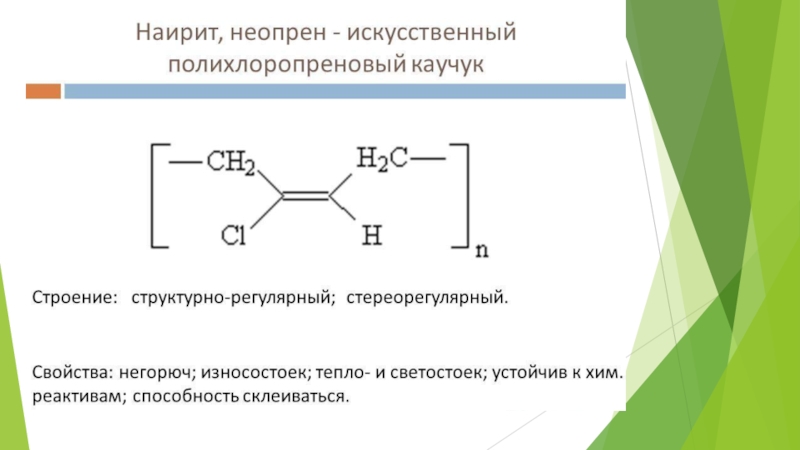
- 35. Первый синтетический каучук СК-1
- 36. Бутадиеновые каучуки – группа синтетических каучуков, продуктов
- 37. Слайд 37
- 38. РезинаВ процессе вулканизации каучука происходит сшивание линейных
- 39. Скачать презентанцию
Алкены
Слайды и текст этой презентации
Слайд 13.2.2. Непредельные углеводороды.
Непредельные углеводороды.
Ненасыщенные углеводороды
Несколько гомологических рядов:
алкены
Слайд 3Особенности строения алкенов
Два соседних атома углерода в молекуле находятся в
состоянии sp2-гибридизации
-связь в молекуле этена образована за счет перекрывания
гибридных электронных орбиталей на прямой соединяющей центры атомов С и НЭти связи направлены к вершинам правильного треугольника и угол между ними – 120о.
- связь образована за счет перекрывания негибридных р-орбиталей вне прямой соединяющей центры атомов, перпендикулярно плоскости в которой лежат связи.
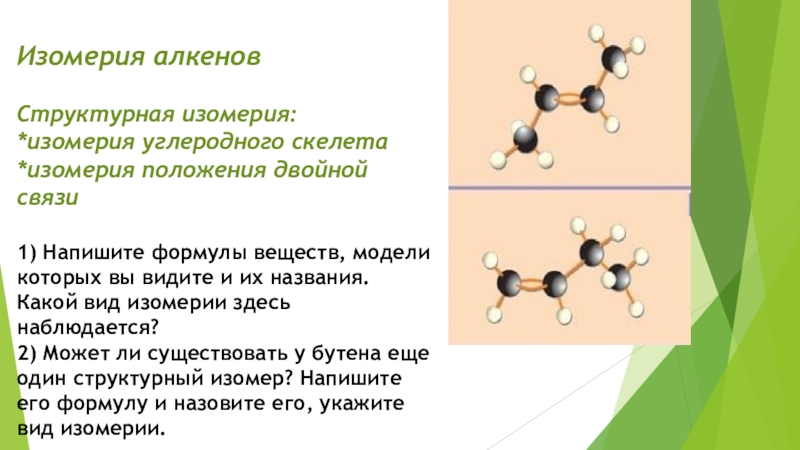
Слайд 4Изомерия алкенов Структурная изомерия: *изомерия углеродного скелета *изомерия положения двойной связи 1)
Напишите формулы веществ, модели которых вы видите и их названия.
Какой вид изомерии здесь наблюдается? 2) Может ли существовать у бутена еще один структурный изомер? Напишите его формулу и назовите его, укажите вид изомерии.Слайд 5Изомерия алкенов
Структурная изомерия:
* межклассовая изомерия.
Алкены и циклоалканы имеют
общую молекулярную формулу СnH2n
Слайд 6Пространственная изомерия
*цис-транс-изомерия
Порядок соединения атомов в молекуле этих изомеров одинаков, но
в пространстве замещающие группы в молекулах изомеров располагаются по разному.
В цис-изомерах заместители у разных атомов углерода находятся по одну сторону воображаемой плоскости, проходящей через атомы углерода с двойной связью, в транс-изомерах заместители находятся по разные стороны этой плоскости.
Слайд 7Химические свойства алкенов
Алкены химически активны. Почему?
Легко окисляются. Горят на воздухе
светящимся пламенем.
СН2=СН2 + О2 → СО2+ H2О
При
мягком окислении (+ разб. раствор марганцовки при н.у.) из них образуются двухатомные спирты.СН2=СН2 + KMnO4 + H2О => СН2OH-СН2OH + MnO2↓ +KOH , эту реакцию можно использовать как качественную реакцию на двойную связь
При кипячении с концентрированным раствором марганцовки обычно образуются карбоновые кислоты и идет разрыв углеродной цепи по месту двойной связи
Слайд 8Характерной реакцией алкенов является реакция электрофильного присоединения АЕ.
А) Галогенирование (при н.у.)
СН2=СН2 + Cl2 => CH2Сl-CН2Cl
СН2=СН-СН3
+ Br2 => CH2Br-CНBr-CH3, эту реакцию можно использовать для определения наличия двойной связи в молекуле т.к. происходит обесцвечивание бурого раствора бромной воды при н.у.Б) Гидрирование
СН2=СН2 + Н2 => CH3-CН3
СН2=СН-СН3 + H2 => CH3-CН2-CH3
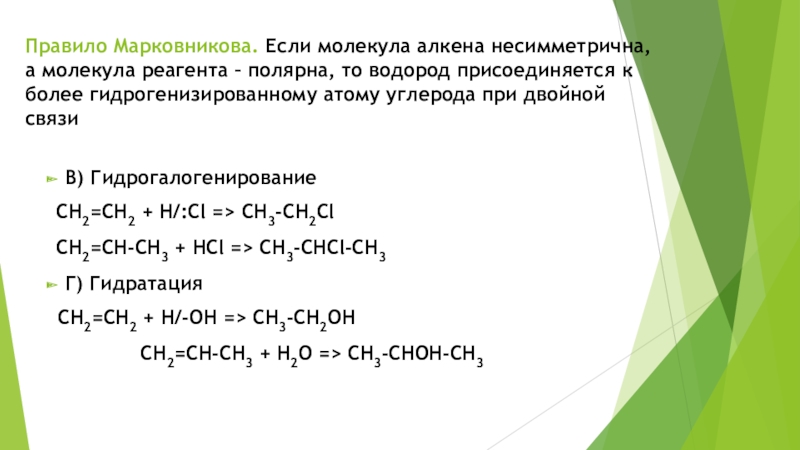
Слайд 9Правило Марковникова. Если молекула алкена несимметрична, а молекула реагента –
полярна, то водород присоединяется к более гидрогенизированному атому углерода при
двойной связиВ) Гидрогалогенирование
СН2=СН2 + H/:Cl => CH3-CН2Cl
СН2=СН-СН3 + HCl => CH3-CНCl-CH3
Г) Гидратация
СН2=СН2 + H/-ОН => CH3-CН2ОН
СН2=СН-СН3 + H2О => CH3-CНОН-CH3
Слайд 12Применение алкенов
Алкены используют для получения:
полимеров
галогенпроизводных (растворители)
спиртов и т.д.
Слайд 14Особенности строения алкинов
Два соседних атома углерода в молекуле находятся в
состоянии sp-гибридизации
-связь в молекуле этина образована за счет перекрывания
гибридных электронных орбиталей на прямой соединяющей центры атомов С и НЭти связи находятся на одной прямой и угол между ними – 180о.
- связь образована за счет перекрывания 2-х негибридных р-орбиталей вне прямой соединяющей центры атомов, перпендикулярно прямой в которой лежат связи.
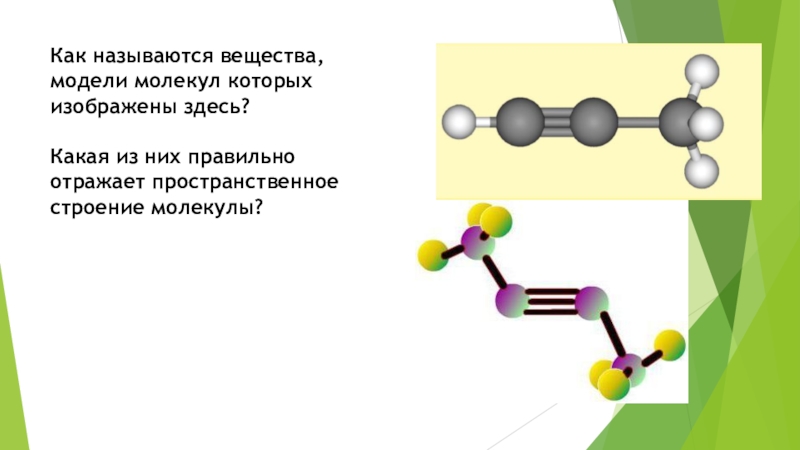
Слайд 15Как называются вещества, модели молекул которых изображены здесь? Какая из них
правильно отражает пространственное строение молекулы?
Слайд 17Химические свойства алкенов Алкены химически активны. Но менее активны чем алкены.
Почему?
1) ацетилен и его гомологи горят коптящим пламенем. Это пламя
превращается в ослепительно яркое если использовать кислородное дутье. При нагревании без доступа воздуха алкины разлагаются на простые вещества (реакция дегидрирования). Алкины легко окисляются марганцовкой. Раствор марганцовки обесцвечивается, что можно использовать для обнаружения тройной связи. При окислении алкинов рвется не только π-связь, но и σ- связь, и образуются две карбоновые кислоты.
Слайд 18Характерной реакцией алкинов является реакция присоединения АЕ.
Для них характерны реакции электрофильного присоединения (водорода, галогеноводорода или
галогенов), но они протекают при более жестких условиях и в две стадии. Сначала рвется одна -связь, а потом вторая. Например, они также, как и алкены, обесцвечивают бромную воду.Слайд 19Особым образом протекает реакция гидратация алкинов (реакция Кучерова).
Она катализируется
солями ртути (II). На первой стадии реакции образуются непредельные спирты,
которые называют виниловыми спиртами или енолами.Если двойная связь и гидроксогруппа оказывается у одного атома углерода, это делает молекулу неустойчивой, и происходит процесс изомеризации.
Слайд 20Особенностью алкинов является способность проявлять слабые кислотные свойства
Это способность
появляется если тройная связь находится в начале цепи.
Алкины способны
образовывать соединения (карбид кальция, карбид серебра): СаС2 или Ag2C2. Но эти соединения очень нестойкие и легко разлагаются водой. Реакцию с нитратом серебра можно использовать как качественную на ацетилен.СаС2 + H2О → С2Н2 ↑+ Са(ОН)2
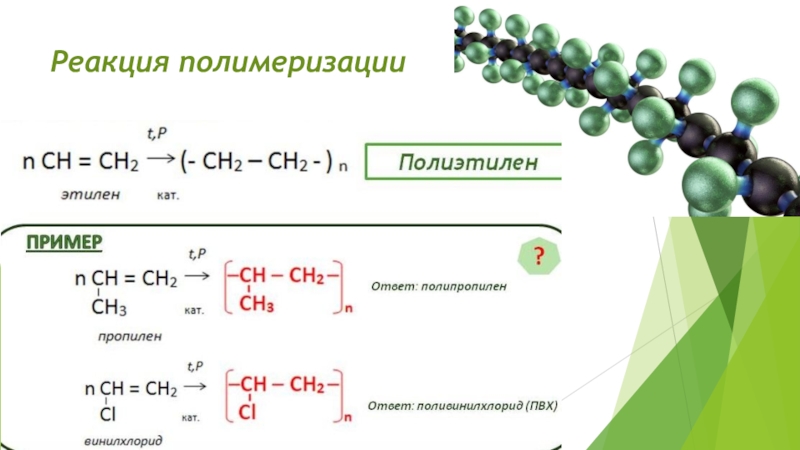
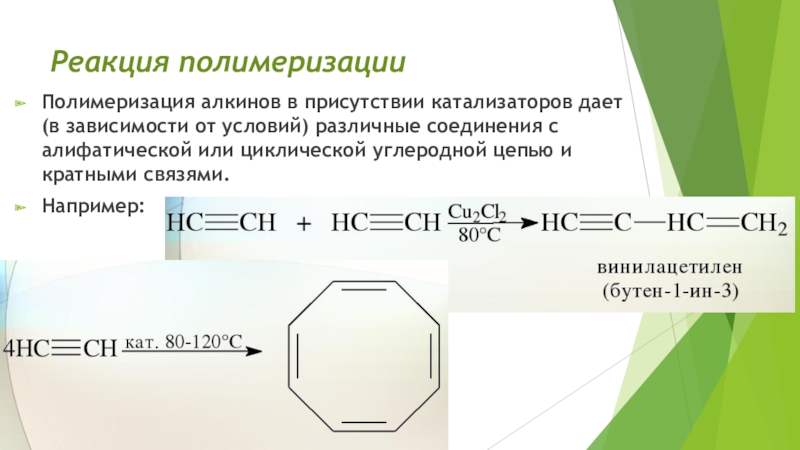
Слайд 21Реакция полимеризации
Полимеризация алкинов в присутствии катализаторов дает (в зависимости
от условий) различные соединения с алифатической или циклической углеродной цепью
и кратными связями.Например:
Слайд 22Нахождение в природе и получение
Встречаются ли алкины в природе?
1) В
промышленности алкины получают реакцией дегидрирования (например из метана при 1500
С)СН4 → СН2≡ СН2+Н2
2) В лаборатории (а раньше и в промышленности) для получения ацетилена используют карбид кальция.
Слайд 25Классификация диенов
Если эти двойные связи разделены двумя и более одинарными
связями, тогда эти вещества ведут себя как обычные алкены. СН2=СН
- СН2 - СН=СН2Если связи находятся рядом (СН2=С=СН-СН3) – образуются т.н. аллены, они нестабильны и практического значения не имеют.
Большое практическое значение имеют диены с сопряженными π-связями (разделенными одной σ-связью). СН2=СН-СН=СН2