Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Альдегиды и кетоны
Содержание
- 1. Альдегиды и кетоны
- 2. Номенклатура кетоновПо заместительной номенклатуре ИЮПАК кетоны называют
- 3. Слайд 3
- 4. По радикально-функциональной номенклатуре (ИЮПАК) кетоны называют, перечисляя
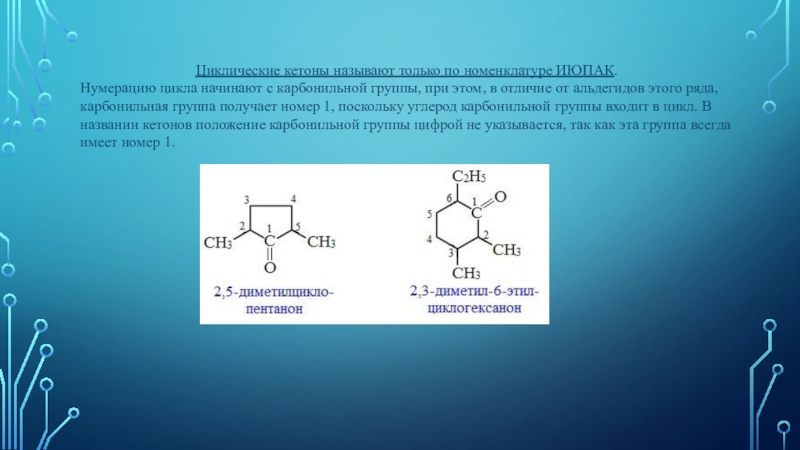
- 5. Циклические кетоны называют только по номенклатуре ИЮПАК.Нумерацию
- 6. Непредельные кетоныКетоны этого ряда называют как по
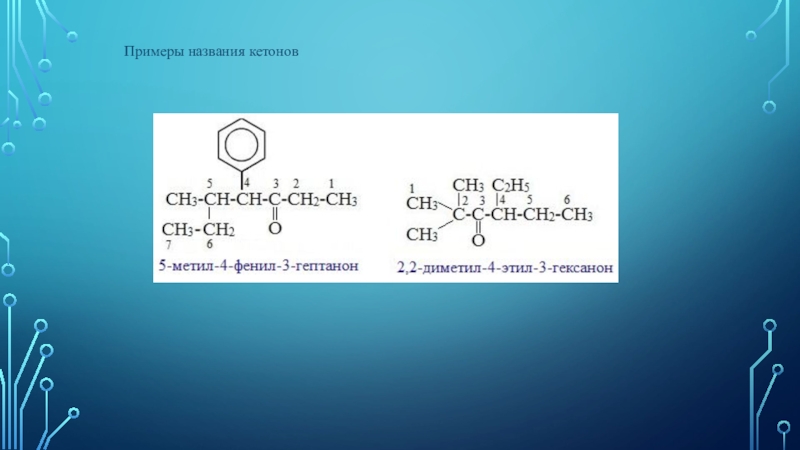
- 7. Примеры названия кетонов
- 8. Свойства всех альдегидов и кетонов зависят от
- 9. Реакции по «-С=О» связи – это реакции
- 10. Следовательно, взаимодействие кетонов с нуклеофилами протекает труднее.Пространственный
- 11. В связи с этим, все реакции альдегидов
- 12. В лабораторных условиях для восстановления альдегидов и
- 13. 3. Взаимодействие со спиртами (в присутствии кислоты
- 14. 4. Гидратация (присоединение воды)Альдегиды в водных растворах
- 15. 6. Взаимодействие с «N» нуклеофилами
- 16. 7. Присоединение гидросульфида натрия (NaHSO3)Реакции окисленияВ молекулах
- 17. 1. Реакция «серебряного зеркала» - окисление аммиачным
- 18. Реакции замещения1. α -ГалогенированиеАльдегиды и кетоны легко
- 19. Реакции конденсации (альдольная и кротоновая конденсация)1. При
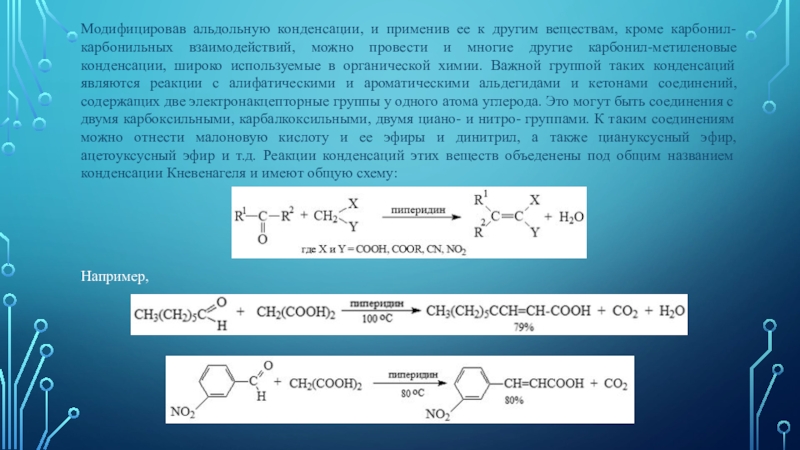
- 20. Модифицировав альдольную конденсации, и применив ее к
- 21. Благодарю за внимание!
- 22. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Номенклатура кетонов
По заместительной номенклатуре ИЮПАК кетоны называют как предельные углеводороды
Слайд 4По радикально-функциональной номенклатуре (ИЮПАК) кетоны называют, перечисляя заместители при кетогруппе
в алфавитном порядке, добавляя слово «кетон».
У некоторых кетонов, также как
и у альдегидов, сохраняются тривиальные названия. Простейший алифатический кетон имеет тривиальное название ацетон.Слайд 5Циклические кетоны называют только по номенклатуре ИЮПАК.
Нумерацию цикла начинают с
карбонильной группы, при этом, в отличие от альдегидов этого ряда,
карбонильная группа получает номер 1, поскольку углерод карбонильной группы входит в цикл. В названии кетонов положение карбонильной группы цифрой не указывается, так как эта группа всегда имеет номер 1.Слайд 6Непредельные кетоны
Кетоны этого ряда называют как по радикально-функциональной номенклатуре (для
кетонов простого строения), так и по систематической международной номенклатуре. В
последнем случае выбирается наиболее длинная цепь, несущая карбонильную группу и кратную связь.К названию соответствующего алкена добавляется окончание «он» и цифрами указывается положение кратной связи и карбонильной группы, которая в этом случае должна получить наименьший номер.
Слайд 8Свойства всех альдегидов и кетонов зависят от распределения электронной плотности
на реакционном центре.
В данном случае реакционным центром является атом карбонила
(атом углерода, принадлежащий -С=О связи).Из-за различий в электроотрицательности электронная плотность смещена от атома «С» к атому «О» на -С=О связи. Поэтому на атоме «С» концентрируется частично-положительный заряд, а на атоме «О» частично-отрицательный.
Они обозначаются соответственно «d+» и «d-».
Высокая полярность –С=О связи приводит к тому, что у соседнего атома углерода(a-атома) повышена полярность связи С-Н. Именно поэтому альдегиды и кетоны в некоторых реакциях имеют возможность вести себя как –С-Н кислоты.
Слайд 9Реакции по «-С=О» связи – это реакции присоединения к атому
«С», заряженному положительно, поэтому может начинать атаку либо частица заряженная
отрицательно, либо часть молекулы, где сконцентрирован частично отрицательный заряд. Это реакции AdN, то есть реакции нуклеофильного присоединения.Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Сравнение реакционной способности альдегидов и кетонов
При сравнении реакционной способности альдегидов и кетонов необходимо учесть 2 фактора: электронный и пространственный.
Альдегиды более реакционноспособны, чем кетоны. Кетоны реагируют обычно в более жестких условиях, чем альдегиды, а в некоторые реакции даже и не вступают.
Электронный фактор связан с величиной положительного заряда на карбонильном атоме углерода и влиянием на него электронодонорных эффектов заместителей R и R'.
В молекулах кетонов на карбонильный атом углерода действуют индуктивные эффекты двух углеводородных радикалов R и R', а в молекулах альдегидов одного радикала R, поэтому в случае кетонов величина положительного заряда на этом атоме меньше.
Слайд 10Следовательно, взаимодействие кетонов с нуклеофилами протекает труднее.
Пространственный фактор связан с
доступностью реакционного центра (Cδ+) для нуклеофильной атаки, а это зависит
от размеров заместителей R и R'.В молекулах альдегидов (содержат один радикал R) карбонильный атом углерода оказывается более доступен по сравнению с кетонами, поэтому нуклеофильные реакции для альдегидов протекают легче, чем для кетонов.
Реакционная способность карбонильных соединений определяется величиной частичного положительного заряда «δ+» на атоме углерода в карбонильной группе. Чем этот заряд больше, тем выше химическая активность карбонильного соединения.
Поэтому, чем большее количество электронной плотности «подходит» к атому карбонила, тем меньше величина частично положительного заряда «δ+» (минус «гасит» плюс). А значит снижается реакционная способность.
Слайд 11В связи с этим, все реакции альдегидов и кетонов можно
разделить на несколько групп: реакции присоединения, реакции замещения, реакции присоединения,
конденсации и специфические реакции(например, реакция диспропорционирования).Реакции присоединения
Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AdN.
Общая схема:
1. Гидрирование (восстановление)
Слайд 12В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид
лития (LiAlH4):
2. Присоединение циановодородной (синильной) кислоты НСN
Альдегиды и кетоны, взаимодействуя
с синильной кислотой, образуют циангидрины – органические соединения, молекулы которых содержат две функциональные группы: циано-группу и гидроксильную –ОН.Присоединение идет в соответствии с распределением электронной плотности в молекулах:
в дальнейшем можно получить гидроксикислоту
Слайд 133. Взаимодействие со спиртами (в присутствии кислоты или основания как
катализатора)
Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя
соответственно полуацетали или ацетали.Полуацетали — соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (ОR) группы.
Ацетали – это соединения, содержащие при одном атоме углерода две алкоксильные группы.
В щелочной среде: В кислой среде:
Слайд 144. Гидратация (присоединение воды)
Альдегиды в водных растворах существуют в виде
гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
5.
Присоединение реактива Гриньяра — образование спиртовВ зависимости от того, альдегид или кетон, получается первичный, вторичный или третичный спирт
Слайд 167. Присоединение гидросульфида натрия (NaHSO3)
Реакции окисления
В молекулах альдегидов атом углерода
карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны
связи С-Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению.Альдегиды легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С-Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(ОН)=О.
Слайд 171. Реакция «серебряного зеркала» - окисление аммиачным раствором оксида серебра
(реактив Толленса)
Качественная реакция на альдегидную группу!
2. Окисление гидроксидом меди (II)
Качественная
реакция на альдегидную группу!Для реакции используют свежеприготовленный Cu(ОН)2, образующийся при взаимодействии растворимой соли меди (II) со щелочью.
Голубая суспензия гидроксида меди (II) при нагревании с альдегидом приобретает окраску оранжево-красного осадка оксида меди (I):
Слайд 18Реакции замещения
1. α -Галогенирование
Альдегиды и кетоны легко вступают в реакцию
с галогенами (Cl2, Br2, I2) с образованием ɑ-галогенпроизводных.
Такой эффект наблюдается
только для ɑ-атома углерода, т.е атома, следующего за альдегидной группой, независимо от длины углеродного радикала.2. Галоформная реакция (проба Люголя, если реакция идёт с йодом)
Качественная реакция на метилкетоны и ацетальдегид!
Галоформная реакция – обработка карбонильного соединения избытком галогена в присутствии щелочи. Выпадение осадка галоформа указывает на наличие в исходном соединении метильной группы, связанной с карбонилом:
Слайд 19Реакции конденсации (альдольная и кротоновая конденсация)
1. При альдольной конденсации происходит
присоединение одной молекулы карбонильного соединения к другой молекуле, образуется альдегидоспирт
(альдоль) или кетоспирт.Альдольная конденсация широко используется в промышленности для получения синтетических каучуков, смол, лаков и различных душистых веществ.
2. При кротоновой конденсации образуется молекула непредельного альдегида или кетона. Химическая реакция сопровождается выделением молекулы воды.
Реакция проводится в более жестких условиях (при нагревании или в присутствии кислоты) альдоль дегидратируется с образованием кротонового альдегида:
Слайд 20Модифицировав альдольную конденсации, и применив ее к другим веществам, кроме
карбонил-карбонильных взаимодействий, можно провести и многие другие карбонил-метиленовые конденсации, широко
используемые в органической химии. Важной группой таких конденсаций являются реакции с алифатическими и ароматическими альдегидами и кетонами соединений, содержащих две электронакцепторные группы у одного атома углерода. Это могут быть соединения с двумя карбоксильными, карбалкоксильными, двумя циано- и нитро- группами. К таким соединениям можно отнести малоновую кислоту и ее эфиры и динитрил, а также циануксусный эфир, ацетоуксусный эфир и т.д. Реакции конденсаций этих веществ объеденены под общим названием конденсации Кневенагеля и имеют общую схему:Например,