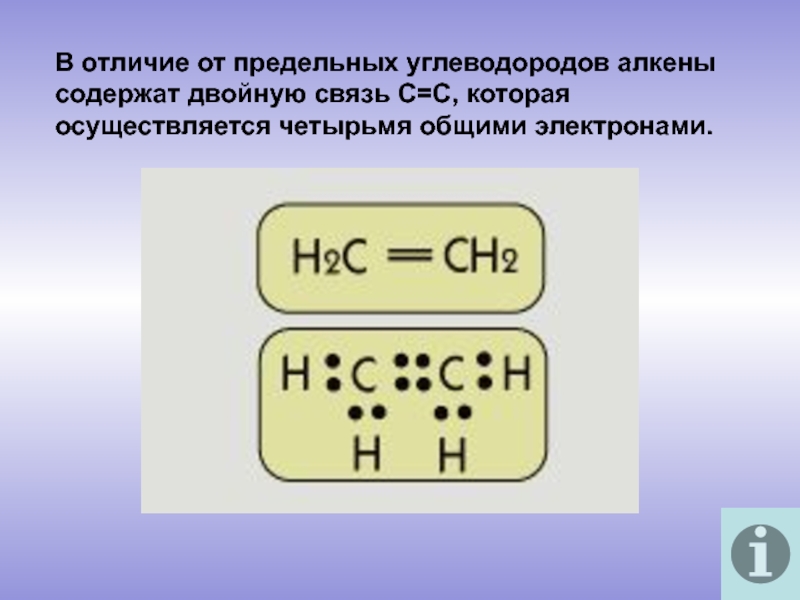
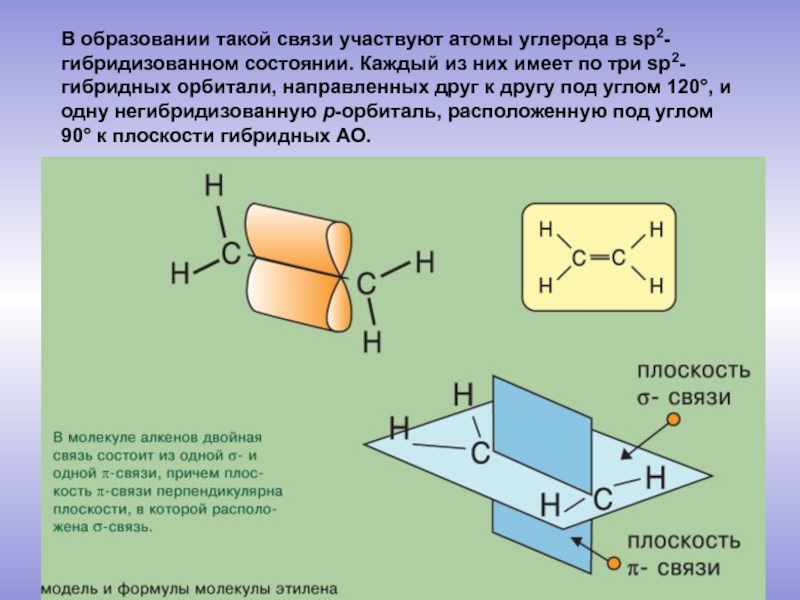
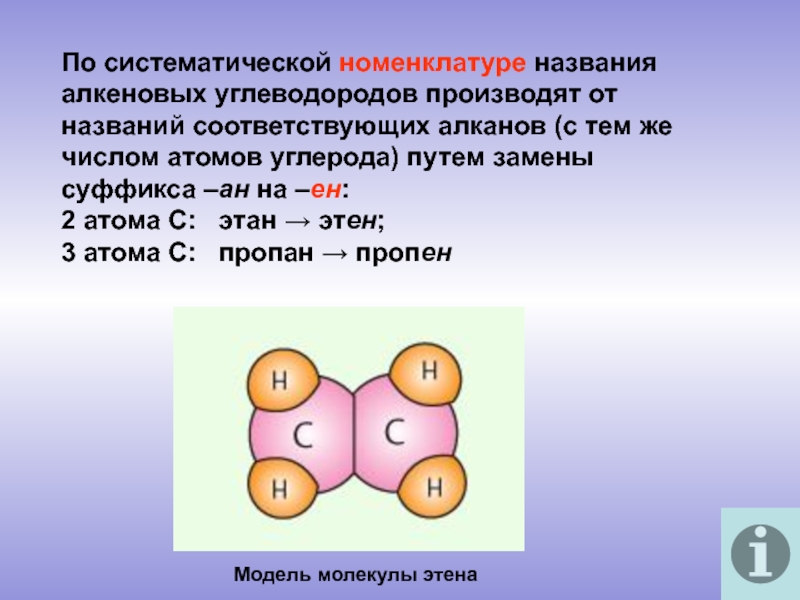
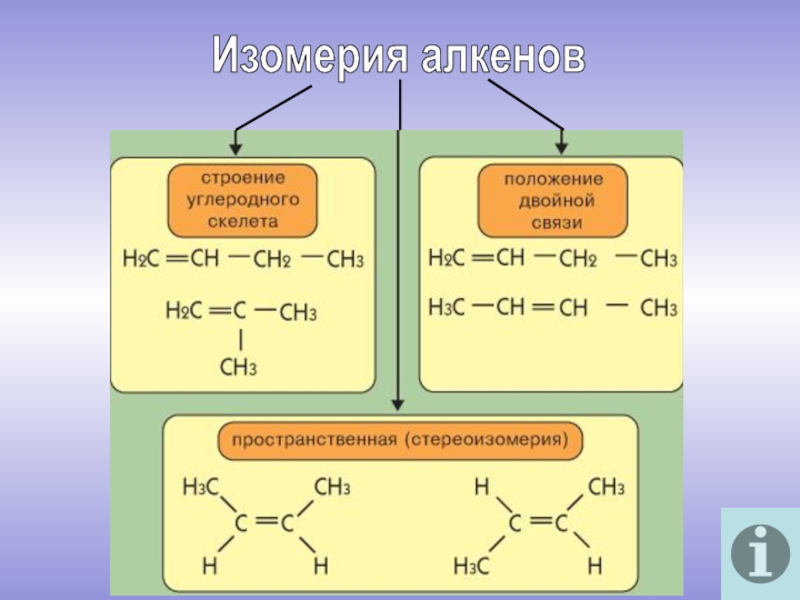
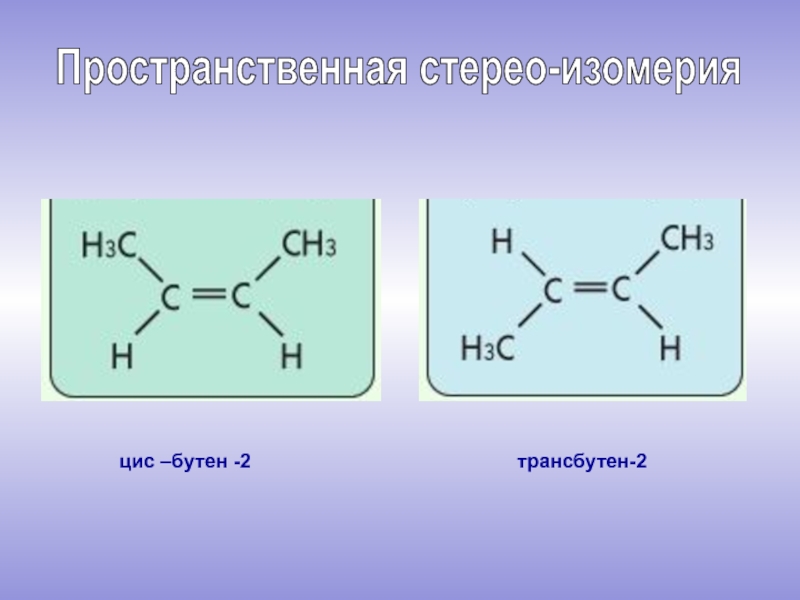
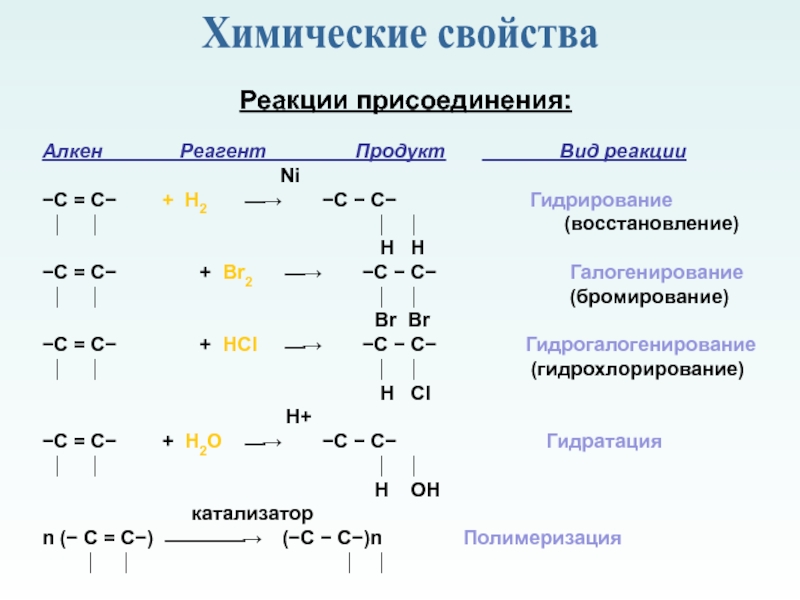
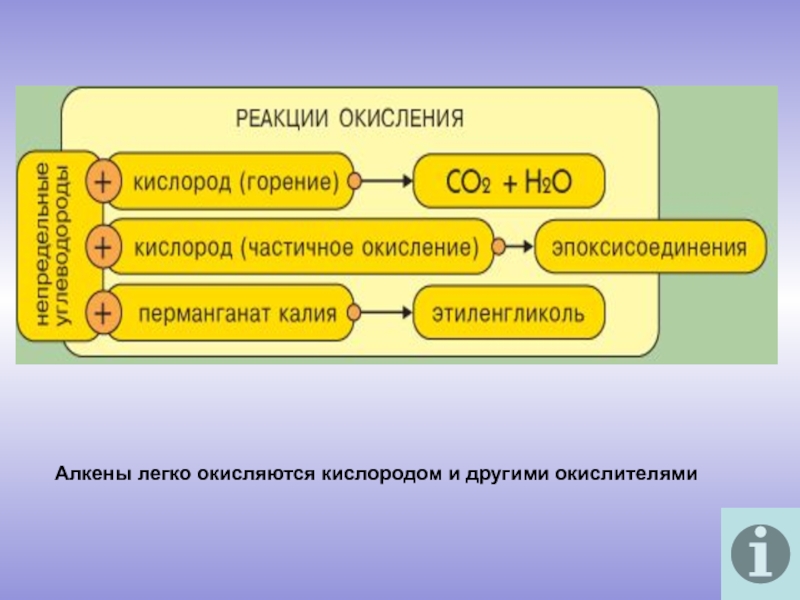
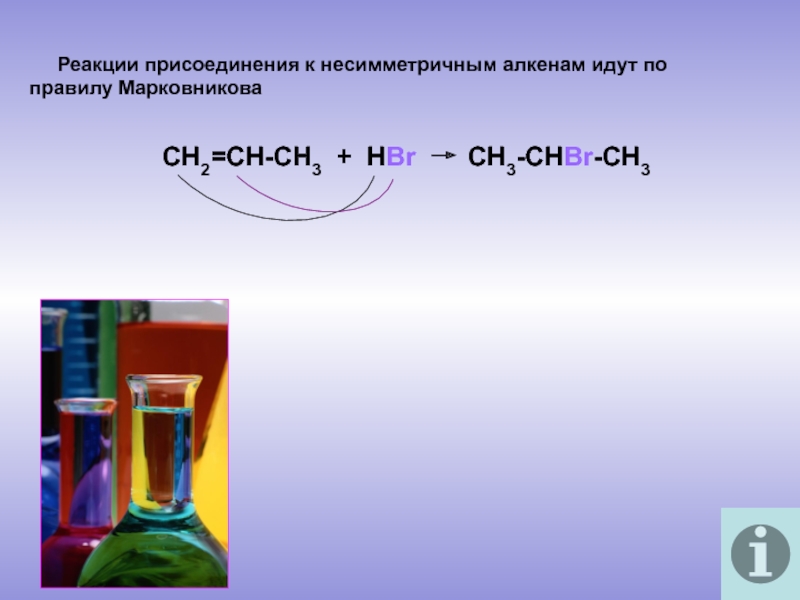
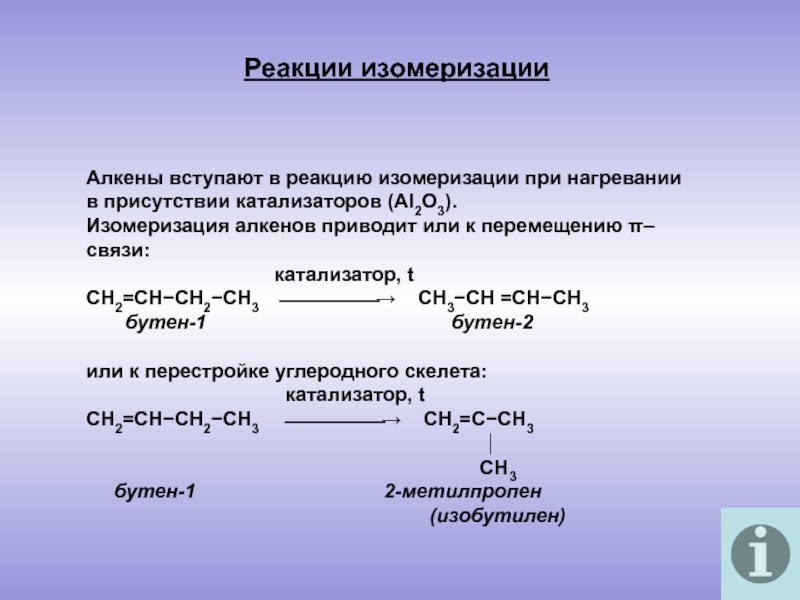
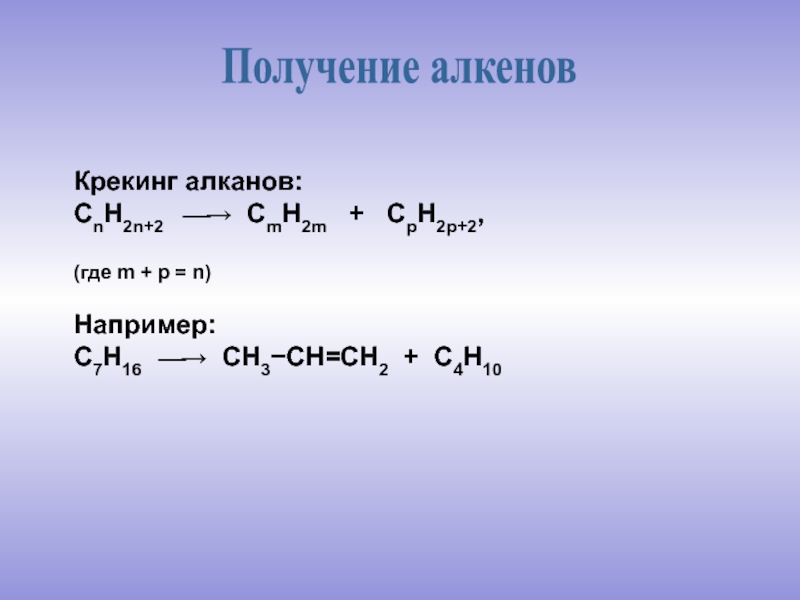
молекулы которых содержат двойную связь.
Общая формула ряда алкенов СnH2n
Простейшие представители:
С2Н4 С3Н6 С4Н8СН2=СН2 СН2=СН–СН3 СН2=СН–СН2–СН3
этилен пропилен бутилен-1
(этен) (пропен) (бутен-1)