Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкины (ацетиленовые УВ)
Содержание
- 1. Алкины (ацетиленовые УВ)
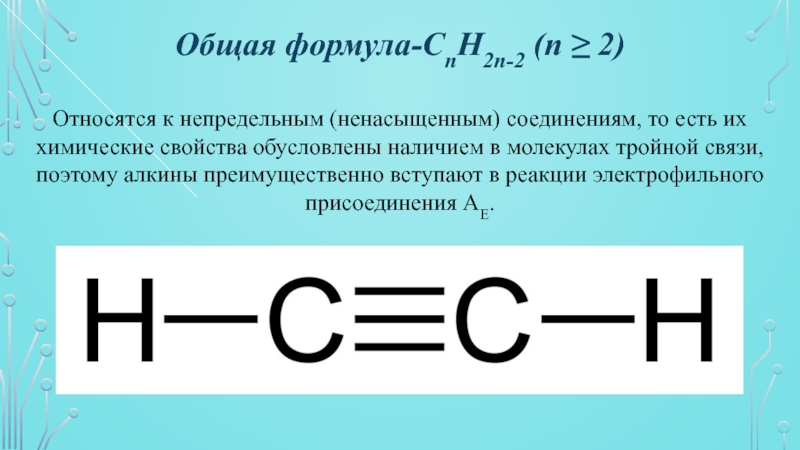
- 2. Общая формула-CnH2n-2 (n ≥ 2)Относятся к непредельным
- 3. 1. Способы полученияПромышленныеЛабораторные
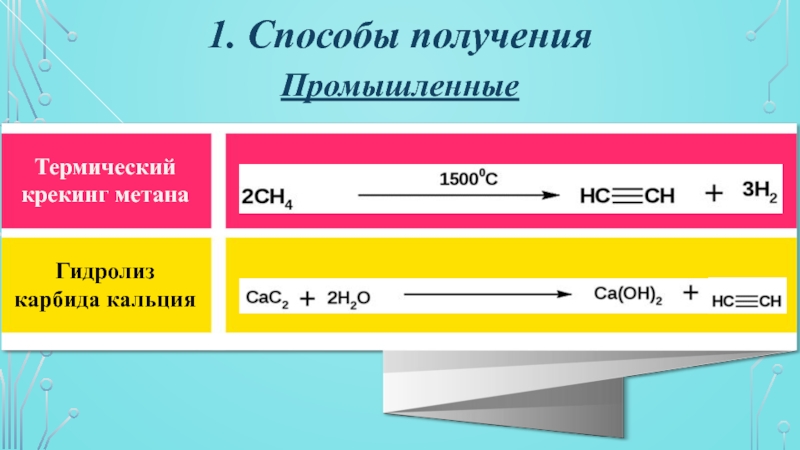
- 4. 1. Способы полученияПромышленныеТермический крекинг метанаГидролиз карбида кальция
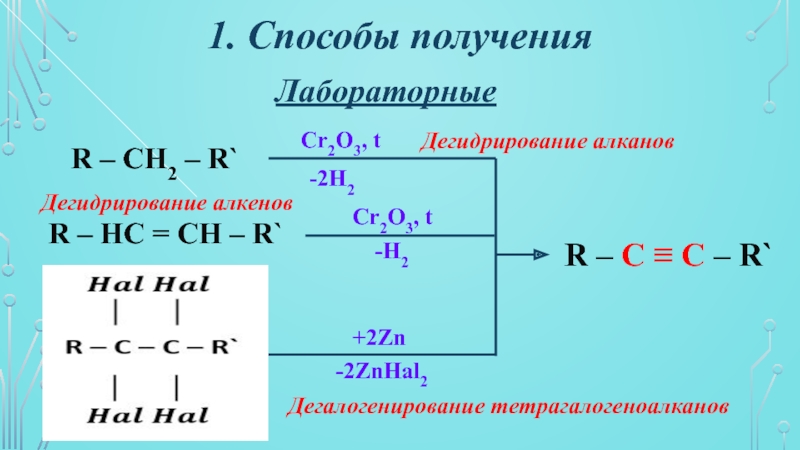
- 5. Лабораторные1. Способы полученияR – CH2 – R`R
- 6. 1. Способы полученияЛабораторныеПравило ЗайцеваВодород отщепляется от соседнего наименее гидрированного атома углерода.
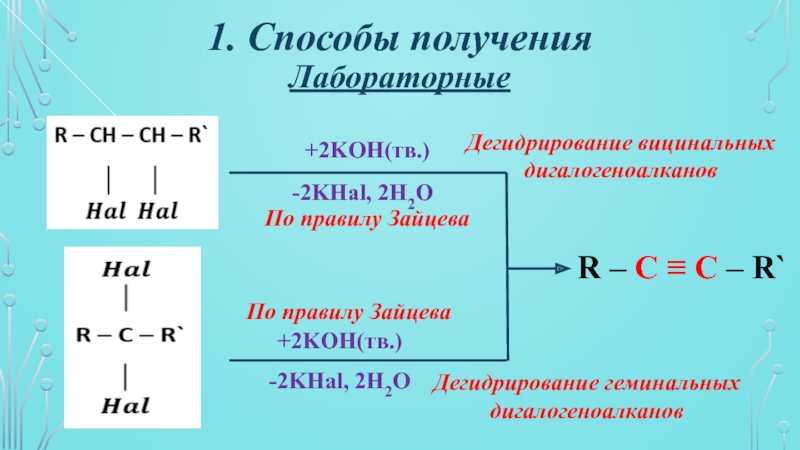
- 7. 1. Способы полученияЛабораторные+2KOH(тв.)+2KOH(тв.)-2KHal, 2H2O-2KHal, 2H2OR – C
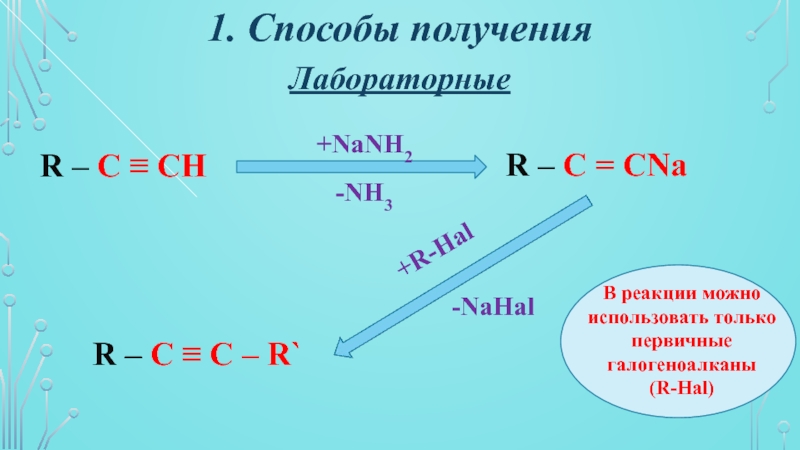
- 8. 1. Способы полученияЛабораторныеR – C ≡ CH
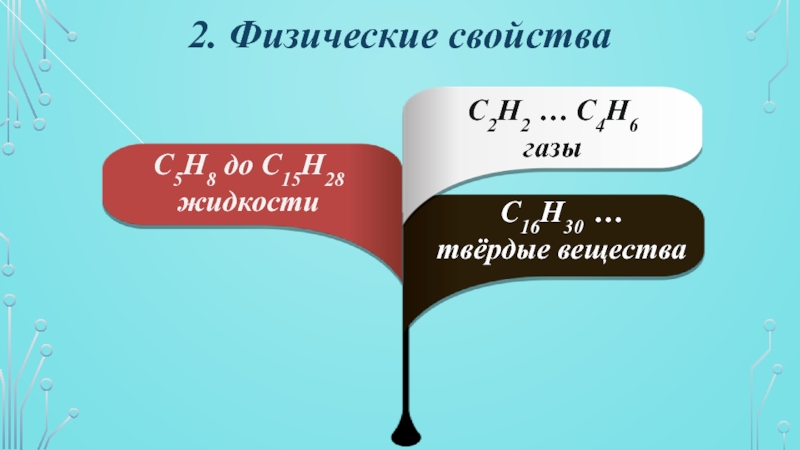
- 9. 2. Физические свойстваС2Н2 … С4Н6 газыС5Н8 до С15Н28жидкостиС16Н30 …твёрдые вещества
- 10. 2. Физические свойстваС2Н2 С3Н4 С4Н6
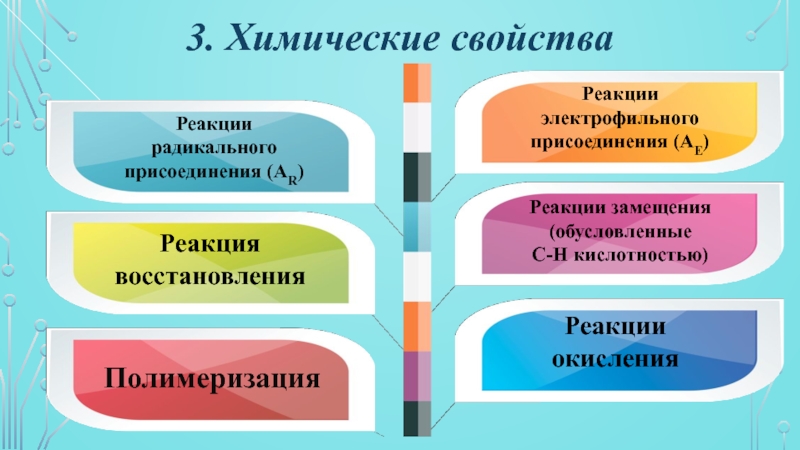
- 11. 3. Химические свойстваРеакции электрофильного присоединения (АЕ)Реакции радикального присоединения (АR)Реакции замещения (обусловленные С-Н кислотностью)Реакция восстановленияРеакции окисленияПолимеризация
- 12. 3. Химические свойстваРеакции электрофильного присоединения (АЕ)R-C≡C-R'+2HHalГидрогалогенированиеГидратация по
- 13. Правило МарковниковаЭлектрофил присоединяется к наиболее гидрированному атому углерода при кратной связи.
- 14. Реакции радикального присоединения (АR)3. Химические свойстваR-C≡C-R'+HНаl,H2O2Против правила Марковникова
- 15. 3. Химические свойстваРеакции замещения (обусловленные С-Н кислотностью)Особенностью
- 16. 3. Химические свойстваРеакции замещения (обусловленные С-Н кислотностью)R-C≡CHR
- 17. 3. Химические свойстваРеакции замещения (обусловленные С-Н кислотностью)R-C≡CHR
- 18. 3. Химические свойстваРеакция восстановленияR-C≡C-R'R –HC = CH – R`R –H2C – CH2 – R`+H2Ni; to+H2Ni; to
- 19. 3. Химические свойстваРеакции окисленияПолное окислениеНеполное окислениеR-C≡C-R'R-C≡CНCO2 +
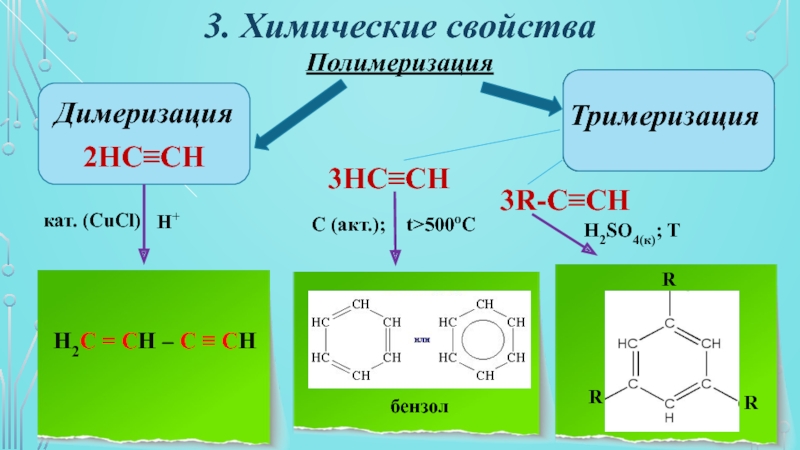
- 20. 3. Химические свойстваПолимеризацияДимеризацияТримеризация2НC≡CН3НC≡CН3R-C≡CНH2C = CH – C ≡ CH бензолRкат. (CuCl)H+C (акт.);t>500oCH2SO4(к); TRR
- 21. Скачать презентанцию
Общая формула-CnH2n-2 (n ≥ 2)Относятся к непредельным (ненасыщенным) соединениям, то есть их химические свойства обусловлены наличием в молекулах тройной связи, поэтому алкины преимущественно вступают в реакции электрофильного присоединения AE.
Слайды и текст этой презентации
Слайд 5Лабораторные
1. Способы получения
R – CH2 – R`
R – HC =
CH – R`
Cr2O3, t
-2H2
Дегидрирование алканов
Cr2O3, t
-H2
Дегидрирование алкенов
+2Zn
-2ZnHal2
Дегалогенирование тетрагалогеноалканов
R – C
≡ C – R`Слайд 61. Способы получения
Лабораторные
Правило Зайцева
Водород отщепляется от соседнего наименее гидрированного атома
углерода.
Слайд 71. Способы получения
Лабораторные
+2KOH(тв.)
+2KOH(тв.)
-2KHal, 2H2O
-2KHal, 2H2O
R – C ≡ C –
R`
Дегидрирование вицинальных дигалогеноалканов
Дегидрирование геминальных дигалогеноалканов
По правилу
ЗайцеваПо правилу Зайцева
Слайд 81. Способы получения
Лабораторные
R – C ≡ CH
R – C
= CNa
R – C ≡ C – R`
+NaNH2
-NH3
+R-Hal
-NaHal
В реакции
можно использовать только первичные галогеноалканы (R-Hal)
Слайд 102. Физические свойства
С2Н2 С3Н4 С4Н6 С5Н8…
t кип.
увеличивается
Плохо растворимы в воде, но хорошо растворимы
в обычных органических
растворителях с низкой полярностью(бензоле, эфире, лигроине,четырёххлористом углероде).
t кип. и t пл. алкинов > t кип. и t пл. соответствующих
алкенов
Слайд 113. Химические свойства
Реакции
электрофильного
присоединения (АЕ)
Реакции
радикального
присоединения (АR)
Реакции замещения
(обусловленные
С-Н кислотностью)
Реакция
восстановления
Реакции
окисления
Полимеризация
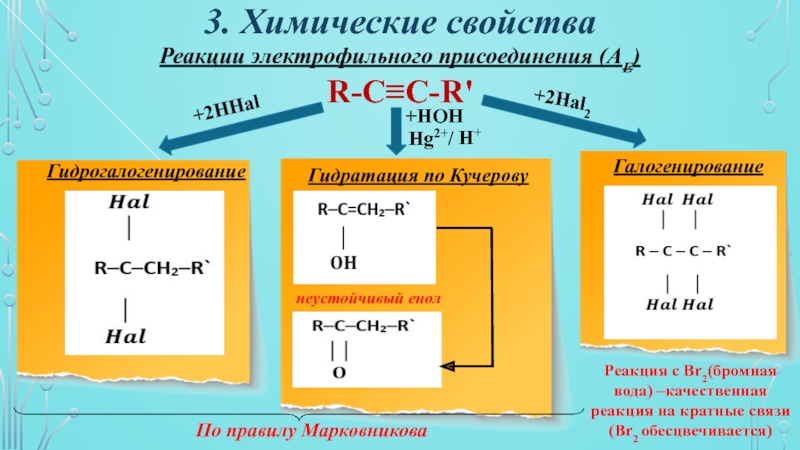
Слайд 123. Химические свойства
Реакции электрофильного присоединения (АЕ)
R-C≡C-R'
+2HHal
Гидрогалогенирование
Гидратация по Кучерову
Галогенирование
+2Hal2
+HOH
Hg2+/
H+
неустойчивый енол
По правилу
Марковникова
Реакция с Br2(бромная вода) –качественная реакция на кратные связи (Br2
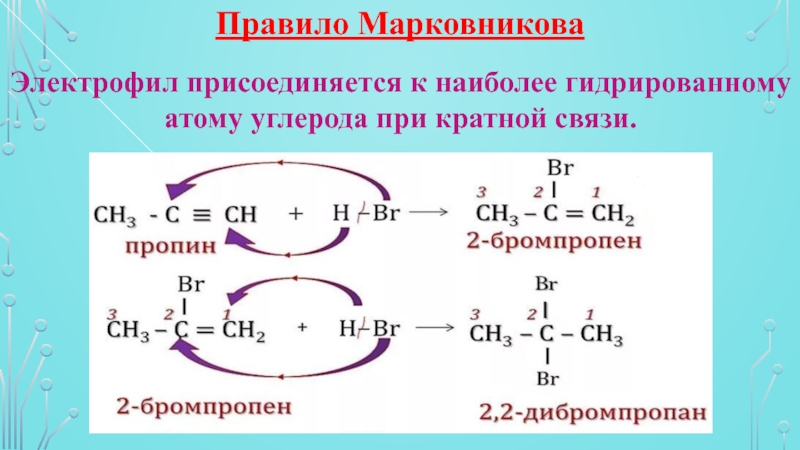
обесцвечивается)Слайд 13Правило Марковникова
Электрофил присоединяется к наиболее гидрированному атому углерода при кратной
связи.
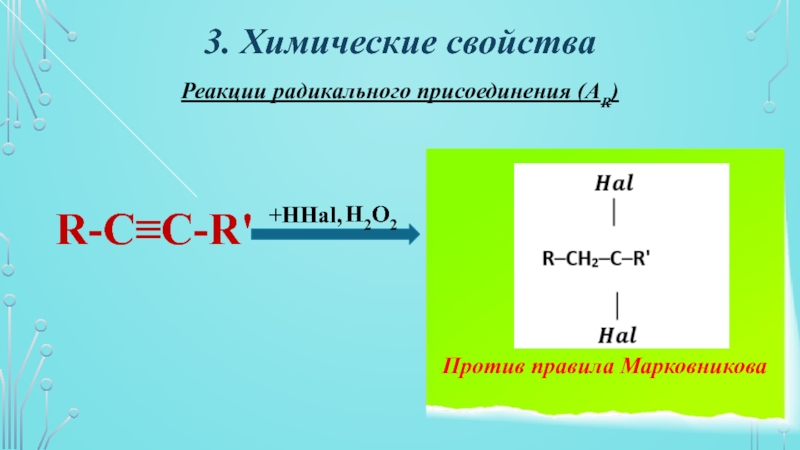
Слайд 14Реакции радикального присоединения (АR)
3. Химические свойства
R-C≡C-R'
+HНаl,
H2O2
Против правила Марковникова
Слайд 153. Химические свойства
Реакции замещения (обусловленные С-Н кислотностью)
Особенностью алкинов,
имеющих концевую тройную
связь, является их способность отщеплять протон под действием сильных оснований,
то есть проявлять слабые кислотные свойства. Алкины, в отличие от алкенов и алканов, способны образовывать соли-ацетиленидыR-C≡CMe
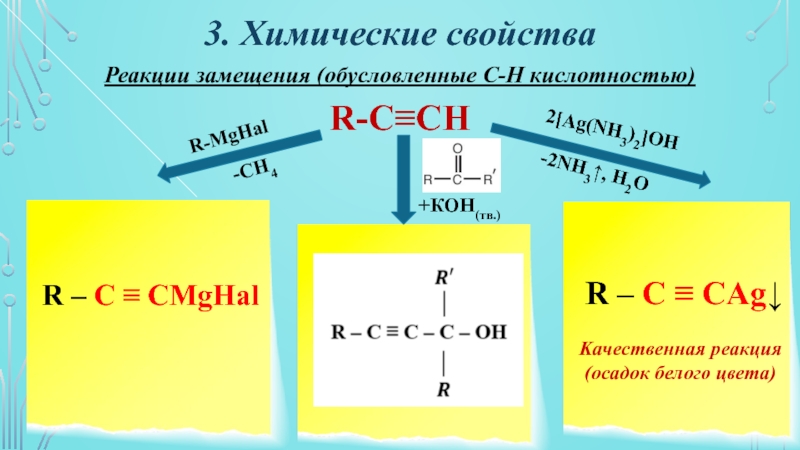
Слайд 163. Химические свойства
Реакции замещения (обусловленные С-Н кислотностью)
R-C≡CH
R – C ≡
CMgHаl
R-MgHal
-CH4
R – C ≡ CAg↓
Kачественная реакция
(осадок белого цвета)
2[Ag(NH3)2]OH
-2NH3↑,
H2O+КОН(тв.)
Слайд 173. Химические свойства
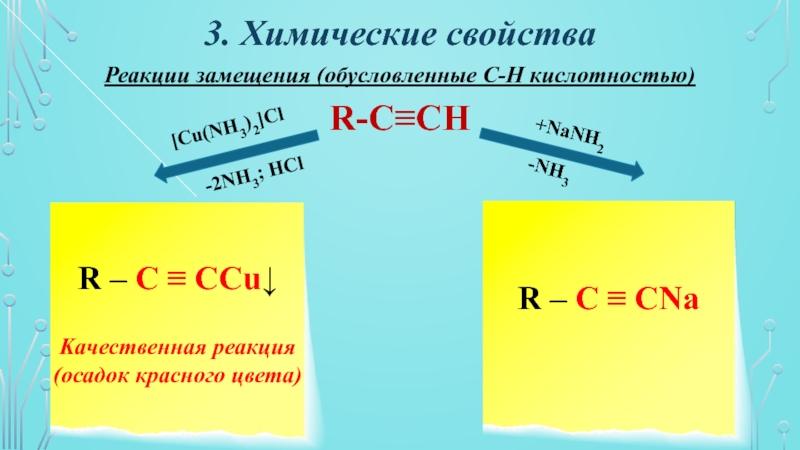
Реакции замещения (обусловленные С-Н кислотностью)
R-C≡CH
R – C ≡
CCu↓
Kачественная реакция
(осадок красного цвета)
R – C ≡ CNa
+NaNH2
-NH3
[Cu(NH3)2]Cl
-2NH3; HCl
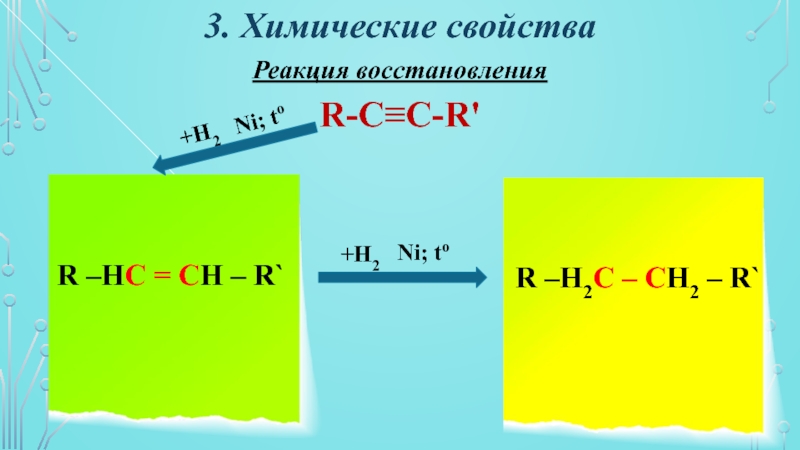
Слайд 183. Химические свойства
Реакция восстановления
R-C≡C-R'
R –HC = CH – R`
R –H2C
– CH2 – R`
+H2
Ni; to
+H2
Ni; to
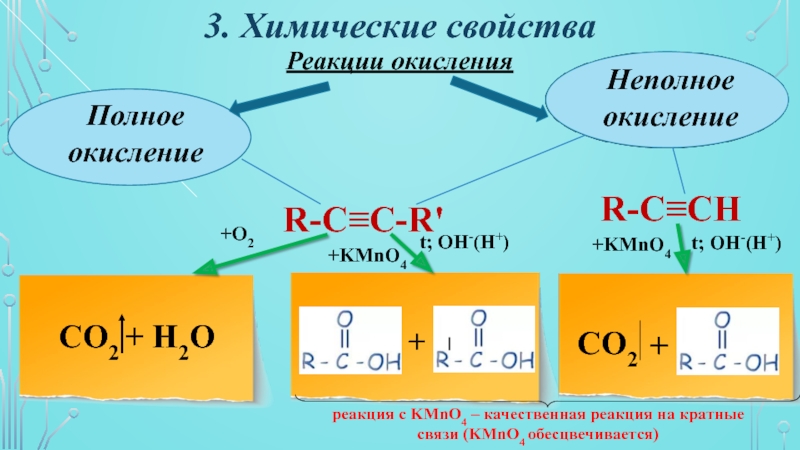
Слайд 193. Химические свойства
Реакции окисления
Полное
окисление
Неполное
окисление
R-C≡C-R'
R-C≡CН
CO2 + H2O
+O2
+KМnO4
t; OH-(H+)
+KМnO4
реакция с
KMnO4 – качественная реакция на кратные связи (KMnO4 обесцвечивается)
t; OH-(H+)
+
CO2
+