элементов вспомним некоторые базовые понятия и принципы.
Главный принцип: свойства материальной
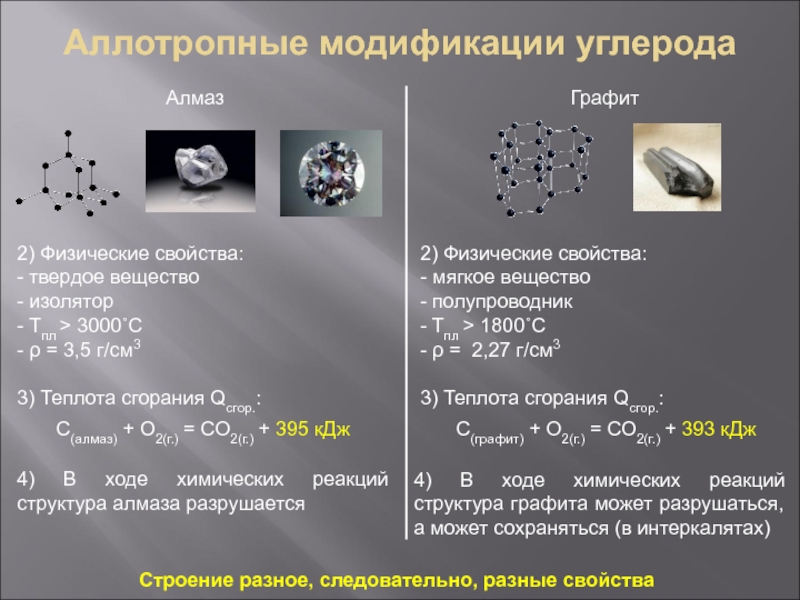
системы определяются её составом и строением. Этот принцип является общим принципом природы, мы будем его применять по отношению к веществам. Если состав двух веществ одинаков, но строение различное, то и свойства у этих веществ будут разными. Одним из самых ярких примеров являются графит и алмаз – оба эти вещества состоят только из атомов углерода, но соединены эти атомы по-разному, что приводит к кардинально различающимся свойствам:
Строение кристаллических решеток алмаза (а) и графита (б) и изображения самородного алмаза и графита
а)
б)
Подробнее эти вещества будут рассмотрены ниже.